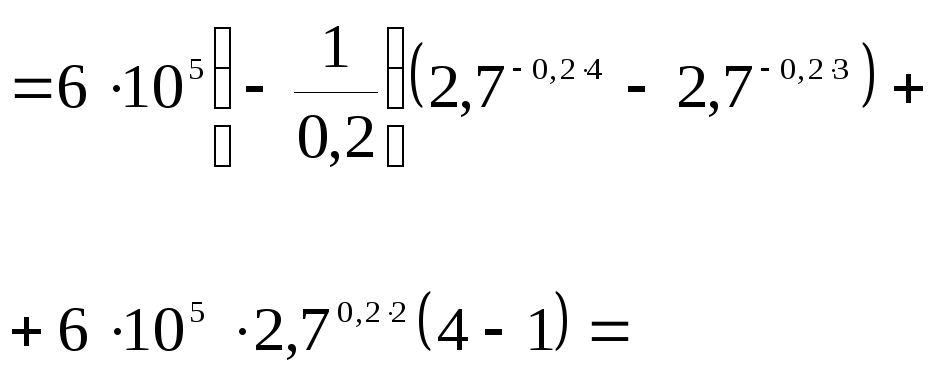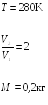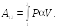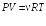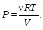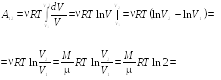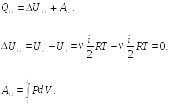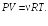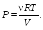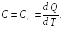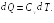- •Курс физики
- •Механика глава 1. Кинематика и динамика частицы § 1. Путь и перемещение
- •§ 2. Скорость и ускорение
- •§ 3. Сила и работа
- •Глава 2. Кинематика и динамика вращения твердого тела § 4. Угловая скорость и угловое ускорение
- •§ 5. Средняя скорость и среднее ускорение
- •§ 6. Момент силы
- •Глава 3. Законы сохранения § 7. Механическая энергия. Закон сохранения механической энергии
- •§ 8. Импульс. Закон сохранения импульса
- •§ 9. Момент импульса. Закон сохранения момента импульса
- •Глава 4. Механические колебания § 10. Гармонические колебания
- •§ 11. Затухающие колебания
- •§ 12. Вынужденные колебания
- •Глава 5. Механические волны § 13. Гармонические волны
- •§ 14. Плоская гармоническая волна
- •Экзаменационные вопросы 1
- •Контрольные задания 1 Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •Вариант 26
- •Вариант 27
- •Вариант 28
- •Вариант 29
- •Вариант 30
- •Приложение а
- •Молекулярная физика глава 6. Кинетическая теория газов § 15. Уравнение состояния идеального газа
- •§ 16. Внутренняя энергия идеального газа
- •§ 17. Распределение Максвелла
- •§ 18. Барометрическая формула
- •§ 19. Распределение Больцмана
- •§ 20. Явления переноса
- •Глава 7. Термодинамика § 21. Термодинамическая система и термодинамический процесс
- •§ 22. Первый закон термодинамики
- •§ 23. Теплоемкость идеального газа
- •§ 24. Адиабатический процесс
- •§ 25. Энтропия
- •§ 26. Второй и третий законы термодинамики
- •Глава 8. Реальные газы § 27. Силы межмолекулярного взаимодействия в газах
- •§ 28. Агрегатное состояние вещества
- •§ 29. Уравнение Ван-дер-Ваальса
- •§ 30. Внутренняя энергия реального газа
- •Экзаменационные вопросы 2
- •Контрольные задания 2 Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •Вариант 26
- •Вариант 27
- •Вариант 28
- •Вариант 29
- •Вариант 30
- •Приложение б
- •Электромагнетизм глава 9. Электрическое поле в вакууме § 31. Напряженность поля
- •§ 32. Поток вектора
- •§ 33. Теорема Гаусса для поля вектора
- •§ 34. Циркуляция вектора
- •§ 35. Потенциал поля
- •§ 36. Связь между φ и
- •Глава 10. Электрическое поле в диэлектрике § 37. Диполь в электрическом поле
- •§ 38. Поляризация диэлектрика
- •§ 39. Вектор
- •Глава 11. Энергия электрического поля § 40. Электроемкость
- •§ 41. Электроемкость плоского конденсатора
- •§ 42. Энергия электрического поля
- •Глава 12. Электрический ток § 43. Электрический ток
- •§ 44. Закон Ома для проводника
- •§ 45. Обобщенный закон Ома
- •§ 46. Закон Джоуля – Ленца
- •Глава 13. Магнитное поле в вакууме § 47. Магнитная индукция
- •§ 48. Закон Био – Савара
- •§ 49. Теорема Гаусса для поля вектора
- •§ 50. Теорема о циркуляции вектора
- •§ 51. Магнитное поле в соленоиде
- •§ 52. Закон Ампера
- •Глава 14. Магнитное поле в веществе § 53. Контур с током в магнитном поле
- •§ 54. Намагничивание магнетика
- •§ 55. Вектор
- •Глава 15. Энергия магнитного поля § 56. Индуктивность
- •§ 57. Электромагнитная индукция
- •§ 58. Энергия магнитного поля
- •Глава 16. Электромагнитные волны § 59. Вихревое электрическое поле
- •§ 60. Ток смещения
- •§ 61. Система уравнений Максвелла
- •§ 62. Электромагнитные волны
- •Глава 17. Волновая оптика § 63. Свет
- •§ 64. Интерференция света
- •§ 65. Дифракция света
- •§ 66. Поглощение света
- •§ 67. Рассеяние света
- •§ 68. Поляризация света
- •§ 69. Закон Малюса
- •§ 70. Вращение плоскости поляризации
- •Контрольные задания 3 Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •Вариант 26
- •Вариант 27
- •Вариант 28
- •Вариант 29
- •Вариант 30
- •Экзаменационные вопросы 3
- •Приложение в
- •Квантовая физика глава 18. Квантовая оптика § 71. Тепловое излучение
- •§ 72. Закон Кирхгофа
- •§ 73. Законы теплового излучения черного тела
- •§ 74. Формула Планка
- •§ 75. Фотоэффект
- •§ 76. Формула Эйнштейна для фотоэффекта
- •§ 77. Фотон
- •§ 78. Эффект Комптона
- •Глава 19. Квантовая механика § 79. Волны де Бройля
- •§ 80. Волновая функция
- •§ 81. Соотношение неопределенностей Гейзенберга
- •§ 82. Уравнение Шредингера
- •§ 83. Микрочастица в потенциальном ящике
- •Глава 20. Атомная физика § 84. Атом водорода
- •§ 85. Излучение и поглощение света атомом водорода
- •§ 86. Пространственное квантование
- •§ 87. Принцип Паули
- •Глава 21. Зонная теория твердых тел § 88. Металлы, полупроводники и диэлектрики
- •§ 89. Электронно-дырочная проводимость полупроводников
- •§ 90. Примесные полупроводники
- •Глава 22. Ядерная физика § 92. Строение атомного ядра
- •§ 93. Энергия связи ядра
- •§ 94. Радиоактивность
- •Контрольные задания 4 Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •Вариант 26
- •Вариант 27
- •Вариант 28
- •Вариант 29
- •Вариант 30
- •Экзаменационные вопросы 4
- •Приложение г
- •Оглавление
§ 22. Первый закон термодинамики
Обозначим
![]() приращение внутренней энергии системы
при переходе системы из состояния 1 в
состояния 2. Приращение энергии
приращение внутренней энергии системы
при переходе системы из состояния 1 в
состояния 2. Приращение энергии
![]() может происходить или за счет сообщения
системы количества тепла
может происходить или за счет сообщения
системы количества тепла
![]() ,
или за счет совершения над системой
работы
,
или за счет совершения над системой
работы
![]() .
Можем написать
.
Можем написать
![]()
(22.1)
Если
система совершает работу
![]() над внешними телами, то выражение (22.1)
принимает вид
над внешними телами, то выражение (22.1)
принимает вид
![]()
или
![]()
(22.2)
Соотношение (22.2) выражает первый закон термодинамики: количество тепла, сообщенное системе, идет на приращение внутренней энергии системы и на совершение системой работы над внешними телами.
Первый закон термодинамики обычно записывают в виде
![]()
(22.3)
где
![]() — элементарное (очень малое) количество
тепла, сообщенное системе;
— элементарное (очень малое) количество
тепла, сообщенное системе;
![]() — элементарное (очень малое) приращение
внутренней энергии системы;
— элементарное (очень малое) приращение
внутренней энергии системы;
![]() — элементарная работа, совершенная
системой над внешними телами.
— элементарная работа, совершенная
системой над внешними телами.
Отметим,
что в отличие от внутренней энергии
количество тепла
![]() и работа
и работа
![]() не являются функциями состояния, а
зависят от способа теплопередачи и
совершения работы. Это выражается,
например, в том, что
не являются функциями состояния, а
зависят от способа теплопередачи и
совершения работы. Это выражается,
например, в том, что
![]()
но нельзя написать, что
![]() и
и
![]()
Количество тепла, сообщаемое системе в процессе 12,
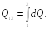
(22.4)
Если
к системе подводится тепло,
![]() >
>
![]() ,
если тепло отводится от системы,
,
если тепло отводится от системы,
![]() <
<
![]() .
.
Работа, совершаемая системой над внешними телами в процессе 12,
![]() (22.5)
(22.5)
![]()
Если
система совершает работу над внешними
телами,
![]() >
>
![]() ,
если внешние тела совершают работу над
системой,
,
если внешние тела совершают работу над
системой,
![]() <
<
![]() .
.
Получим
выражение для работы, совершаемой
системой. Рассмотрим процесс расширения
газа, заключенного в сосуде с подвижным
поршнем площадью
![]() (рис. 22.1).
Сила, действующая на поршень при
расширении газа,
(рис. 22.1).
Сила, действующая на поршень при
расширении газа,
![]()
где
![]() — давление газа на поршень.
— давление газа на поршень.
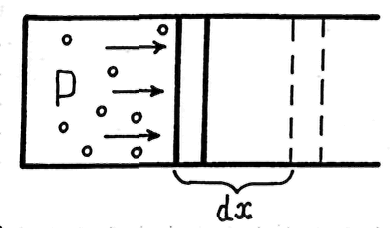
Рис. 22.1
При
элементарном перемещении
![]() поршня газ совершает элементарную
работу
поршня газ совершает элементарную
работу
(![]() 22.6)
22.6)
где
![]() — элементарное
приращение объема газа.
— элементарное
приращение объема газа.
Если
при расширении газа его объем изменился
от
![]() до
до
![]() ,
работа, совершенная газом,
,
работа, совершенная газом,
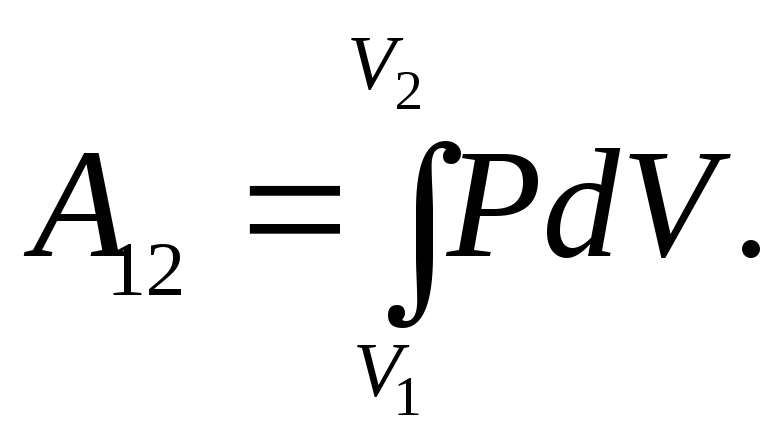
(22.7)
Пример
22.1. Газ
совершает процесс, в ходе которого
давление
![]() изменяется с объемом
изменяется с объемом
![]() по закону
по закону
![]() ,
где
,
где
![]()
![]()
![]() Найти работу
Найти работу
![]() ,
совершаемую газом при расширении от
,
совершаемую газом при расширении от
![]() до
до
![]()
|
Дано:
|
Решение
|
|
|
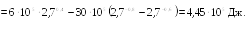
Ответ:
![]()
Пример
22.2. При
изотермическом расширении азота при
температуре
T
= 280 К объем его увеличился в два раза.
Определить совершенную при расширении
газа работу
![]() .
Масса азота M
= 0,2 кг.
.
Масса азота M
= 0,2 кг.
|
Дано:
|
Решение
.
|
|
|
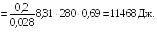
Ответ:
![]()
§ 23. Теплоемкость идеального газа
Различные тела, обладающие одной и той же массой, нагреваются по-разному при сообщении им одного и того же количества тепла. Говорят, что они различаются теплоемкостями.
Теплоемкостью
![]() тела называют
величину, равную количеству тепла,
которое нужно сообщить телу, чтобы
повысить его температуру на один кельвин.
Можем написать
тела называют
величину, равную количеству тепла,
которое нужно сообщить телу, чтобы
повысить его температуру на один кельвин.
Можем написать
![]()
(23.1)
где
![]() — количество тепла, которое нужно
сообщить телу, чтобы увеличить его
температуру на
— количество тепла, которое нужно
сообщить телу, чтобы увеличить его
температуру на
![]() .
.
Теплоемкость одного килограмма тела называют удельной теплоемкостью. Можем написать
![]()
(23.2)
где
![]() — масса тела.
— масса тела.
Теплоемкость
одного моля тела называют молярной
теплоемкостью
![]() .
Можем написать
.
Можем написать
![]() (23.3)
(23.3)
где
![]() — число молей тела.
— число молей тела.
Теплоемкость
зависит от условий, при которых происходит
нагревание тела. Например, нагревание
тела можно проводить при постоянном
объеме или при постоянном давлении. В
первом случае имеем теплоемкость
![]() при постоянном объеме, во втором —
теплоемкость CP
при постоянном давлении.
при постоянном объеме, во втором —
теплоемкость CP
при постоянном давлении.
Получим
выражение для теплоемкостей
![]() и CP
идеального газа.
и CP
идеального газа.
Пусть
нагревание газа происходит при постоянном
объеме (V
= const)
В этом
случае газ не совершает работу над
внешними телами
![]() .
Первый закон термодинамики (23.3) имеет
вид
.
Первый закон термодинамики (23.3) имеет
вид
(![]() 23.4)
23.4)
С учетом соотношения (23.4) имеем
(![]() 23.5)
23.5)
Внутренняя энергия идеального газа (см. § 16)
![]()
откуда, дифференцируя, получаем
![]()
(23.6)
Подставляя выражение (23.6) в соотношение (23.5), получаем теплоемкость идеального газа при постоянном объеме
![]()
(23.7)
Молярная теплоемкость идеального газа при постоянном объеме
![]()
(23.8)
Теперь
рассмотрим нагревание газа при постоянном
давлении (P = const).
Разделим соотношение (22.3) на
![]() :
:
![]()
(23.9)
С учетом формулы (23.5)
![]()
(23.10)
Продифференцируем уравнение Клапейрона – Менделеева
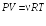
при P = const:
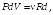
откуда
dV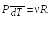
(23.11)
По определению теплоемкости (16.1)
dQ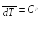
.
(23.12)
Подставляя выражения (23.10)–(23.12) в соотношение (23.9), получаем теплоемкость идеального газа при постоянном давлении
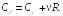
(23.13)
Из соотношения (23.13) видно, что теплоемкость газа при постоянном давлении больше теплоемкости газа при постоянном объеме. Это объясняется тем, что при нагревании газа при постоянном объеме все подведенное к газу количество тепла идет только на увеличение внутренней энергии, а при нагревании газа при постоянном давлении подведенное к газу количество тепла расходуется не только на увеличение внутренней энергии, но и на работу, совершаемую газом при расширении.
Молярная теплоемкость идеального газа при постоянном давлении
(![]() 23.14)
23.14)
Соотношение (23.14) называют уравнением Майера. С учетом выражения (23.8) имеем
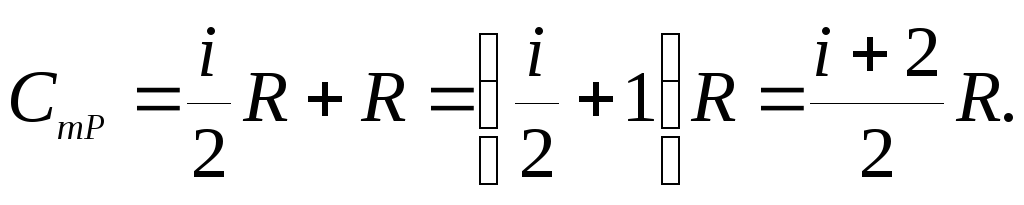
(23.15)
Пример
23.1. При
изотермическом расширении ν молей
идеального газа при температуре
![]() его объем увеличился от
его объем увеличился от
![]() до
до
![]() .
Определить количество тепла
.
Определить количество тепла
![]() ,
полученное
газом.
,
полученное
газом.
|
Дано:
|
Решение
|
|
|
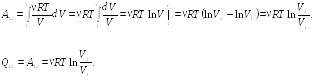
Ответ:
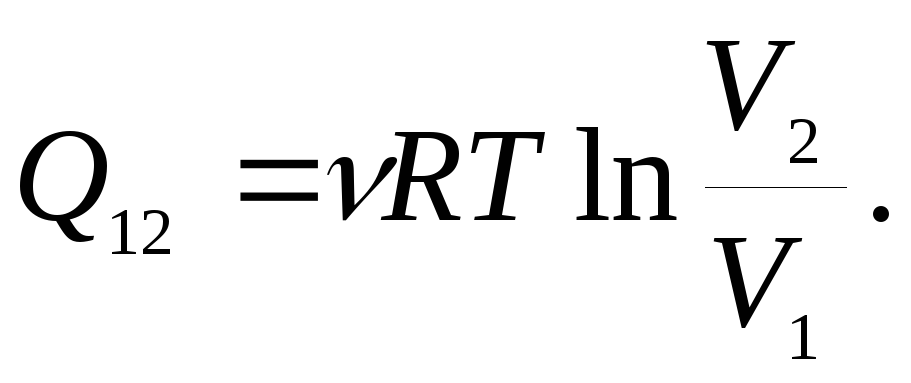
Пример
23.2. Какое
количество тепла
![]() надо сообщить водороду массой M
= 100 г для
изохорного нагревания на
надо сообщить водороду массой M
= 100 г для
изохорного нагревания на
![]() ?
?
|
Дано:
M = 100 г
|
Решение
|
|
|
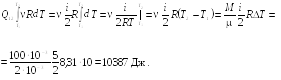
Ответ:
![]()