
- •Министерство сельского хозяйства
- •Формы взаимодействия микро и макро организмов
- •Характерные особенности инфекционной болезни
- •Методы лабораторных исследований
- •Лабораторная диагностикакоринебактериозов
- •Выделение и идентификация коринебактерии
- •Питательные среды
- •Бактериологическое исследование
- •Микроскопическое исследование исходного материала
- •Бактериологическое исследование
- •Микроскопическое исследование исходного материала
- •Биопроба. Проводят с целью выделения культуры возбудителя из исследуемого мате риала и проверки патогенных свойств выделенной культуры.
- •Микроскопическое исследование исходного материала
- •Выделение и идентификация культуры возбудителя
- •Питательные среды такие же как и при лабораторной диагностике актинобациллезной пневмонии свиней.
- •Микроскопическое исследование исходного материала
- •Выделение и идентификация культуры возбудителя
- •Выделение и идентификация культуры возбудителя
- •Сывороточно-дрожжевой бульон. Готовят так же, как и сывороточно-дрожжевой агар, но на основе жидкой питательной среды.
- •Лабораторная диагностика бортелиоза
- •Бактериологическое исследование
- •Выделение и идентификация бордетелл
- •Бактериологическое исследование
- •Питательные среды
- •Лабораторная диагностика сапа
- •Биопроба. Проводят с целью обнаружения возбудителя в исследуемом материале и подтверждения патогенных свойств выделенной культуры на золотистых хомячках, морских свинках.
- •Выделение и идентификация культуры возбудителя
- •Микроскопическое исследование исходного материала
- •Микроскопическое исследование исходного материала
- •Выделение и идентификация культуры возбудителя
- •Питательные среды
- •Питательные среды
- •Микроскопическое исследование исходного материала
- •Выделение и идентификация кампилобактерии
- •Серологическая диагностика
- •Питательные среды
- •Биопроба. Проводят в случаях, когда микроскопическое исследование материала дает отрицательные результаты. Заражают молодых кур, кроликов, морских свинок, белых мышей, куриные эмбрионы.
- •Питательные среды
- •Определение потребности в холестерине. От стерола не зависят ахолеплазмы, требуют его для своего роста микоплазмы, уреаплазмы и спироплазмы.
- •Питательные среды для культивирования микоплазм
- •Лабораторная диагностика контагиозной плевропневмонии крупного рогатого скота
- •Выделение и идентификация культуры возбудителя
- •Серологическая диагностика
- •Выделение и идентификация культур возбудителей
- •Микроскопическое исследование исходного материала
- •Выделение и идентификация микоплазм от овец и коз
- •Серологическая диагностика
- •Лабораторная диагностика микоплазмозов свиней
- •Микроскопическое исследование исходного материала
- •Выделение и идентификация свиных микоплазм
- •Серологическая диагностика
- •Лабораторная диагностика микоплазмозов птиц
- •Микроскопическое исследование исходного материала
- •Выделение и идентификация культур микоплазм
- •Серологическая диагностика
- •Лабораторная диагностика Ку-лихорадки
- •Бактериологическое исследование
- •Серологическая диагностика
- •Бактериологическое исследование
- •Микроскопическое исследование материала
- •Выделение и идентификация культуры возбудителя
- •Лабораторная диагностика неориккетсиоза собак
- •Микроскопическое исследование материала
- •Биопроба. На собаках путем заражения кровью или тканью селезенки можно проводить серийные пассажи возбудителя. Инкубационный период 6-12 дней. Серологическая диагностика
- •Лабораторная диагностика анаплазмоза крупного и мелкого рогатого скота
- •Микроскопическое исследование материала
- •Серологическая диагностика
- •Микроскопическое исследование материала
- •Лабораторная диагностика гемабартонеллеза кошек
- •Микроскопическое исследование материала
- •Биопроба. При внутривенном, интраперитонеальном или оральном заражении материалом кошек воспроизводится клинически выраженное заболевание.
- •Микроскопическое исследование исходного материала
- •Выделение и идентификация хламидии
- •Серологическая диагностика
- •Лабораторная диагностика бешенства
- •Индикация и идентификация вируса
- •Серологическая идентификация
- •Лабораторная диагностика ящура
- •Серодиагностика и ретроспективная диагностика
- •Лабораторная диагностика ортомиксовирусных инфекций
- •Лабораторная диагностика гриппа птиц
- •Серологическая идентификация
- •Лабораторная диагностика классической чумы свиней
- •Серологическая идентификация
- •Серодиагностика и ретроспективная диагностика
- •Индикация и идентификация вируса
- •Серодиагностика и ретроспективная диагностика
Серодиагностика и ретроспективная диагностика
РН. Диагноз на прошедшую инфекцию обычно ставят при помощи РН в культуре клеток, определяя титры ВНА в сыворотках крови реконвалесцентов. Для этого используют постоянную дозу вируса (100-1000 ТЦД50) и двукратные разведения испытуемой сыворотки, которую предварительно инактивируют 30 мин при 56°С. Для более точной диагностики лучше исследовать парные сыворотки, взятые с интервалом 3-4 нед. Титры AT у переболевших животных могут колебаться от 1:8 до 1:1280. ВНА обычно появляются на 7-8-й день после заражения и циркулируют в крови 18 мес. На 14-й день титр их у свиноматки, 3-дн и 3-нед поросят достигает 1:128 - 1:1024, а у отъемышей и откормочных свиней - 1:32- 1:256, С 3-4 мес титр медленно снижается, через год он уже на 2-3 разведения ниже максимального. У некоторых: свиноматок, наоборот, титр AT резко снижается. Колостральные AT обычно исчезают у поросят в возрасте 3-4 мес, в связи с чем обнаруженные у животных в это время ВНА следует относить за счет инфекции.
Для выявления и титрования AT предложен микрометод РН с использованием микропланшетов. Сначала готовят двукратные разведения исследуемых сывороток (от 1:4 до 1:256) в объеме 0,05 мл, затем во все лунки микропипеткой вносят по 0,05 мл вируса, содержащего 100 ТЦД50. После часовой инкубации при комнатной температуре во все лунки вносят по 0,05 мл суспензии клеток почек или щитовидной железы свиней в концентрации 300 тыс. клеток в 1 мл питательной среды, содержащей 30% инактивированной телячьей сыворотки. Пластины с культурой клеток выдерживают в термостате при 37°С в течение 4 да с 5% СО2. Контролем РН служат 8 лунок с незараженной культурой клеток. Реакцию учитывают через 48-96 ч при условии наличия ЦПД в лунках, инфицированных вирусом в разведении 10-1 и 10-2, и в лунках, инфицированных смесью вируса с отрицательной сывороткой, и при отсутствии ЦПД в лунках, инфицированных смесью вируса со специфической сывороткой, и в лунках, не зараженных вирусом. Положительными считают сыворотки, которые в разведении не ниже 1:4 полностью нейтрализуют 100 ТЦД50 вируса.
Тест нейтрализации бляшкообразования более чувствителен, чем РН, Титр AT в нем колеблется от 1:100 до 1:5000, а в РН- 1:10 до 1:160.
РНГА. Используют для определения AT в парных сыворотках крови больных животных, а также для контроля за эпизоотическим состоянием племенных хозяйств-репродукторов в отношении гастроэнтерита. При этом у 5% поголовья 2 раза в год выборочно исследуют сыворотку крови на наличие AT к вирусу. РНГА ставят в макро - и микровариантах по общепринятой методике. Положительными считают сыворотки, которые в разведении 1:16 и выше вызывают агглютинацию эритроцитарного диагностикума. РНГА более чувствительна, чем PH. AT у заражённых поросят выявляются на 4-й день. РНГА используют как для подтверждения клинического диагноза, так и для выявления скрытых форм болезни и вирусоносительства. Реакция позволяет выявлять антитела к ВИГС в 2 раза чаще, чем РН. В бывшем СССР разработан эритроцитный диагностикум, с помощью которого можно выявить специфические AT у вакцинированных и больных ИГС.
ИФ. Описана модификация этого метода, обеспечивающая быстрое выявление и титрование AT к ВИГС. Сущность её заключается в приготовлении большого количества тефлонизированных стёклышек с лунками, содержащими АГ ВИГС. Их получают путём посева в лунки смеси инфицированных и неинфицированных клеток перививаемой линии свиньи тестикулов. Стёклышки помещают в чашки Петри, которые инкубируют 16-18 ч в термостате с газовой смесью воздуха, содержащей 5% CО2. Около половины клеток в каждой лунке оказывались инфицированными вирусом, что обеспечивает контрастность, помогающую определить специфическую флюоресценцию в присутствии разной степени фонового окрашивания. После фиксирования ацетоном стёклышки можно хранить до использования в НИФ при минус 20°С. Сравнение этой модификации с РН, показывает что по чувствительности она не уступает, обладая рядом преимуществ: быстротой получения результатов (3 ч по сравнению с 4-6 дн для РН); простотой постановки; значительно меньшим расходом культуры клеток; возможностью хранения полученных препаратов в замороженном состоянии в течение нескольких месяцев. Важным оказалось также то обстоятельство, что токсичность исследуемых сывороток, часто существенно осложняющая проверку их в РН, не является препятствием для получения результатов.
РДП. Позволяет выявлять AT к ВИГС. АГ в данной реакции служит щелочной экстракт содержимого кишечника поросят, зараженных ВИГС.
ELISA. Успешно используется для выявления и количественного определения сывороточных AT к ВИГС. При исследовании сывороток от поросят, инокулированных культуральным или кишечным ВИГС, ELISA выявлял AT к вирусу в среднем на 3 дня раньше, чем РН при исследовании проб сывороток от поросят, заражённых культуральным вирусом, и на 1 день раньше при обследовании сывороток от поросят, заражённых кишечным вирусом, причём титры AT в ELISA превышают титры ВНА. Имеются и другие достоинства ELISA по сравнению с РН, в частности, на результаты реакции не влияет присущая некоторым полевым сывороткам цитотоксичность. С 1981 г. этот тест в двух вариантах - косвенный и послойный (двухсэндвичный) - успешно используется в ветеринарной практике Италии. Интересно, что с его помощью можно количественно оценивать lg 3 классов: G, М и А. Модифицированный авторадиографический тест для выявления AT к вирусу ИГС был предложен в 1983 г. в Чехословакии.
Метод блокирования ELISA. Этот метод используется для дифференциации ВИГС и РКВС с помощью монАТ. В блок-ELISA АГ ВИГС реагирует с сывороткой к ВИГС или монАТ к РКВС.
РТГА. ВИГС обладает ГА активностью в отношении эритроцитов цыплят, морских свинок и КРС, но не агглютинирует эритроциты гусей и мышей. Наиболее высокие титры ГА отмечены при 4°С. Поскольку специфическая антисыворотка к вирусу ингибирует ГА, то для серодиагностики ИГС можно использовать РТГА. Титры гемагглютининов в свиных сыворотках коррелируют с титрами ВНА. РТГА с культуральным вирусным АГ ставят на физиологическом р-ре (рН 7,2) с эритроцитами морской свинки в концентрации 0,6% при температуре смеси 4°С, учёт реакции проводят через 1,5-2 ч. Установлена зависимость ГА активности вируса от его инфекционной активности. Определены оптимальные условия постановки РТГА для обнаружения AT к вирусу ИГС в сыворотках крови свиней. Показана пригодность ее для исследования полевых материалов - сывороток крови и молока свиноматок на наличие специфических к ВИГС AT. Выявлена корреляция между уровнем AT, выявляемых в РТГА, и иммуноферментным методом.
Дифференциальная диагностика. В полиэтиологической структуре вирусных гастроэнтеритов свиней доминируют рота - и коронавирусы, вызывающие диарейный синдром. ИФА даёт возможность проведения широкого эпизоотологического анализа и дифференциации указанных болезней.
Лабораторная диагностика ротавирусной диареи свиней
Ротавирусы - важнейшие энтеропатогены неонатального периода животных многих видов, включая свиней. Энтеропатогенность ротавирусов свиней (РВС) подтверждается ш способностью вызывать тяжелые гастроэнтериты и атрофию ворсинок в экспериментальных условиях у поросят-гнотобиотов и поросят, не получавших молозива, в отсутствие других возбудителей, Ротавирусная инфекция свиней (РВИС) наблюдается во всех странах с развитым свиноводством.
Для диагностических исследований отбирают образцы кала или содержимого кишечника при остром заболевании. Наибольшая концентрация РВС отмечается в течение 12-24 ч после начала диареи.
Для выявления РВС используют ряд методов, включая ЭМ, ИЭМ, ИФА, изоляцию, реакцию латекс-агглютинации, дот-блот-гибридизации, РНК-электрофоретипирование.
Индикация вируса. ЭМ и ИЭМ. Это основной метод выявления вируса. Он позволяет обнаруживать различные группы РВ. Морфология и тип вирусных частиц, обнаруживаемые в негативно контрастированных препаратах, изменяются при окрашивании и зависят от серогрупп РВС. Негативное окрашивание фосфорно-вольфрамовой кислотой (ФВК) при нейтральном рН выявляет предпочтительно 1-слойные капсиды, тогда как ФВК при рН 4,5 или уранилацетат выявляют 2-слойные частицы. Ядро частиц выявляется у РВС группы В. ИЭМ позволяет дифференцировать различные серогруппы РВС.
ИФА. Часто используется для выявления вирусспецифического АГ в фекалиях или содержимом кишечника и более чувствителен, чем латекс-агглютинация, но менее чувствителен чем ЭМ. Электрофоретипирование вирусной РНК часто используется для обнаружения и дифференциации серогрупп РВС, но эти результаты должны быть подтверждены серологически. Дот-блот-гибридизация используется как альтернатива для индикации и идентификации групп РВ и их серотипов.
Выделение вируса. У 90-100% поросят до 5-6-нед возраста можно обнаружить РВ в фекалиях. Продолжительность экскреции вируса, как правило, не превышает 1 нед. Изоляты получены из фекалий в клеточных культурах (клетки МА-104). На различном числе пассажей наблюдался типичный ЦПЭ, вирусный АГ обнаруживали в цитоплазме инфицирован-ных клеток в ИФ. Адаптация РВ к клеточным культурам подтверждена также с помощью I методов ЭМ и ИФА.
Серологическая диагностика. Разработан метод гемагглютинации и РТГА с РВС I (шт. S-80). ГА вируса получают при репродукции его в клетках МА-104, предварительно обработанных трипсином. Вирус агглютинирует эритроциты человека типа А, В и О, морской свинки и свиней. Титр РГА с эритроцитами морской свинки равен 1:8 - 1:128. Максималь- ный титр ГА отмечен при инкубации вируса с эритроцитами в течение ночи при 4°С. Титр I АТ к РВ со шт. S-80 в РТГА достигает 1:320 и коррелирует с РН (r~0,66). Серологическая (ретроспективная) диагностика имеет небольшое значение в диагностике РВИС, поскольку АТ широко распространены в стаде. Однако титр АТ и серотип отражают иммунный статус животных. Помимо вышеописанной реакции АТ к РВС могут выявляться в непрямой ИФ. Для этого линию клеток МА-104 заражают одной из групп РВС (А, В или С). После культивирования клетки фиксируют в смеси ацетон-метанол и используют в качестве АГ в непрямой ИФ. С этой же целью можно использовать криосрезы слизистой оболочки кишечника больных поросят. В непрямой ИФА и РТГА обычно выявляют АТ к групповому АГ. ИФА, комбинированный с типоспецифическими монАТ, используют для определения классов АТ к РВС. ВНА выявляются в реакциях подавления бляшкообразования или подавления фокусов ИФ.
Лабораторная диагностика болезни Тешена
Болезнь Тешена - вирусная болезнь свиней, характеризующаяся развитием негнойного энцефаломиелита и появлением параличей. Болезнь проявляется клиническими признаками поражения центральной нервной системы (гиперстезия, мышечный тремор, нистагм, опистотонус, тоникоклонические судороги, "ходульная походка", параличи конечностей мышц шеи, глотки). Очень часто данную болезнь свиней описывали под различными самостоятельными названиями: полиомиелит лошадей, болезнь Талфана, энцефаломиелит поросят, болезнь Клобука и др. Болезнь Тешена регистрируется во всех странах с развитым свиноводством. Для выделения вируса из ЦНС необходимо отбирать пробы тканей от свиней с нервным синдромом на ранней стадии его проявления. У животных с признаками параличей уже через несколько дней вирус не обнаруживается в ЦНС. Вирус может быть выделен в культурах клеток из спинного мозга, коры головного мозга или мозжечка.
Идентификацию вируса проводят на основе физико-химических характеристик, ИФ или ИФА. Для выявления АТ широко используется ЕLIЗА. При дифференциальной диагностике следует исключить БА, бешенство, КЧС, отравления хлоридами и соланином. Диагноз на прошедшую инфекцию, а также латентное вирусоносительство ставят на основании определения титров АТ в сыворотках крови реконвалесцентов в РН в культуре клеток почки свиньи с использованием лабораторных штаммов вирусов болезни Тешена, Талфана и Т-80.
Для ускоренной диагностики болезни, а также выявления концентрации вируса в органах и тканях используют ИФ. В первые 3 дня болезни наблюдают специфическое свечение цитоплазмы нейронов всех исследованных отделов ЦНС, клеток межпозвоночных узлов, отдельных клеточных элементов селезенки, мезентериальных лимфоузлов, слизистой толстого кишечника. Но начиная с 4 сут свечение в нервных элементах и других тканях резко снижается, а на 5-7-е сут энтеровирусный АГ выявляют лишь в эпителии слизистой кишечника. Вот почему для диагностики энзоотического энцефаломиелита свиней кроме тканей ( мозжечок, продолговатый и спинной мозг), рекомендуемых инструкцией для ИФ, необходимо отбирать и кусочки слизистой ободочной кишки. При прижизненной диагностике и определения у животных вирусоносительства разработан и внедрен в производство прямой метод флюоресцирующих АТ в мазках - отпечатках со слизистой прямой кишки и фекалий. Положительную ИФ в мазках наблюдают в эпителиоцитах и их обломках в течение всей болезни, а у переболевших (вирусоносителей) - до 2 мес.
Лабораторная диагностика репродуктивного и респираторного синдрома свиней
Репродуктивный и респираторный синдром свиней (РРСС, "синее ухо, голубой аборт", эпизоотический поздний аборт свиней) - вирусное контагиозное заболевание главным образом свиноматок, характеризующееся абортами, наличием мертворожденных поросят, преждевременными опоросами или задержкой опороса, респираторными нарушениями, появлением окрашивания кожи ушей и других органов. Регистрируется во многих странах.
Диагноз на РРСС ставят на основании клинико-эпизоотологических данных и результатов лабораторных исследований. Лабораторная диагностика основана на выделении вируса, серологических исследованиях. Для выделения вируса используют сыворотку или плазму крови больных и павших поросят, пробы лёгких, селезёнки, плевральной и перикардиальной жидкости. Выделение вируса проводят в культурах альвеолярных макрофагов, полученных от молодых (6-8 нед) СПФ-поросят. Успех голландских учёных и объясняется прежде всего тем, что они использовали эту культуру, в то время как культуры клеток РК-2, РК-15 и К-6 оказались не чувствительными для выделения возбудителя. Идентификацию возбудителя проводят по физико-химическим и серологическим свойствам. Из серологических методов используют вначале непрямой метод ИФ и прямой метод ИФА. В США для идентификации возбудителя использовали РН, разработанную с этим вирусом в университете штата Миннесота, а также ИФ и ИФА, разработанные в национальной лаборатории Аmes в шт. Айова. Во Франции разработан непрямой метод ИФА для обнаружения специфических АТ. Сероконверсия в диагностических титрах (1:20 и выше) развивается к 14-му дн после экспериментального инфицирования, а к 28-му дн титры антител накапливаются до 1:1280. Разработана методика очистки и концентрирования культурального вируса РРСС, репродуцированного в культуре клеток МАРС-145 и FL. Предварительно вируссодержащая суспензия очищается от балластных белков низкоскоростным центрифугированием, затем концентрируется 2-кратным осаждением ПЭГ мол.м. 6000 и очищается высокоскоростным центрифугированием (7000 мин-1 в течение 6 ч). В градиенте плотности СsС1-сахарозы материал концентрировали в 100 раз. Очистка составляла 96,5%. Все этапы подготовки препаратов контролировали по активности в ИФА. Высокоспецифичные активные препараты АГ вируса РРСС используют для изготовления АТ диагностикумов для ИФА. Метод непрямой ИФА более простой и его можно использовать в полевых условиях. Достаточно исследовать из стада 10 проб сывороток, (лучше парных), чтобы с уверенностью поставить лабораторный диагноз.
В РФ разработан твердофазный ИФА, для проведения диагностики РРСС, составлены наборы диагностикумов для выявления РРСС и специфических АТ. МонАТ к вирусу РРСС могут быть использованы как для выявления АГ вируса РРСС в патологическом материале, так и для определения АТ в сыворотках крови свиней, так как они дают более специфическую реакцию по сравнению с полиАТ.
При дифференциальной диагностике необходимо исключить вирусные и бактериальные болезни, протекающие с нарушениями в репродуктивных системах, а также отравления. Исключают прежде всего АЧС, КЧС, БА, грипп свиней, ЭМК, парвовирусную болезнь, ТГЭ, лептоспироз и хламидиоз. Характерной особенностью этой болезни является обострение вторичных и хронически протекающих инфекций, возбудители которых могут скрытно циркулировать в пораженных стадах свиней. Это ещё более усложняет проведение лабораторной дифференциальной диагностики.
Лабораторная диагностика cиндрома "голубой глаз" свиней
Синдром "голубой глаз" свиней (СГГС) болезнь, проявляющаяся кератоконъюнктивитом с голубой окраской роговицы, нарушением нервной системы, снижением репродуктивности, высокой гибелью поросят. Регистрируется во многих странах.
Диагностика основана на клинико-морфологических данных, гисто- и вирусологических исследованиях. Для изолирования вируса суспензию из головного мозга, лимфоузлов глотки и легких, подозреваемых особей, инокулируют в первичную культуру клеток почки поросенка (или, перевиваемую культуру клеток РК-15). Монослой каждые 24 ч просматривают для обнаружения синцития. Специфичность ЦПЭ подтверждают в РГА и гемадсорбции с эритроцитами разных животных, а также ЭМ и МФА (последний применяют также для прямого обнаружения вирусспецифического АГ вируса в клетках срезов органов, замороженных в криостате). Для определения вирусспецифических AT используют РЗГА, РН и ИФА.
Известно, что у свиней помутнение роговицы встречается очень редко, его наблюдают у отдельных животных при травмах, авитаминозе А и экспериментальном заражении ВБА. БА имеет с СГГС сходные клинические признаки, при ней также поражаются ЦНС, легкие, репродуктивные органы, но ВБА индуцирует образование внутриклеточных включений, а главным признаком могут служить аборты. Следует помнить, что помутнение роговицы при естественном течении БА никогда не наблюдается. К тому же ВБА является ДНК-содержащим и имеет много отличий от возбудителя СГГС (например, при инокуляции кроликам вызывает энцефалит и гибель).
Синдром "голубой глаз" имеет также сходство с энцефалитом, вызывемым ГА вирусом, но помутнение роговицы при этом отсутствует. ГА-вирус, к тому же, не агглютинирует эритроциты лошади, с трудом культивируется в культурах клеток (за исключением первичной почки свиньи), величина его составляет 80-120 нм.
По некоторым признакам СГТС имеет сходство и с другими болезнями, парвовирусной инфекцией (поражаются генитальные органы самок); гриппом (респираторные органы); с болезнями, протекающими с нервным синдромом (классическая чума свиней, энтеровирусная инфекция, колибактериоз и др.). Все эти патологии следует дифференцировать от синдрома "голубой глаз".
Лабораторная диагностика оспы свиней
Оспа свиней (ОС) - контагиозное заболевание, характеризующееся лихорадкой и пузырьково-пустулезной сыпью, появляющейся на коже и слизистых оболочках. Вызывается или оригинальным эпителиотропным вирусом оспы свиней (ВОС), или вирусами оспы коров и осповакцины. Регистрируется во всех странах.
Диагноз ставят на основании клинико-эпизоотологических и эпидемиологических данных, результатов лабораторных исследований, вирусоскопии, гистологического исследования, постановки биопробы на поросятах, кроликах и телятах (последние реагируют на введение вирусов коровьей оспы и осповакцины).
Выделение вируса
Подготовка материала. Очень важно правильно взять патологический материал для исследования. Его берут не менее чем с 5-10 участков пораженных тканей (везикул, папул и др.). Материал от больных животных, до этого обработанных моющими, дезинфицирующими р-рами, для исследования не пригоден. В лабораторию направляют мазки, сделанные из содержимого везикул больного животного, мазки-отпечатки оспенных поражений кожи, содержимое везикул, целые папулы и пустулы, иссеченные вместе с субэпидермальной тканью. Мазки высушивают на воздухе и упаковывают в целлофан. Везикулярную жидкость собирают в капилляры пастеровских пипеток, концы которых осторожно запаивают и помещают в пробирки с резиновыми пробками. Для гистологических исследований папулы и пустулы помещают во флаконы с 50%-ным р-ром глицерина и 10%-ным р-ром формалина. Не консервированный материал доставляют в термосе со льдом в тот же день. Необходимо помнить, что ВОС малоустойчив к теплу и кислой среде. Водный р-р глицерина (4-10%-ный) консервирует вирус в течение 4-5 лет. Лиофилизированный вирус сохраняется активным до 3 лет и более, особенно под вакуумом при низкой температуре. Для выделения вируса пробы взятого вируссодержащего материала растирают в ступке или готовят 10%-ную суспензию на физиологическом р-ре. Если материал консервировали глицерином, его предварительно отмывают физраствором. Суспензию центрифугируют 15 мин при 2000 мин-1. Надосадочную жидкость отсасывают, добавляют к ней 500 ЕД/мл пенициллина, 250 мкг/мл стрептомицина и 50 ЕД/мл нистатина, встряхивают и выдерживают 12 ч при 4°С.
Заражение животных. Биопробу ставят на 2-3-мес поросятах. Надосадочную жидкость (0,6 мл) втирают в участки скарифицированной кожи живота. Биопробу считают положительной при образовании по ходу насечек через 6-8 дн характерной узелково-пустулезной сыпи и при обнаружении элементарных телец при микроскопии. Биопробу ставят при неясных симптомах болезни и отрицательных результатах вирусоскопических исследований.
Индикация и идентификация вируса
Вирусоскопия. Свежую папулу протирают ватой, смоченной спиртом, срезают (лучше бритвой) и поверхностью среза делают несколько тонких мазков на предметных стеклах. Мазки подсушивают на воздухе и окрашивают методом серебрения (по Морозову). При вирусоскопических исследованиях пораженных участков кожи обнаруживают характерное расположение вирионов в виде россыпи. Однако отсутствие вирусных частиц в препарате еще не исключает оспу.
ЭМ. ЭМ пораженных участков кожи больных оспой поросят и обнаружение характерных вирусных частиц - один из методов экспресс-диагностики оспы. Для этого требуется всего около 30 мин.
Обнаружение специфических телец-включений. Развитие оспенных поражений в коже больных хорошо прослежено гистологическими исследованиями, результаты которых приведены в табл.108.
Таблица 108 – Результаты гистологических исследований кожи свиньи, больной оспой
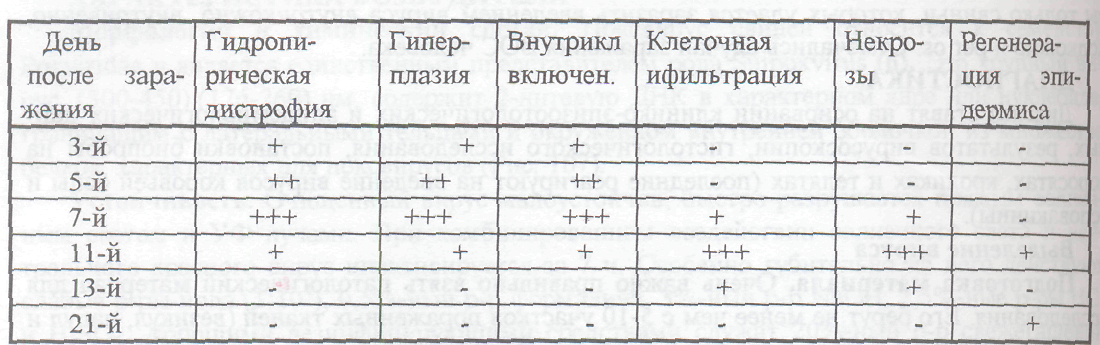
Обозначения: (+, ++, +++) - выраженность реакции
(-) - отсутствие реакции или внутриклеточных включений
Диагноз на оспу считают положительным при наличии в гистологических препаратах ацидофильных включений и внутриядерных вакуолей в гиперплазированных кератиноцитах эпидермиса кожи. Цитоплазматические включения при ОС относятся к группе Б, т. е. к включениям, материал которых участвует в репродукции вируса.
Серологическая идентификация. Не разработана. Однако при необходимости возможна постановка РДП и более чувствительного теста - противоточного электрофореза.
Дифференциальная диагностика. Болезнь у свиней могут вызвать вирусы ОС, оспы коров, осповакцины и, по данным некоторых исследователей, оспы кур. Дифференциацию возбудителя, вызвавшего оспу у свиней, проводят на КЭ, культурах клеток органов и тканей кроликов или поросятах. Для этого используют 2-х поросят, переболевших оспой (подопытные), и 2-х здоровых (контрольные). Им втирают в скарифицированную кожу по 2 капли растворенной сухой осповакцины. Развитие оспенных поражений у подопытных и контрольных животных через 5-8 дн после нанесения вируса осповакцины указывает на наличие в хозяйстве оспы, вызванной натуральным ВОС. Отсутствие их у подопытных животных при положительной поствакцинальной реакции у контрольных свидетельствует о наличии у свиней оспы коров или осповакцины.
Дифференциацию возбудителей, выделенных от больных свиней с клинической картиной оспы, проводят на основании данных, приведенных в табл. 109. Более простым способом дифференцирования этих болезней является заражение кролика путем введения исследуемого материала в скарифицированную кожу. ВОС не вызывает у этих животных кожной реакции, в то время как вирусы осповакцины и оспы коров ее вызывают. Оба последних вируса можно выделить также путем заражения КЭ и культур клеток. Наличие телец-включений вдоль центральной "просветленной" околоядерной зоны в пораженных эпителиальных клетках является патогномоничным для ВОС.
Оспу у свиней следует дифференцировать от экзантем, появляющихся при авитаминозах, аллергии и нарушении обмена веществ, энзоотической бронхопневмонии, стрептококковом сепсисе, паратифе, чесотке, лишае, ВБС и везикулярной экзантеме. При экзантемах незаразной этиологии обычно не бывает лихорадки и биопроба отрицательная. Экзантема при чесотке, паратифе и других болезнях протекает без стадийного развития, как при оспе, а из патологического материала выделяют соответствующих возбудителей.
Таблица 109 – Дифференциальная диагностика оспы овец
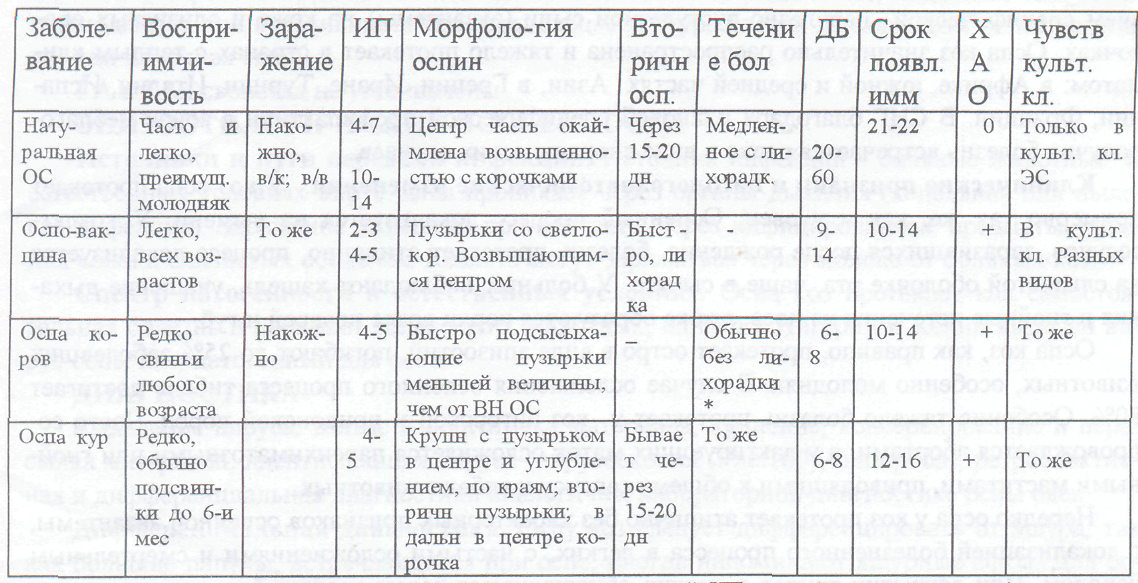
Обозначения: + наличие репродукции на ХАО; 0 - отсутствие таковой. ИН - инкубационный период; * - при отсутствии осложнений; ДБ - длительность болезни; в/к - внутрикожное заражение; в/в - внутривенное заражение.
Примечание. Свиньи оспой от овец и коз обычно не заражаются. Среди указанных вирусов перекрестный иммунитет образуется только между вирусами оспы коров и осповакцины; ВН ОС - вирус натуральной оспы свиней.
Лабораторная диагностика реовирусная инфекция овец
Инфекционная катаральная лихорадка овец ("синий язык" КЛО) - вирусная трансмиссивная инфекция, передающаяся кровососущими насекомыми из рода Сulicoides, характеризующаяся лихорадочным состоянием, воспалительно-некротическими поражениями ротовой полости, особенно языка, пищеварительного тракта, эпителия венчика и основы кожи копыт, а также дегенеративными изменениями скелетных мышц. Регистрируется во многих странах. В Российской Федерации с 1993 г. неблагополучными являются некоторые районы Бурятии.
Диагноз ставят на основании эпизоотологических данных, симптомов болезни, патоморфологических изменений и результатов лабораторных исследований. Для окончательного диагноза проводят выделение вируса, его идентификацию и ставят биопробу. Для выделения вируса более чувствительны 10-11-дн КЭ, заражаемые на ХАО или внутривенно пробами испытуемой крови, обработанной ультразвуком. Выделенный вирус идентифицируют в РН, применяя типоспецифические сыворотки. Для быстрого обнаружения вируса рекомендуется ИФ в культуре клеток. Показано, что РН по бляшкам более чувствительна, чем РСК и РДП. С помощью РСК удается выявлять АТ в сыворотке крови овец и КРС.
Для выделения вируса КЛО проводят иммобилизацию Сulicoides триэтиламином, которым пропитывают специальные аппликаторы. Через 2-3 мин после воздействия паров препарата обездвиженных насекомых микроскопируют и отбирают самок, которых замораживают в жидком азоте. Перед началом проведения вирусологического исследования насекомых размораживают и помещают в среду Игла МЕМ с 10% фетальной сыворотки и антибиотиками, обрабатывают ультразвуком; суспензию осветляют центрифугированием. Для выделения вируса КЛО используют перевиваемую линию клеток С 6/36 , полученную из личинки Аedes оlbapietus. Эта линия высоко чувствительна, пригодна для первичной изоляции вируса КЛО из патологического материала. Линию клеток выращивают при температуре 28°С, создавая оптимальные условия для функционирования РНК-полимеразы вируса. Поскольку в этих условиях ЦПД не проявляется, то его наличие в зараженной суспензии клеток насекомых определяют с помощью ИФ и ИФА. Разработан укороченный метод первичной обработки патологического материла (пулов насекомых). Исследование его в культуре клеток показало высокую чувствительность и пригодность для полевых обследований популяций насекомых на инфицированность вирусом КЛО.
Установлена высокая чувствительность метода выделения вируса в перевиваемой линии культуры клеток ПСКГ в сочетании с методом ИФА. Последний рекомендован для выявления АГ вируса блутанга в инфицированных культурах клеток и в суспензии инфицированных комаров Сulicoides variipennis. Высокая чувствительность ИФА позволяет обнаружить одного инфицированного мокреца в смеси с 92 неинфицированными насекомыми. Разработан непрямой вариант ИФА для серологической диагностики блутанга. Окончательная диагностика КЛО, которая часто протекает субклинически у домашних и диких животных, может быть проведена только лабораторными методами выделения вируса, выявления АГ, нуклеиновых кислот вируса и АТ. Вирус выделяют из компонентов крови, в основном из эритроцитов, отобранных у животных во время лихорадочной реакции. Исследуемый материал вводят в КЭ и проводят пассаж в культуре клеток (ВНК -21, Vero).
Для идентификации вирусных АГ используют ИФ, РН, ИЭМ с применением монАТ и ИФА. Дня выявления нуклеиновых кислот делают гибридизационный анализ и ПЦР. АТ обнаруживают в РДП в агарозе и в конкурентном ИФА. Последняя реакция с использованием вирусепецифических монАТ является более чувствительным и специфичным методом обнаружения АТ к КЛО. РН в культуре клеток служит наиболее общепринятым методом выявления типоспецифических АТ. Во ВНИИЗЖ также получены монАТ для постановки ингибирования ТФ ИФА.
КЛО необходимо дифференцировать от ящура, контагиозного пустулезного дерматита (эктимы), оспы, везикулярного стоматита, злокачественной катаральной лихорадки, сердечной водянки, болезни Найроби, лихорадки долины Рифт и некробактериоза.
Лабораторная диагностика оспы овец
Оспа овец - острая контагиозная болезнь, протекающая с характерными папулезно-улезными поражениями кожи морды и других мест со слабым волосяным покровом (экзантема) и слизистых оболочек. В 1964 г. на XII сессии Генерального Комитета МЭБ оспу овец внесли в список наиболее опасных (конвенционных) болезней животных. Она широко распространена в соседних странах, занимающихся овцеводством. Эпизодически в результате заноса из неблагополучных соседних стран бывают вспышки в южных регионах России.
Диагноз ставят с учетом эпизоотологических данных, результатов клинического обследования, биопробы и вирусоскопии мазков из свежеразвившихся первичных очагов поражения или мест инокуляции вируса при постановке биопробы. В этих случаях необходимо найти животных с характерными оспинами гнездно-сетчатого строения с кратерообразными углублениями, чего при других экземах, как правило, не бывает. При типичном течении диагностировать оспу не трудно. При тщательном обследовании овец пораженной отары всегда можно найти отдельных животных с типичными оспинами на разных стадиях формирования. У одного и того же животного оспины образуются не одновременно, одни находятся в стадии розеол, другие - в стадии папул.
Лабораторная диагностика оспы основана на выделении вируса, вирусоскопии мазков препаратов из срезанного эпителия розеолы, на присутствие элементарных телец, постановке биопробы, РИФ, РДП.
Выделение вируса. Для исследования берут содержимое везикул или пустул, поверхность которых предварительно очищают ватным тампоном, смоченным эфиром или спиртом. Для гистологического исследования вырезают измененные участки кожи на границе с неизмененными. Патологический материал для вирусологических исследований следует пересылать в замороженном или охлажденном (до 4-6°С) виде. Обычно при абортивном и неясном течении болезни ставят биопробу на неиммунных молодых овцах. Испытуемую суспензию, приготовленную общепринятым методом в разведениях 1:20 и 1:200, инокулируют внутрикожно в бесшерстную поверхность хвоста в дозе 0,1-0,15 мл. Наблюдение ведут в течение 10 дн. В положительных случаях на месте инъекции развивается местный оспенный процесс (розеола, папула, везикула, пустула, некроз), специфичность которого подтверждают методом вирусоскопии мазков, приготовленных из срезанного эпителия розеолы, на присутствие элементарных частиц.
Серологическая идентификация
ИФ. Исследование (прямой метод) проводят общепринятым методом. При наличии ВОО в клетках инфицированной культуры с 6-8-го ч после заражения в отдельных участках цитоплазмы появляются светящиеся очаги. Позже начинают светиться обширные участки.
РДП. Для получения сыворотки, годной для использования в РДП, иммунизируют кроликов овиной, делают 2-4 внутривенные инъекции в объеме 2; 1; 0,5 и 0,25 мл с интервалом в 5 дн. Через 7 дн после последней инъекции у кроликов берут кровь для получения сыворотки. Полученные кроличьи сыворотки необходимо истощить культурой фибробластов эмбриона овцы. РДП ставят общепринятым методом.
Дифференциальная диагностика. Оспу овец и коз в стадии образования пустул и корок следует дифференцировать от чесотки, пустулезной экземы и контагиозного пустулезного дерматита (эктимы) овец и коз.
Список сокращений
АЧС – африканская чума свиней
БОЕ – бляшкообразующая единица
БН – болезнь Ньюкасла
ВНА – вируснейтрализующие антитела
ВИЭФ – встречный иммуноэлектрофорез
ВД-БС – вирусная диарея – болезнь слизистых
ВКЧС – вирус классической чумы свиней
ВБА – вирус болезни Ауески
ВЧКРС – вирус чумы крупного рогатого скота
ВБ – вирус бешенства
ВГП – вирус гриппа птиц
ВГС – вирус гриппа свиней
ВЛКРС – вирус лейкоза крупного рогатого скота
ВЯ – вирус ящура
ГАЕ – гемагглютинирующая единица
ЖКТ – желудочно-кишечный тракт
ИФ – иммунофлуоресценция
ИФА – иммуноферментный анализ
ИОЭФ – иммуноэлектроосмофорез
ИГС – инфекционный гастроэнтерит свиней
ИРТ – инфекционный ринотрахеит
ИЛТ – инфекционный ларинготрахеит
КРС – крупный рогатый скот
КЭ – куриный эмбрион
КС – комплемент связывающий
КСА – комплемент связывающие антитела
КЧС – классическая чума свиней
ККРА – кровекапельная реакция агглютинации
КЧП – классическая чума птиц (грипп)
ЛД50 – 50%-ная летальная доза
НРИФ – непрямая реакция иммунофлуоресценции
НИФ – непрямая флуоресценция
РН – реакция нейтрализации
РТГА – реакция торможения гемагглютинации
РП – реакция преципитации
РСК – реакция связывания комплемента
РЗГА – реакция задержки гемагглютинации
РГА – реакция гемагглютинации
РНГА – реакция непрямой гемагглютинации
РПГА – реакция пассивной гемагглютинации
РВИЭОФ – реакция встречного иммуноэлектроосмофореза
РНИФ – реакция непрямой иммунофлуоресценции
РИФ – реакция иммунофлуоресценции
РРГ – реакция радиального гемолиза
РИД – реакция иммунодиффузии
РРСС – респираторный и репродуктивный синдром свиней
СГГС – синдром «голубой глаз»
ТЦД50 – 50%-ная тканевая цитопатическая доза
ТФИФА – твердофазный иммуноферментный анализ
ТГС – трансмиссивный гастроэнтерит свиней
ХАО – хориоалантоисная оболочка
ЦПД – цитопатическое действие
ЦНС – центральная нервная система
ЭФ – электрофорез
ЭЛД50 – 50%-ная эмбриональная летальная доза
ЭМ – электронная микроскопия
Содержание
Общая часть…………………………………………………………………4
Особенности морфологии и строения микроорганизмов………………...4
Формы взаимодействия микро и макроорганизмов……………………..16
Характериные особенности инфекционной болезни……………………18
Методы лабораторных исследований…………………………………….23
Отбор, консервирование, транспортировка и хранение материала для лабораторного исследования………………………………………………….34
Специальная часть…………………………………………………………38
Лабораторная диагностика стафилококкозов.…………………………38
Лабораторная диагностика стрептококкозов………………………………51
Лабораторная диагностика энтеробактерий……………………………….70
Лабораторная диагностика колибактериоза………………..……………...96
Лабораторная диагностика сальмонеллезов……………………………...108
Лабораторная диагностика иерсинеозов………………………………….129
Лабораторная диагностика морганелл……………………………………148
Лабораторная диагностика клебсиелл……………………………………156
Лабораторная диагностика протеи………………………………………..162
Лабораторная диагностика сибирской язвы……………………………...166
Лабораторная диагностика туберкулеза………………………………….178
Лабораторная диагностика паратуберкулеза……………………………..198
Лабораторная диагностика листериоза..………………………………….201
Лабораторная диагностика рожи свиней…………………………………213
Лабораторная диагностика лептоспироза………………………………...217
Лабораторная диагностика клостридиозов…...…………………………..232
Лабораторная диагностика инфекционной энтеротоксемии животных..233
Лабораторная диагностика брадзота овец………………………………..239
Лабораторная диагностика клостридиоза птиц…………………………..242
Лабораторная диагностика эмфизематозного карбункла……………......243
Лабораторная диагностика злокачественного отека……………………..246
Лабораторная диагностика ботулизма……………………………………249
Лабораторная диагностика столбняка………………………………….....252
Лабораторная диагностика коринобактериозов…...……………………..260
Лабораторная диагностика актиномикоза………………………………..269
Лабораторная диагностика нокаридиоза.…………………………………275
Лабораторная диагностика бруцеллеза…………………………………...278
Лабораторная диагностика туляремии….………………………………...296
Лабораторная диагностика пастереллеза…….…………………………...302
Лабораторная диагностика гемофилезного полисерозита поросят…......309
Лабораторная диагностика гемофилеза кур……….……………………..312
Лабораторная диагностика актинобациллезной пневмонии свиней……315
Лабораторная диагностика бортелиоза.…………………………………..321
Лабораторная диагностика инфекционного кератоконъюктивита крупного рогатого скота………………………………………………………………326
Лабораторная диагностика инфекционного тромбоэмболического менингоэнцефалита крупного рогатого скота…………………………………...329
Лабораторная диагностика контагиозного метрита лошадей…………...333
Лабораторная диагностика сапа…………………………………………...338
Лабораторная диагностика мелиоидоза…………………………………..342
Лабораторная диагностика псевдоманоза………………………………...346
Лабораторная диагностика некробактериоза…………………………….352
Лабораторная диагностика копытной гнили овец и коз…………………359
Лабораторная диагностика дизентерии свиней…………………………..364
Лабораторная диагностика кампилобактериозов….……………………..370
Лабораторная диагностика борррелиоза птиц..…………………………..384
Лабораторная диагностика микоплазмозов………………………………386
Лабораторная диагностика контагиозной плевропневмонии крупного рогатого скота…………................................................................................402
Лабораторная диагностика микоплазмозов крупного рогатого скота сопровождающиеся поражением респираторного, генетального тракта и молочной железы……………………………………………………………...405
Лабораторная диагностика микоплазмозов мелкого рогатого скота…...407
Лабораторная диагностика микоплазмозов свиней……………………...412
Лабораторная диагностика микоплазмозов птиц…………………….......417
Лабораторная диагностика риккетсиозов………………………………...423
Лабораторная диагностика Ку-лихорадки..………………………………423
Лабораторная диагностика инфекционного гидроперекардита животных……………………………………………………………………426
Лабораторная диагностика эрлихиозов.………………………………….428
Лабораторная диагностика неореккетсиоза собак……………………….430
Лабораторная диагностика анаплазмоза крупного и мелкого рогатого скота…………………………………………………………………………431
Лабораторная диагностика эритрозоопоза……………………………….432
Лабораторная диагностика гемабартонеллеза кошек….………………...433
Лабораторная диагностика хламидиозов…………………………………434
Лабораторная диагностика бешенства……………………………………447
Лабораторная диагностика инфекционного ринотрахеита крупного рогатого скота……………………………………………………………....455
Лабораторная диагностика ротавирусной инфекции крупного рогатого скота…………………………………………………………………………462
Лабораторная диагностика вирусной диареи крупного рогатого скота..469
Лабораторная диагностика парагриппа-3 крупного рогатого скота……477
Лабораторная диагностика лейкоза……………………………………….481
Лабораторная диагностика ящура………………………………………...493
Лабораторная диагностика чумы крупного рогатого скота и мелких жвачных…………………………………………………………………………..499
Лабораторная диагностика аденовирусной инфекции крупного рогатого скота…………………………………………………………………………506
Лабораторная диагностика ортомиксовирусных инфекций…………….508
Лабораторная диагностика гриппа птиц………………………………….512
Лабораторная диагностика гриппа свиней……………………………….518
Лабораторная диагностика болезни Ауески……………………………...523
Лабораторная диагностика инфекционного ларинготрахеита кур……...534
Лабораторная диагностика ньюкаслской болезни……………………….540
Лабораторная диагностика классической чумы свиней…………………547
Лабораторная диагностика инфекционного гастроэнтерита свиней…...559
Лабораторная диагностика ротавирусной диареи свиней……………….567
Лабораторная диагностика болезни Тешена……………………………..569
Лабораторная диагностика репродуктивного и респираторного синдрома свиней……………………………………………………………………….570
Лабораторная диагностика синдрома «голубой глаз» свиней…………..571
Лабораторная диагностика оспы свиней………………………………….572
Лабораторная диагностика реовирусной инфекции овец……………….575
Лабораторная диагностика оспы овец…………………………………….577
Список сокращений………………………………………………………...579
Содержание…………………………………………………………………581
Список используемой литературы………………………………………...584
Использованная литература
Адамов А.К., Агафонов В.И. Суспензионные антигены, антитела и иммуносорбенты. М., 1969.
Акатов А.К., Зуева В.К. Стафилококки. М.: «Медицина», 1983.
Альтон Д., Джонс A.M. Объединенный комитет ФАО/ВОЗ по бруцеллезу. Четвертый доклад. Женева, 1995.
Ананьин В.В. В кн. «Лептоспирозы людей и животных». М.: «Медицина», 1971.
Антонов Б.И, Борисова В.В, Волкова П.М. и др. Лабораторные исследования в ветеринарии. Справочник. - М.: Агропромиздат, 1986.
Ахметов A.M. Сальмонеллезы животных. М.: «Колос», 1983.
Ашмарин И.И. Практическая медицинская микробиология. М.: «Медицина», 1966.
Бабич М.А. Физико-химические методы контроля ингредиентов питательных сред и биопрепаратов. Метод, пособие для биофабрик и вет. лабораторий. М., 1970.
9. Бакулов И.А., Гаврилов В.А., Косаченко Н. и др. Докл. РАСХН, 1997, № 2, с. 40-42.
10. Бакулов И.А., Гаврилов В.А., Селиверстов В.В. Сибирская язва. Владимир: «Посад», 2001.
11. Бакулов И.А., Вишняков И.Ф., Власов Н.А. и др. Особо опасные болезни животных. Покров.: ВНИИВВиМ, 1998.
12. Бектимиров М.А. Разработка методов диагностики копытной гнили овец, выделение и изучение биологии возбудителя. М., 1978.
13. Белая О.Ф., Черкасов В.Л., Белая Ю.А. и др. Реакция коагглютинации при кишечных инфекционных заболеваниях.//Методические рекомендации. М., 1990.
14. Белоусов В.И., Каврук Л.С, Малахов Ю.А. и др. Методические указания по бактериологической диагностике колибактериоза (эшерихиоза) животных. М., 2000.
15. Беляков В.Д., Ряпис Л.А., Илюхин В.И. Псевдомонады и псевдомо-нозы. М.: «Медицина», 1990.
16. Ветеринарная микробиология иммунология: Учебник /Под ред. проф. Н. А. Радчука. - М. Агропромиздат 1991.
17. Костенко Т.С., Скаршевская Е.И., Гительсон С.С. Практикум по ветеринарной микробиологии и иммунологии. М. Агропромиздат 1989.
18. Козловский Е. В, Емельяненко П.А. Ветеринарная микробиология и иммунология: Учебник. - М. Агропромиздат 1989.
19. Колычев Н. И. Ветеринарная микробиология и иммунология. Омск 1996г.
20. Практикум по ветеринарной микробиологии и иммунологии. Костенко Т.С., Родионова В.Б, Скородумов Д.И. М.: Колос, 2001.
21. Клиническая иммунология: Учебник /Под ред. А.В. Караулова. – М.: МИА, 1999.
22. Сидоров М.А, Скородумов Д.И, Федотов В.Б. Определитель зоопатогенных микроорганизмов. – М.: Колос, 1995.
23. Скородумов Д.И, В.В. Субботин, Сидоров М.А, Костенко Т.С. Микробиологическая диагностика бактериальных болезней животных. – М.:ИзографЪ, 2005.
24. Сюрин В.Н., Белоусова Р.В., Фомина Н.В. Ветеринарная вирусология. – Изд.2-е. – М.: Агропромиздат, 1991.
25. Сюрин В.Н., Белоусова Р.В., Фомина Н.В.. Диагностика вирусных болезней животных. – М.: Агропромиздат, 1991.
26. Сюрин В.Н., Самуйленко А.Я.,Соловьев Б.В., Фомина Н.В.. Вирусные болезни животных. – М.: ВНИТИБП,1998.
27. Сюрин В.Н., Белоусова Р.В., Соловьев Б.В., Фомина Н.В.. Методы лабораторной диагностики вирусных болезней животных. – М.: Агропромиздат, 1998.
28. Троценко Н.И., Белоусова Р.В., Преображенская Э.А.. Практикум по ветеринарной вирусологии. – М.: Колос, 1999.
