
- •Министерство сельского хозяйства
- •Формы взаимодействия микро и макро организмов
- •Характерные особенности инфекционной болезни
- •Методы лабораторных исследований
- •Лабораторная диагностикакоринебактериозов
- •Выделение и идентификация коринебактерии
- •Питательные среды
- •Бактериологическое исследование
- •Микроскопическое исследование исходного материала
- •Бактериологическое исследование
- •Микроскопическое исследование исходного материала
- •Биопроба. Проводят с целью выделения культуры возбудителя из исследуемого мате риала и проверки патогенных свойств выделенной культуры.
- •Микроскопическое исследование исходного материала
- •Выделение и идентификация культуры возбудителя
- •Питательные среды такие же как и при лабораторной диагностике актинобациллезной пневмонии свиней.
- •Микроскопическое исследование исходного материала
- •Выделение и идентификация культуры возбудителя
- •Выделение и идентификация культуры возбудителя
- •Сывороточно-дрожжевой бульон. Готовят так же, как и сывороточно-дрожжевой агар, но на основе жидкой питательной среды.
- •Лабораторная диагностика бортелиоза
- •Бактериологическое исследование
- •Выделение и идентификация бордетелл
- •Бактериологическое исследование
- •Питательные среды
- •Лабораторная диагностика сапа
- •Биопроба. Проводят с целью обнаружения возбудителя в исследуемом материале и подтверждения патогенных свойств выделенной культуры на золотистых хомячках, морских свинках.
- •Выделение и идентификация культуры возбудителя
- •Микроскопическое исследование исходного материала
- •Микроскопическое исследование исходного материала
- •Выделение и идентификация культуры возбудителя
- •Питательные среды
- •Питательные среды
- •Микроскопическое исследование исходного материала
- •Выделение и идентификация кампилобактерии
- •Серологическая диагностика
- •Питательные среды
- •Биопроба. Проводят в случаях, когда микроскопическое исследование материала дает отрицательные результаты. Заражают молодых кур, кроликов, морских свинок, белых мышей, куриные эмбрионы.
- •Питательные среды
- •Определение потребности в холестерине. От стерола не зависят ахолеплазмы, требуют его для своего роста микоплазмы, уреаплазмы и спироплазмы.
- •Питательные среды для культивирования микоплазм
- •Лабораторная диагностика контагиозной плевропневмонии крупного рогатого скота
- •Выделение и идентификация культуры возбудителя
- •Серологическая диагностика
- •Выделение и идентификация культур возбудителей
- •Микроскопическое исследование исходного материала
- •Выделение и идентификация микоплазм от овец и коз
- •Серологическая диагностика
- •Лабораторная диагностика микоплазмозов свиней
- •Микроскопическое исследование исходного материала
- •Выделение и идентификация свиных микоплазм
- •Серологическая диагностика
- •Лабораторная диагностика микоплазмозов птиц
- •Микроскопическое исследование исходного материала
- •Выделение и идентификация культур микоплазм
- •Серологическая диагностика
- •Лабораторная диагностика Ку-лихорадки
- •Бактериологическое исследование
- •Серологическая диагностика
- •Бактериологическое исследование
- •Микроскопическое исследование материала
- •Выделение и идентификация культуры возбудителя
- •Лабораторная диагностика неориккетсиоза собак
- •Микроскопическое исследование материала
- •Биопроба. На собаках путем заражения кровью или тканью селезенки можно проводить серийные пассажи возбудителя. Инкубационный период 6-12 дней. Серологическая диагностика
- •Лабораторная диагностика анаплазмоза крупного и мелкого рогатого скота
- •Микроскопическое исследование материала
- •Серологическая диагностика
- •Микроскопическое исследование материала
- •Лабораторная диагностика гемабартонеллеза кошек
- •Микроскопическое исследование материала
- •Биопроба. При внутривенном, интраперитонеальном или оральном заражении материалом кошек воспроизводится клинически выраженное заболевание.
- •Микроскопическое исследование исходного материала
- •Выделение и идентификация хламидии
- •Серологическая диагностика
- •Лабораторная диагностика бешенства
- •Индикация и идентификация вируса
- •Серологическая идентификация
- •Лабораторная диагностика ящура
- •Серодиагностика и ретроспективная диагностика
- •Лабораторная диагностика ортомиксовирусных инфекций
- •Лабораторная диагностика гриппа птиц
- •Серологическая идентификация
- •Лабораторная диагностика классической чумы свиней
- •Серологическая идентификация
- •Серодиагностика и ретроспективная диагностика
- •Индикация и идентификация вируса
- •Серодиагностика и ретроспективная диагностика
Лабораторная диагностика гриппа птиц
Поставить диагноз на грипп птиц можно путём выделения вируса и идентификации его в РСК, РН и РТГА, а также выявления специфических AT в процессе эпизоотии или по прошествии её (ретроспективная диагностика). В нашей стране биопромышленность выпускает 2 диагностических набора:
а) набор специфических АГ и сывороток к ним для диагностики гриппа птиц 13-и серотипов;
б) диагностический набор для идентификации вируса НБ и Ш (актуального эпизоотического типа).
Выделение вируса. Взятие и подготовка материала. В качестве вируссодержащего материала используют селезёнку, головной мозг, синусы, трахею, лёгкие, воздухоносные мешки, кишечник от больной птицы или свежих трупов. Материал в лабораторию доставляют в замороженном виде в термосе со льдом. Инфекционные титры вируса в назальных смывах бывают максимальными через 2-4 дня после заражения птицы и достигают 105-107 ЭИДзо/мл смыва. Изолировать вирусы из клоачных смывов удаётся чаще всего на 5-8-й день после экспериментального заражения птицы.
Заражение куриных эмбрионов. Испытуемую суспензию инокулируют 9-10-дн КЭ (не менее 5 на одну пробу) в аллантоисную или амниотическую (лучше) полости общепринятым методом и инкубируют в течение 72 ч. Экстраэмбриональную жидкость каждого эмбриона раздельно проверяют на ГА-активность капельной РГА с 1 %-ной взвесью эритроцитов кур. При отсутствии положительной РГА проводят еще 3-5 слепых пассажей, используя для заражения КЭ эмбриональную жидкость предыдущего пассажа. Если титры ГА низкие, проводят таким же образом еще 2-3 дополнительных пассажа. Проба испытуемого материала считается отрицательной, если в 3-5 слепых пассажах не будет обнаружено ГА и патогенного действия вируса (гибели КЭ). При положительной РГА проводят идентификацию выделенного вируса.
Заражение культуры клеток. Вирус после 2-5 пассажей хорошо развивается в культуре фибробластов КЭ. ЦПД обычно проявляется через 24-48 ч (в зависимости от дозы и адаптации). Присутствие его устанавливают при помощи РГА и РГАд. Предложен ускоренный метод титрования инфекционности вируса гриппа в культуре клеток путем подсчета гемадсорбирующих клеток. Метод позволяет получить результат через 8 ч после заражения.
Биопроба на цыплятах. Испытуемую суспензию инокулируют цыплятам 2-3-месячного возраста. Летальную инфекцию у цыплят можно вызвать при любом методе заражения (подкожно, внутримышечно, в мозг, конъюнктиву) подтипами А1, А7 и А5. Заражение per os с кормом и водой удается непостоянно, лишь в случае высокой патогенности эпизоотического изолята гриппа. Зараженные цыплята, как правило, гибнут через 36-72 ч в зависимости от дозы и вирулентности возбудителя.
Индикация и идентификация вируса. Для этой цели широко используют методы ИФ, цитоскопию, биопробу (на птице и КЭ) и серологическую идентификацию. С помощью монАТ можно идентифицировать не только разные группы вирусов (ВГП и ПМВ), но и определять подтипы ВГП и серотипы ПМВ птиц, и даже штаммы внутри одного подтипа, а также локализацию компонентов вириона в зараженных клетках (МРВГП - МА клонов 1С6, 5С10, N:2 - МА клоны 303 и т.д.). На основе монАТ можно готовить диагностические препараты для выявления АГ и AT в РТГА, НИФ, РСК, ИФА и др. реакциях.
РГА. Для индикации вируса в патологическом материале можно использовать РГА. Надосадочную жидкость после центрифугирования суспензии проб из органов и тканей больной птицы, а также смывов исследуют в капельной или пробирочной РГА с 1%-ной суспензией эритроцитов кур или 0,5%-ной взвесью эритроцитов морской свинки. Реакцию учитывают через 20 мин и 1 ч. Специфичность определяют в РТГА.
Цитоскопия. Метод заключается в исследовании тканевых элементов в отпечатках, полученных со слизистой оболочки верхних дыхательных путей (лучше) и органов. Препараты высушивают и окрашивают одним из методов: по Романовскому, Пигаревскому, Быковскому и т. п. При окраске по Быковскому и Пигаревскому в цитоплазме клеток при гриппе обычно обнаруживают тельца-включения ярко-красного цвета; при окраске по Романовскому - фиолетового цвета. Внутриклеточные включения находят не только в клетках цилиндрического эпителия, но и в цитоплазме макрофагов, лейкоцитов и плоского эпителия. В настоящее время этот принцип исследования используется с применением люминесцентной микроскопии.
Метод простого флюорохромирования. На мазки-отпечатки из органов и смывов наносят 1-2 капли рабочего раствора акридина оранжевого (1:10000), покрывают покровным стеклом и свежий препарат (в течение 10 мин после приготовления) рассматривают в люминесцентном микроскопе. Ядра клеток выявляются по изумрудно-зеленому свечению, РНК плазмы клеток - в виде не резко ограниченных гранул красного или оранжевого цвета. В препарате, имеющем вирус гриппа, выявляются включения в виде четко отграниченных ярко-красных гранул в цитоплазме клеток.
Серологическая идентификация
Для идентификации гриппа млекопитающих и птиц наиболее простым и высоко достоверным методом является РТГА. РН - штаммоспецифическая и также высоко достоверная, но используется в диагностике значительно реже. Ее обычно применяют при некоторых неясных и спорных случаях.
Реакция связывания комплемента. Используют для определения типоспецифичности выделенного вируса, когда в РТГА не удается установить родственных связей между выделенным и эталонными штаммами вируса гриппа по антисывороткам к ним. В этом случае в РСК с эталонными иммунными сыворотками против вирусов гриппа типов А, В и С устанавливают типовую принадлежность штамма.
В последнее время для типирования нейраминидазы вируса начали применять РТНА, но в диагностической ветеринарной практике она пока еще не применяется. Ее используют, в основном, для изучения АГ связей различных штаммов вируса гриппа.
Реакция торможения гемагглютинации. Идентификацию испытуемого вируса проводят с набором эталонных штаммоспецифических гриппозных сывороток к его АГ вариантам. Для дифференциации в реакцию вводят сыворотку против вируса НБ. РТГА ставят микро- или макрометодом по общепринятой методике.
Иммуноферментный метод. Может быть использована как экспресс-метод диагностики гриппа птиц. Препараты готовят непосредственно ex tempore от убитой больной или свежепавшей птицы. Прямой метод ИФ позволяет определять АГ ВГП в мазках-отпечатках тканей птиц, идентифицировать АГ данного вируса из различных тканей организма, инкубационных яиц, печени зараженных эмбрионов и культур клеток фибробластов; выявить вирусный АГ даже в тех случаях, когда вирус из пораженных тканей выделить не удается.
В ветеринарной диагностической практике для идентификации выделенного вируса РДП не используют, так как необходимы концентрированные и очищенные АГ. В основном применяют ее для изучения АГ структуры вирусов гриппа. Разработаны наборы для ИФА с монАТ, непосредственно обнаруживающие ГА, нуклеокапсидный или матриксный белки вируса гриппа. Идентификацию вирусспецифической нуклеиновой последовательности предлагается осуществлять ПЦР с 2-мя типами праймеров (на основе генов неструктурного белка и ГА). Тест стандартизован для определения AT к ВГП в сыворотке крови у индеек.
Минимальные АГ различия между вариантами и родительским вирусом выявлялись только монАТ, продуцируемыми клетками гибридомы PEG-1 или фрагментами селезенки гипериммунных животных. МонАТ дают возможность точно проследить филогенетические взаимоотношения между вирусными штаммами в составе субтипа, а в сочетании с методами пептидного картирования и определения последовательности а.к. - выяснить молекулярную структуру АГ участка ГА.
Серодиагностика и ретроспективная диагностика. Обнаружение анти-ГА, ВНА и КСА - надежный признак протекающей или уже прошедшей инфекции ГП в стаде.
РТГА. Исследование парных сывороток проводят с диагностической целью при атипичном, часто вялом течении болезни с поражением органов дыхания. Сыворотку от диких птиц на присутствие противогриппозных AT исследуют при изучении роли перелетных птиц в распространении гриппа. Обязательным условием для ретроспективной диагностики ГП является одновременное исследование парных сывороток, так как для диагностических целей имеет значение сравнительный титр AT против вирусов различных серологических подтипов в 1-й и 2-й пробах сыворотки. Первую пробу сыворотки хранят при 4°С или в замороженном виде. Обе пробы исследуют одновременно. Перед постановкой реакций сыворотки прогревают при 60°С 30 мин, а затем освобождают от термостабильных ингибиторов, используя СО2, КО4 и др. методы. Если титр AT во 2-й пробе сыворотки (через 10-14 дн после заболевания) превышает не менее чем в 4 раза титр AT к тому же типу вируса в 1-й пробе, то РТГА считается положительной, подтверждающей диагноз гриппа птиц. При постановке РТГА с парными сыворотками больных птиц необходимо использовать не только набор эталонных штаммов (например, к вирусам A/Fowl plague, A/Chick/Scotland, A/Turkey, A/Duck), но и местные штаммы того птицехозяйства, где зарегистрирована болезнь. При анализе результатов РТГА необходимо указывать, сколько сывороток было с низким, средним и высоким титром к тому или иному штамму вируса гриппа. В ряде случаев вместо индивидуальных сывороток показатели иммунитета стада (после переболевания или прививки живой вакциной) можно изучить на сыворотках,.полученных от нескольких птиц. В этих случаях испытуемые сыворотки, взятые от отдельных птиц, нужно соединять в равных объемах. На протяжении опыта (120 дн после реконвалесценции) в сыворотках кур находили анти-ГА: до 75-го дня титры сохранялись примерно на одном уровне (5-5,8 log2), а в дальнейшем снижались (до 4,4-4,6 log2).
РСК применяют для обнаружения АГ и AT в целях ранней и ретроспективной диагностики гриппа. Ставят с аллантоисными жидкостями КЭ или с очищенными диагностикумами. РДП широкого применения не нашла, так как необходимы высокие концентрации чистых АГ. Среди исследователей нет единого мнения о чувствительности этой реакции. Некоторые авторы указывают, что чувствительность РДП сравнительно невысока, поскольку достоверные положительные результаты получали лишь при исследовании сывороток с титром AT в РТГА 1:80 и выше.
Реакция радиального гемолиза. В настоящее время используется для сероэпидемиологических исследований и при оценке эффективности противогриппозных вакцин. РРГ с ВГ А обладает выраженной штаммовой специфичностью: диаметр зон гемолиза с гомологичными АГ при исследовании сывороток хорьков, зараженных 6-ю различными вирусами, были в 1,5-3 раза больше, чем с гетерологичными. При правильном подборе штамма РРГ может быть с успехом использована для определения анти-ГА.
Показано хорошее совпадение результатов титрования AT в ELISA, РСК и ИФ. Однако в ELISA значительно выше (титр 1:481-1:1520), чем в РСК и РИФ. Сенсибилизацию лунок панелей проводят РНК-АГ вируса гриппа А. Предложен новый метод приготовления AT эритроцитарных диагностикумов к вирусам гриппа, которые с успехом могут быть изготовлены на основе любых штаммов вируса гриппа. Они позволяют определять типовую принадлежность эпизоотических и межэпизоотических штаммов ВГП, свиней и лошадей. В практической работе врачу ветеринарной лаборатории, возможно, придется встретиться не только с гриппом кур и уток, но и с гриппом индеек.
Таблица 107 - Лабораторные методы дифференциации гриппа и ньюкаслской болези птиц
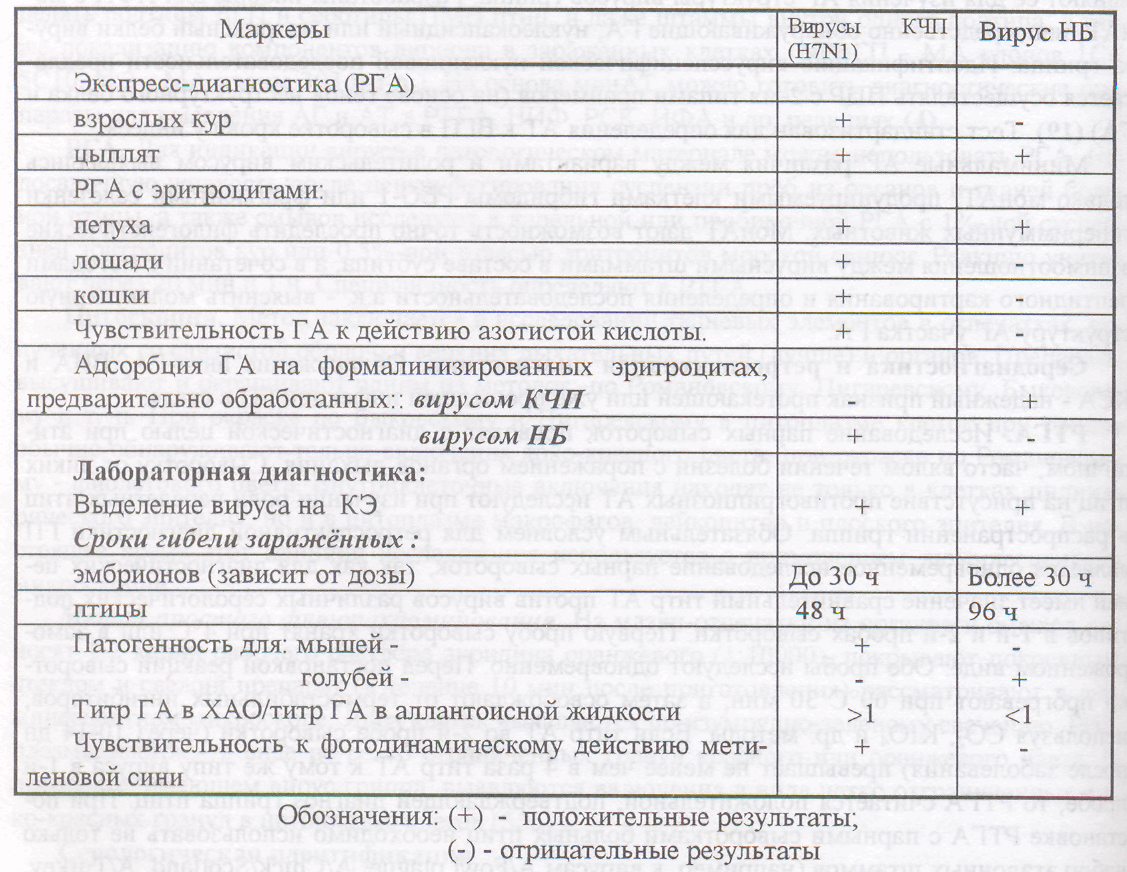
Умея диагностировать грипп кур и уток, имея набор диагностикумов, врач лаборатории при необходимости сможет поставить диагноз при гриппозной инфекции индеек.
При респираторных вирусных болезнях КРС, свиней и птиц (грипп, парагрипп, РС-инфекция) разработан направленный тест. Это новый иммуноферментный мембранный тест быстрого обнаружения вирусов гриппа в носоглоточных смывах. Чувствительность направленного метода Flu-А составляла 90%. С помощью этого теста более легко обнаруживается клеточно-ассоциированный АГ, присутствующий в клинических пробах, чем свободный вирус. С помощью Flu-А теста удалось обнаружить вирусы гриппа А птиц (субтипы ГА Н3 и Н6) и свиней (H1N1) в клоачных смывах и гомогенатах.
Дифференциальная диагностика. КЧП (H7N1) и другие формы гриппа птиц следует отличать от НБ, ИБ, ИЛТ, гемофилеза и респираторного микоплазмоза. Для идентификации вирусов НБ и КЧП используется диагностический набор.
В сомнительных случаях для дифференциального диагноза ставят РН на КЭ и заражают птиц, иммунных к вирусу НБ.
Лабораторная диагностика гриппа свиней
Грипп свиней (инфлюэнца свиней, энзоотическая бронхопневмония) - высоко контагиозная, остро протекающая болезнь, возникающая в холодное время года и характеризующаяся внезапным началом, резко выраженной лихорадкой, общей слабостью и поражением органов дыхания. Вирус гриппа свиней (ВГС) может вызвать заболевание людей и, наоборот, установлена возможность заражения свиней вирусом гриппа человека.
Болезнь впервые диагностирована в США в 1918 г. во время пандемии гриппа людей. Встречается во многих странах Европы и Америки, зарегистрирована и в бывшем СССР В отдельных хозяйствах причиняет большой экономический ущерб. Описана вспышка гриппа среди 115 свиноматок, вызванная "новым типом" вируса гриппа H3N2, который появился в Дании в 1990 г. Степень опоросов сократилась с 90 до 43% - через 14 дн после появления заболевания. Снизилось количество новорожденных поросят.
Выделение вируса. Выделение вируса на лабораторных животных. Используют хорьков, белых крыс, но чаще белых мышей. В качестве исходного материала для выделения вируса используют кусочки лёгкого, трахеи, бронхиальный экссудат, носовые смывы от больных свиней.
Мышей заражают интразально под эфирным наркозом и в течение 5- 7 дн наблюдают за ними, обращая внимание на общее состояние животных. Если животные не гибнут, их убивают. На вскрытии отмечают изменения в лёгких. Затем проводят ещё 3-4 пассажа. По мере адаптации вирулентность вируса для белых мышей значительно возрастает, они гибнут на 4-7-й, а иногда на 14-й день после заражения.
Выделение вируса на КЭ. Испытуемый материал инокулируют в аллантоисную или амниотическую полости 9-12-сут КЭ, которые после заражения инкубируют 48-72 ч, иногда до 96 ч при температуре 37°С. Для выделения вируса обычно проводят 2-3 слепых пассажа.
Выделение вируса в культуре клеток. Культура клеток почек поросёнка - универсальная биологическая система, применяя которую можно выделить вирус от больных свиней. Для быстрой индикации вируса гриппа в 1-слойных культурах почечного эпителия поросят используют РГАД с эритроцитами курицы, морской свинки или 0-группы человека. ГАд, положительная РГА, а также дегенеративные изменения клеток указывают на присутствие вируса в исследуемом материале. Вирус, вызвавший явление ГАд, должен адаптироваться к КЭ и вызывать накопление ГА.
Риноцитоскопия. Со слизистой оболочки носа делают мазки-отпечатки. Положительный диагноз ставят на основании обнаружения в отпечатке в первые 1-3 дн болезни большого количества клеток цилиндрического эпителия. Позднее содержание цилиндрических клеток в мазке уменьшается. Вопрос о диагностическом значении цитоплазматических включений при гриппе свиней неясен; в литературе нет достаточно обоснованных сообщений.
Обнаружение вируса в РГА. При постановке РГА обычно используют эритроциты кур или морской свинки. Берут 0,5 мл носового смыва, добавляют 0,5 мл 0,5%-ной взвеси эритроцитов, тщательно встряхивают и оставляют при комнатной температуре на 1-2 ч. Результаты реакции учитывают общепринятым методом. Чувствительность реакции можно повысить, увеличив объем испытуемых смывов. РГА со смывами используют только при массовом заболевании гриппом, так как процент специфических реакций не превышает 30.
