
- •Содержание
- •Часть 1. Предмет патологии. Учение о болезни (Куликов в.П., Доронина н.Л.)... 8
- •Часть 2. Механизмы развития болезней (Куликов в.П., Доронина н.Л.) 15
- •Часть 3* Патология органов и систем (Куликов в.П., Доронина н.Л.) 157
- •Часть 4. Ситуационные задачи (Куликов в.П., Костюченко л.А., Доронина н.Л,
- •Часть 5. Тестовые задания (Куликов в.П., Костюченко л.А., Воронцов в.В.,
- •Часть 6. Задания для подготовки к занятиям. Вопросы к экзамену (Куликов в.П.,
- •Часть 1. Предмет патологии. Учение о болезни.
- •I. Предмет патологии.
- •IIII Понятие болезни. Патологические реакции, процессы, состояния. Симптом и синдром. Классификация, стадии развития и исходы болезней.
- •IV. Умирание. Терминальные состояния.
- •VI. Патогенез заболеваний. Саногенез.
- •VII. Лечение заболеваний
- •Часть 2. Общая патология. 2.1 .Повреждение клетки.
- •IV. Общий адаптационный синдром. Схема развития симпато-адреналовой и гипоталамо-гипоФизарно-адреналовой реакций при стрессе. Стресс-реализующие и стресс-лимитирующие системы.
- •Стадии стресса или общего адаптационного синдрома:
- •V. Дистресс Болезни адаптации. Ятоогенные осложнения вследствие использования аналогов стресс-реализующих гормонов.
- •IV. Механизм Формирования патологии у плода при алкоголизме беременной женщины.
- •V. Методы изучения наследственных болезней.
- •2.4. Нарушение регионального кровообращения. Тромбозы и эмболии.
- •7. Характер движения крови по сосудам:
- •IV. Виды региональных нарушений кровообращения и их механизмы. Сладж-Феномен.
- •V. Методы оценки сосудистой гемодинамики.
- •2.5. Патология гемостаза.
- •V. Гипокоагуляиии. Связанные с дефицитом плазменных прокоагулянтов
- •2.6. Гипоксия.
- •I. Понятие гипоксии.
- •V. Адаптивные реакции организма: срочные и долговременные (дыхательные, гемодинамические, гемические, тканевые). Срочная адаптация к гипоксии (или 1-ая стадия долговременной адаптации)*
- •2.7. Патофизиология боли.
- •II. По характеру:
- •III. Понятия обморока и коллапса. Отличия от шока.
- •IV. Кома. Этиология и патогенез отдельных видов ком (печеночная, уремическая, диабетическая).
- •2.9. Воспаление.
- •III. Стадии опухолевого роста.
- •IV. Свойства опухолевого роста.
- •V. Опухолевые маркеры. Механизмы изменения иммунного надзора при
- •2.13. Патология углеводного обмена. Сахарные диабеты.
- •IV. Нарушение платочного метаболизма липидов. Жировая инфильтрация органов.
- •V Этиология и патогенез атеросклероза. Стадии развития атеросклероза и осложнения.
- •2.15. Патология белкового обмена.
- •IV. Вторичные нарушения обмена аминокислот. Патология конечных этапов белкового обмена, роль печени и почек е метаболизме аммиака. Нарушение обмена пуриновых и пиримидиноеых оснований.
- •Часть 3. Патология органов и систем. 3.1. Патология красной крови.
- •IV. Этиология и патогенез гемолитических анемий.
- •2. Липидзависимые мембранопатии:
- •3. Ферментопатии:
- •4. Гемоглобинопатии:
- •V. Этиология и патогенез дизэритропоэтических анемий.
- •VI. Компенсаторные реакции организма при анемиях.
- •3.2. Лейкоцитозы и лейкопении. Лейкозы.
- •I. Лейкоцитозы.
- •IV. Лейкемоидные реакции. Виды. Причины возникновения.
- •V. Лейкозы. Общая характеристика,
- •I. По виду клетки-«родоначальницы» лейкоза:
- •VI. Лабораторная характеристика лейкозов. Отличия лейкозов от лейке-моидных реакций.
- •VII. Общие изменения е организме при лейкозах.
- •3.3. Сердечная недостаточность.
- •2. Гипертрофия левого предсердия
- •1. Гипертрофия правого желудочка
- •2. Гипертрофия левого желудочка
- •1, Нервная регуляция.
- •1А} Норма
- •IV, Диагностика аритмий.
- •3.7. Патология артериального давления и сосудистого тонуса.
- •Резервный
- •VI. Компенсаторные процессы при недостаточности внешнего дыхания.
- •IV. Расстройства функции тонкого и толстого кишечника: секреции, переваривания, всасывания и моторики.
- •1. Усиление перистальтики кишечника.
- •2. Ослабление перистальтики кишечника.
- •V. Нарушение барьерной функции кишечника. Дисбактеоиоз.
- •I Повышение проницаемости мембранПовреждение мембран клеток с их частичной или полной деструкцией
- •Часть 4. Ситуационные задачи.
- •Часть 5. Тестовые задания.
- •Часть 6. План практических занятий. Вопросы к экзамену. 6.1. План практических занятий по патофизиологии.
Часть 2. Общая патология. 2.1 .Повреждение клетки.
Повреждение клетки - нарушение функционирования клетки, связанное с разрушением ее структурных элементов, которое сохраняется какое-то время после удаления повреждающего агента, или приводит к ее гибели.
Клетка - структурно-функциональная, саморегулирующаяся единица организма. В конечном счете, любая патология сопровождается повреждением клетки.
/. Факторы, повреждающие клетку. Специфические и неспеииФические проявления повреждения.
Первично экзогенные либо эндогенные повреждающие клетку фактотры можно классифицировать на три группы:
Л Физические (механические, температурные, осмотические, гравитационные, электромагнитные воздействия, ультрафиолетовое, ионизирующее, ультразвуковое облучение и др.)
Химические (кислоты, щелочи).
Биологические (бактерии, вирусы, грибы, риккетсии, гельминты).
Некоторые специфические проявления повреждения клеток могут быть обусловлены природой повреждающего агента, так термические и химические воздействия сопо-вождаются массивной денатурацией белков, повреждение клеток при воздействии ультразвука осуществляется преимущественно за счет возникновения эффекта кавитации, ионизирующие излучения провоцируют чрезмерную активацию процессов свободно-радикального окисления и т.д.
К неспецифическим проявлениям повреждения клеток, т.е. регистрирующимся независимо от особенностей повреждающего агента, можно отнести следующие:
1, Увеличение проницаемости клеточных мембран, нарушение работы ионных насосов. Клеточная мембрана в норме избирательно (селективно) проницаема для ионов идругих низкомолекулярных веществ. При повреждении клетки проницаемость ее мембраны нарушается в направлении снижения избирательности, что, прежде всего, обусловленонарушением работы энергозависимых ионных мембранных каналов, вследствие нарушения биоокислительных процессов и дефицита АТФ. В клетке в избытке накапливаютсяионы Са** и Иа4", а концентрация ионов К"1" снижается. На рисунке 2.1.1. схематически указаны пути проникновения ионов внутрь клетки и концентрации Ыа+, К+ и СГ в норме.
2. Из-за ионного дисбаланса разность концентрации ионов по обе стороны клеточноймембраны снижается, что приводит к снижению мембранного потенциала (частичнойдеполяризации мембраны), сниэюению возбудимости и нарушению функционированияклетки.

Набухание и отек клетки. Отек неповрежденной клетки не возникает, поскольку исправно работает Ка+-К+-АТФаза, удаляя из клетки Ма+ и «закачивая» в нее К+. При повреждении в клетке накапливается №С1, что приводит к увеличению осмотического давления и гипергидратации клетки. Формированию внутриклеточного отека, кроме того, способствует увеличение внутриклеточного онкотического давления, что связано с альтерацией.
Нарушение обменных процессов, активности ферментов и энергообеспечения клетки. При повреждении митохондрий, дефиците кислорода в клетках начинает прева-лировть наиболее энергетически невыгодный анаэробный гликолиз, следствием которого является внутриклеточный ацидоз из-за накопления недоокисленных продуктов, в частности лактата, В условиях ацидоза нарушается работа ферментов, что еще более усугубляет нарушения метаболизма клетки.
"• Роль гистогематических барьеров. Зависимость токсичности химических соединений от степени липофильности.
Существенное влияние на характер распределения химических соединений и их влияние на клетки оказывают биологические барьеры (кожа; слизистые; гисто-гематические барьеры - сложные композиты, включающие в себя структуры сосудистой стенки и периваскулярных пространств, например, гематоэт^ефолический, плацентарный барьеры).
Через стенку капилляров большинство низкомолекулярных химических соединений проходит довольно легко. Гидрофильные соединения (водорастворимые витамины, различные метаболиты), являются сравнительно менее токсичными, поскольку, проходя через поры стенки капилляров и попадая в интерстициальное пространство, внутрь клеток они могут проникнуть лишь при участии транспортных систем, с затратой АТФ. Липофильные соединения (аммиак, билирубин, жирорастворимые витамины, стероидные гормоны) хорошо проникают через эндотелий капилляров и клеточные мембраны, поэтому их повреждающие действие существенно выше.
Многие вещества не проникают в головной мозг благодаря наличию гематоэнце-фалического барьера. Эндотелий капилляров мозга не имеет пор, через которые в обычных капиллярах проходят многие вещества. В капиллярах мозга практически отсутствует пи-ноцитоз.Глиальные элементы (астроглия), выстилающие наружную поверхность эндотелия, очевидно, играют роль дополнительной липидной мембраны. Через гематоэнцефалический барьер плохо проходят полярные соединения. Липофильные молекулы проникают в ткани мозга легко. Имеются отдельные небольшие участки головного мозга, в которых гемато-эннефалический барьер практически неэффективен (область эпифиза, задней доли гипофиза и др.). Следует также иметь в виду, что при некоторых патологических состояниях (например, при воспалении мозговых оболочек) проницаемость гематоэнцефалического барьера повышается.
Сложным биологическим барьером является плацентарный барьер. Через него также проходят липофильные соединения (путем диффузии). Ионизированные полярные вещества (например, четвертичные аммониевые соли) через плаценту проникают плохо.
'"• Механизмы и стадии умирания клетки. Роль кальция. Аутолиз. Понятие некроза и апоптоза. Механизмы повреждения клеточных структур
Липидный механизм. 1. Свободнорадикальное(СРО) и перикисное окисление липидов(ПОЛ)
Свободные радикалы - это атомы (или молекулы) с неспаренными электронами на внешних атомных или молекулярных орбитах, отличающиеся высокой реакционной способностью (супероксидный радикал (V, гидроксидный радикал #ОН, оксид азота N0 и
16
перекись водорода Н2О2 (не является свободным радикалом, но в результате менталлока-тализа превращается в гидроксильный радикал) и др.).
Неспаренные электроны стремятся ликвидировать феномен неспаренности двумя путями.
Взаимодействием с другими свободнорадикальными атомами (или молекулами) с образованием химически инертного продукта.
«Выдергиванием» неспаренного электрона с противоположным спином из внешней оболочки свободных или связанных атомов. Объектом такого воздействия являются переходные металлы, богатые неепаренными электронами, в результате взаимодействия радикал становится химически инертным (тушится), а металл изменяет заряд. Но свободные радикалы способны «выдергивать» электроны и из биоорганических соединений, которые превращаются в свободнорадикалъные (перикисные) соединения с патологическим нарушением биохимических процессов.
Физиологическое значение свободных радикалов заключается в регуляции генетической программы и апоптоза, образовании катехоламинов, стероидных гормонов и др., детоксикации ксенобиотиков, медиаторов и гормонов, разрушении фагоцитированных структур в фагоцитах.
ПОЛ - физиологический процесс регуляции клеточной активности, однако при избытке свободных радикалов приводит к гибели клетки.
Патологический эффект в организме возникает при избыточной продукции свободных радикалов, или при дефиците антиоксидантных факторов.
При избытке образования свободных радикалов структуры клетки разрушаются, и она гибнет.
Антиоксидантная система подразделяется на неэнзимную и энзимную, а) Неэнзимные антиоксиданты являются донорами электронов для радикальных молекул, превращают их в инертные молекулы, но являются «двуликими» и сами становятся свободнорадикальными. Выполняют лишь буферную роль в антиоксидантной защите организма.
водорастворимые соединения {аскорбиновая кислота, мочевая кислота, глюта-тион);
жирорастворимые соединения (а-токоферол, ретинол).
спирты и тиолы (цистеин, дитиотретиол, маннитол, тиомочевина, этанол и др.)
Ь) Ферментные антиоксиданты способны выступать в качестве доноров или акцепторов свободных электронов, являются основной защитой организма от оксидативного стресса.
супероксиддисмутаза нейтрализует свободнорадикальный кислород с образованием перекиси водорода и атомарного кислорода;
каталаза разлагает перекись водорода;
глутатионпероксидаза в цитозоле клеток разлагает перекись водорода.
с) Липидные антиоксидантные «ловушки» (перехват свободных радикалов) - это холе-стерол клеточных мембран, гидрофильные головки фосфолипидов клеточных мембран.
Активация фосфолипаз ионами Са++, что приводит к расщеплению структурных элементов мембран и образованию лизофосфолипидов (детергентов).
Накопление свободных жирных кислот, обладающих детергентными свойствами.
Кальииевые механизмы
При накоплении Са4^ в гиалоплазме клеток начинается активация ферментов, в частности, в мышечной клетке происходит активация калъмодулина, что способствует сокращению мышечного волокна, повьппение активности протеинкиназ потенцирует син-
17
тез
белка и, следовательно, гипертрофические
изменения. При участии Са осуществляется
активация фосфолипаз
-
ферментов, расщепляющих фосфолипиды
клеточных мембран, в результате
происходит аутоЛиз клетки при участий
протеолитических ферментов поврежденных
лизосом, кроме того, повреждение мембран
митохондрий сопровождается выходом
из них Са"14"
(митохондрии аккумулируют Са**) и
увеличению выраженности клеточной
альтерации.
Основные проявления повреждения клеток
Дистрофия - это нарушение обмена веществ в клетке (трофики), сопровождающееся нарушением функции и структуры клетки и ведущее к ее гибели,
Дисплазия - это нарушение развития клеток, проявляющееся стойким нарушением их структуры и функции, ведущее к нарушению их жизнедеятельности. Вызывают дисплазии различные факторы, повреждающие клеточный геном. В отличие от дистрофий дисплазии необратимы. Основной механизм дисплазии - нарушение дифференци-ровкиклеток.
3. Некроз - это необратимая гибель клеток.Стадии умирания клетки: *
Паранекроз - сходное с гибелью обратимое изменение обмена веществ и функционирования клетки под влиянием патогенного фактора.
Некробиоз - необратимое состояние между жизнью и смертью, агония клетки.
Некроз - гибель клетки.
Аутолиз - саморазрушение клеточных структур и клетки в целом. Механизмы аутолиза - гидролиз компонентов клеток и межклеточного вещества под влиянием ферментов лизосом (основной) и свободнорадикальное и пе-рекисное окисление липидов.
Виды некроза: а) Морфологическая классификация:
коагуляционный (сухой) некроз характеризуется преобладанием процессов коагуляции и обезвоживания в богатых белками тканях (сердце, мышцы, печень, почки).
колликвационный (влажный) некроз формируется в хорошо гидратирован-ных тканях (мозг), характеризуется разжижением, размягчением с образованием кист и полостей.
Ь) Анатомическая классификация:
инфаркт - некроз, сформировавшийся в результате прекращения кровоснабжения органа (или ткани).
гангрена - вид некроза тканей, соприкасающихся с внешней средой (сухая и влажная).
секвестр - отделение омертвевшего участка от живых тканей (например, при остеолмиелите).
4. Апоптоз - запрограммированная, активная (энергозатратная) форма гибеликлеток, проявляющаяся уменьшением ее размеров, конденсацией и фрагментацией хроматина, уплотнением мембраны без выхода содержимого в окружающую среду.
Апоптозом управляют особые гены: стимулирует апоптоз ген р53 (ему принадлежит важнейшая роль в противоопухолевой защите), ингибирует апоптоз - ген Ьс12 (относится к протоонкогенам из-за его способности предотвращать апоптоз и сохранять клетки с мутациями).
Апоптоз противопоставляется другой распространенной форме гибели клеток - некрозу.
18
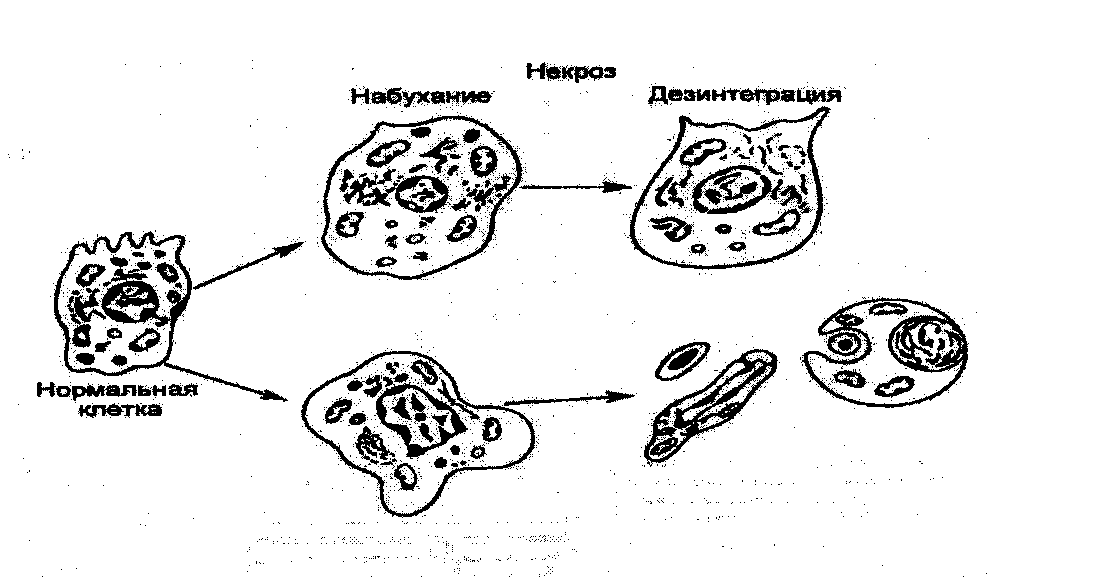
Апоптоз Рис. 2.1.2. Сравнительное изображение развития некроза и апоптоза клеток [по Ярилину А.А., 2001].
Апоптоз проявляется уменьшением объема клетки в противоположность ее набуханию при некрозе; конденсацией и фрагментацией хроматина; снижением трансмембранного потенциала митохондрий; уплотнением цитоплазматической мембраны без выхода содержимого в окружающую среду (рис.2.1.2.).. В результате фагоцитоза, которому клетки подвергаются уже в процессе апоптоза, их содержимое не выделяется в окружающую среду, как это бывает при некрозе, когда вокруг гибнущих клеток скапливаются активные внутриклеточные компоненты, включая энзимы, закисляется среда, что способствует гибели других клеток и развитию очага воспаления. Апоптоз поражает индивидуальные клетки и практически не отражается на их окружении. Физиологическая роль апоптоза:
Поддержание постоянства численности клеток (своего рода контроль перенаселения).
Определение формы организма и его частей (например, наблюдается интенсивный апоптоз нервных клеток в процессе формирования коры у зародыша на 12-23-й неделях беременности).
Обеспечение правильного соотношения численности клеток различных типов (быстрая атрофия гормон-зависимых тканей при снижении концентрации соответствующих гормонов, например, в женских половых органах в течение менструального цикла, или в простате при снижении концентрации андрогенов).
Удаление генетически дефектных клеток.
Селекция лимфоцитов и регуляция иммунных процессов.
Патология, обусловленная нарушением апоптоза:
А) Ослабление апоптоза
• аутоиммунные процессы (семейный аутоиммунный лимфопролиферативныйсиндром, системная красная волчанка, ревматоидный артрит);
злокачественные опухоли (лимфома Беркитта, лейкозы, солидные опухоли). В) Ускорение апоптоза
врожденные уродства (волчья пасть, заячья губа и др.);
19
болезни крови (миелодисплазии, анемии (железо- фолио- В12 - дефицитные), тромбоцитопения, нейтропения).
инфекционные заболевания (СПИД, бактериальный сепсис и др.);
дистрофические заболевания нервной системы (боковой амиотрофический склероз, болезнь Альцгеймера, спинальная мышечная атрофия);
другие заболевания (инфаркт миокарда, токсические гепатиты).
IV. Диагностика клеточного повреждения,
Для диагностики повреждения клетки используются морфологические, функциональные и биохимические методы. Морфологические методы предусматривают непосредственное исследование при помощи микроскопов ткани, клеток и субклеточных структур. Крупные очаги повреждения клеток (инфаркт мозга, абсцесс печени, язва желудка и др.) могут быть обнаружены при помощи инструментальных методов визуализации тканей (магнито-резонансная томография (МРТ), ультразвуковая визуализация, рентгенологические методы). Однако возможности этих методов ограничиваются величиной повреждения и доступностью для соответствующего исследования того или иного органа. Функциональное исследование повреждения клеток базируется чаще всего на изучении биоэлектрической активности органа: электрокардиография позволяет выявить наличие повреждения миокарда, его степень (ишемия, ишемическое повреждение, некроз), величину (мелко- и крупноочаговый инфаркт) и локализацию.
Большое распространение в диагностики повреждения клеток получили биохимические маркеры. Чаще всего это внутриклеточные белки, ферменты или ионы, которые выходят в кровь при повреждении клеток. К таким веществам относятся внутриклеточные ферменты - лактатдегидрогеназы и аминотрансферазы, которыми богаты паренхиматозные органы, креатинфосфокиназы (скелетные мышцы и сердце) и другие ферменты. Поскольку эти ферменты содержаться в клетках различных органов они являются неспецифическими маркерами повреждения клеток. Специфичность исследования можно повысить, если определять изоформу фермента специфичную для клеток какого-либо органа. Например, 4-5 изоформы лактатдегидрогеназы, содержатся в гепатоцитах, их определение в крови способствует установлению повреждения гепатоцитов.
Если анализ изоформ ферментов невозможен, используют косвенные приемы. Например, учитывая, что аспартатаминотрансфераза (АсАТ) преимущественно выделяется в кровь при повреждении кардиомиоцитов, а аланинаминотрансфераза (АлАТ) при деструкции клеток печени, подсчитывают их отношение (коэффициент де Ритиса) и по преобладанию одного или другого фермента судят о локализации повреждения.
Неоднозначно оценивается появление в крови миоглобина (два источника - миокард и скелетные мышцы) и, тем более, калия, который выходит в кровоток при массивном повреждении любых клеток. Появление же в крови других маркеров весьма специфично: повышение гемоглобина свидетельствует о разрушении эритроцитов, тропонина -С - миокардиоцитов, увеличенная амилаза (диастаза) практически всегда говорит о заинтересованности поджелудочной железы.
Признаком неблагополучия клетки, нарушения в ней процессов биоокисления, может служить повышение уровня лактата в крови. Это свидетельствует о том, что клетки переходят на анаэробный способ получения энергии в такой степени, что печень не успевает синтезировать из лактата гликоген.
При активации свободнорадикального и перикисного окисления лиййдов, приводящего к деградации структур клетки в крови накапливается малоновый диальдегид, который служит маркером повреждения клеток и клеточных мембран.
V. Компенсаторные механизмы клетки пои повреждении.
1. Активация энергообеспечения клетки. Активация ферментов окисления и фосфо-рилирования. Активация гликолиза.
20
Активация антиоксидантных систем, буферных систем.

Активация функции ионных насосов и устранение ионного дисбаланса.
Репарация ДНК за счет активации соответствующих ферментов (антимутационные ДНК-азы, полимеразы, которые вырезают мутантный участок и достраивают комплиментарным правильным участком ДНК).
Активация антитоксических клеточных систем (цитохром Р450 повышает гидро-фильность веществ путем присоединения какой-нибудь молекулярной добавки, и тогда это вещество легче выводится из организма).
"Снижение функциональной активности клеток.
Регенерация - восстановление поврежденных структур.
Гипертрофия - увеличение объема и массы клеток и клеточных структур.
Гиперплазия - увеличение числа структурных элементов клетки, ткани.
Общий адаптационный синдром - системная реакция организма на повреждение, обеспечивающая увеличение резистентности его клеток к действию повреждающих факторов,
2.2. Реактивность. Резистентность. Стресс. Адаптация. Болезни адаптации.
/. Понятие и виды реактивности и резистентности.
Реактивность - свойство организма как целого отвечать изменениями жизнедеятельности на воздействие окружающей среды. Реактивность - один из важнейших факторов патогенеза болезней.
Течение болезни, в зависимости от реактивности организма, может быть:
Гиперэргическое (гиперэргия) - быстрое, яркое, выраженное.
Гипоэргическое {гшгоэргия) - затяжное, вялое со стертыми симптомами, низким уровнем фагоцитоза и образования антител.
• Дисэргическое {дшэргия) - извращенная реактивность.Виды реактивности:
Биологическая (видовая, первичная) - изменения жизнедеятельности, возникающие под влиянием обычных для каждого животного воздействий окружающей среды. Например, невосприимчивость человека к чумке собак, к гонорее и сифилису крупного рогатого скота и т. д. Зимняя спячка - видовой вариант изменения реактивности (суслики не болеют в период спячки чумой и туберкулезом).
Групповая - формируется у групп индивидуумов, находящихся под влиянием общего фактора чаще всего внутренней среды. Например, чувствительность к психоэмоциональному стрессу у гипер- и астеников. Реактивность мужчин и женщин. Возрастные изменения реактивности. Группы крови.
Индивидуальная - формируется в зависимости от совокупности конкретных факторов, в которых обитает и формируется организм (наследственность, возраст, пол, питание, температура, содержание кислорода).
По физиологической значимости может быть классифицирована на:
физиологическую (адекватная реакция в физиологических условиях без нарушения гомеостаза, например, иммунитет - специфическая, физическая нагрузка - неспецифическая).
патологическую (при воздействии болезнетворных факторов или неадекватных реакций на физиологические воздействия, например, аллергия, иммунодефицитные состояния - специфическая; шок, наркоз - неспецифическая).
По специфичности выделяют:
• специфическую (характерна для одного конкретного фактора - иммунная, реакциязрачка на свет).
21
•
неспецифическую
(характерна
для различных факторов - стресс-реакция,
парабиоз, фагоцитоз,
биологические барьеры).
В качестве меры реактивности часто используется порог. Под порогом понимается минимальная сила раздражителя, способная вызвать ответную реакцию. Например, оценка реактивности бронхов на вдыхание смеси, содержащей ацетилхолин, позволяет выявить снижение дозы вызывающей спазм бронхов (порога) и диагностировать гиперреактивность бронхов на ранних стадиях развития бронхиальной астмы.
Другой мерой реактивности является лабильность (функциональная подвижность) ткани, характеризующаяся максимальным числом возбуждений (потенциалов действия), которое ткань может воспроизвести при увеличении частоты действия раздражителя. Например, в электроэнцефалографии реактивность нейронов может быть оценена по их способности воспроизводить ритм фотостимуляции.
В качестве меры реактивности в медицине наибольшее распространение получила оценка реакции на дозированный раздражитель. Например, так проводится оценка реакции сердечно-сосудистой системы на физическую или психоэмоциональную нагрузки.
Оценка реактивности сердечно-сосудистой системы на легкую физическую нагрузку
по пробе Мартине.
Методика проведения, В положении сидя у пациента измеряют частоту сердечных сокращений (ЧСС). После этого предлагают выполнить 20 приседаний в течение 30 с. Сразу после выполнения нагрузки пациент садится и у него измеряют ЧСС в течение Юс, После этого пульс продолжают измерять в течение 3-х минут восстановительного периода с периодичностью 1 раз в минуту.
Для оценки результатов пробы вычисляют прирост ЧСС на физическую нагрузку (ФН) в процентах к исходному значению (индекс Мартине).
Индекс Мартине, % = (ЧСС после пробы /ЧССисх х 100)-100
Реактивность сердечно сосудистой системы расценивается как адекватная при индексе в пределах 25-75%. Превышение этого предела свидетельствует о гиперреактивности сердечно-сосудистой системы. Прирост ЧСС на нагрузку менее 25% указывает на гипореактивность. Очень приблизительно индекс Мартине позволяет оценить и физическую работоспособность, как меру резистентности и адаптивности. ФР считается отличной при значении индекса Мартине менее 25 %, хорошей при его значении в пределах 25-50 %, удовлетворительной - 50-75 % и неудовлетворительной при значении более 75%.
Адаптация организма к физической нагрузке характеризуется также временем восстановления ЧСС до исходной величины: хорошая - восстановление в течение 1 мин., удовлетворительная - 2 мин.? плохая - 3 мин. и более.
Резистентность (устойчивость) - это свойство организма противостоять различным воздействиям или невосприимчивость к воздействиям повреждающих факторов * внешней среды.
Формы резистентности:
Абсолютная - реализуется всегда.
Относительная - реализуется при определенных условиях.
Пассивная, связанная с анатомо-физиологическими особенностями организма.
Активная^ связанная с одной стороны с устойчивостью биологической системы, с другой - способностью перестраиваться при изменении внешних условий (лабильностью) и которая осуществляется благодаря механизмам активной адаптации.
Первичная или наследственная форма.
Вторичная, приобретенная или измененная форма. *
Специфическая - устойчивость к действию какого-то одного агента. Неспецифическая - устойчивость к действию многих факторов.
Общая - устойчивость всего организма.
Местная - устойчивость отдельных участков органов или систем тела.
22
Мерой резистентности в медицине чаще всего является величина стрессора, вызывающая повреждение. Например, в фармакологии в опытах на животных так устанавливается токсическая доза лекарств. Для этого подбирают дозу лекарства, вызывающую гибель половины экспериментальных животных (так называемая ЛД50). В кардиологии широко распространено исследование толерантности (переносимости) к физической нагрузке у больных ишемической болезнью сердца с целью установления резистентности миокарда к индуцированной физической нагрузкой ишемии. Ниже приводится пример теста, предназначенного для оценки стрессоустойчивости сердечно-сосудистой системы.
Оценка резистентности сердечно-сосудистой системы к психоэмоциональному стрессу.
Методика проведения: Оценку резистентности сердечно-сосудистой системы к психоэмоциональную стрессу проводят путем регистрации реакции сердечно-сосудистой системы на искусственно создаваемые условия легкого психоэмоционального напряжения. С этой целью чаще всего используют выполнение испытуемым интеллектуальной деятельности в условиях дефицита времени и оценочных реакций [Зависимость...,1987; Сшйа, Кез&т, 1992]. В одном из вариантов таких тестов испытуемому предлагают в максимально быстром темпе производить последовательное вычитание целого числа из целого уменьшаемого, например по 6 из 666. Вслух назывался результат каждого действия. Время счета 1 мин. Экспериментатор контролирует правильность выполнения действий и в случае ошибки делает замечание и поправляет испытуемого. Кроме того, трижды за время счета независимо от темпа испытуемому предлагают ускорить счет. До пробы и сразу после пробы определяют ЧСС.
Реакцию сердечно-сосудистой системы на психоэмоциональное напряжение рассчитывают в процентах прироста ЧСС на пробу.
Реакция ССС = (ЧСС после пробы / ЧСС исх. х 100) -100.
Если прирост ЧСС на пробу составляет более 30%, делают вывод о снижении стрессоустойчивости пациента. Реакция в пределах 10-30% прироста ЧСС характеризуется как нормальная стрессоустойчивость. Отсутствие реакции, как правило, связано с недостаточной значимостью созданной ситуации для испытуемого, с его психологическими особенностями, недостаточной кооперативностью поведения, или нарушением технологии тестирования. Снижение ЧСС на пробу свидетельствует об извращенной реакции на психоэмоциональный стресс.
II. Специфическая и неспецифическая адаптация. Кратковременная и долговременная адаптация. Адаптация - приспособление организма к условиям существования, обеспечивающее повышение устойчивости организма к условиям среды.
Специфическая адаптация - активация функциональной системы, ответственной за повышение устойчивости к конкретному фактору (физической нагрузке, холоду, гипоксии).
Неспецифическая адаптация - стандартная активация стресс-реализующей системы при действии значимого раздражителя.
Адаптаиионные реакции проходят в 2 этапа:
Срочный этап возникает непосредственно после начала действия раздражителя, может реализоваться лишь на основе ранее сформировавшихся физиологических механизмов (увеличение ЧСС, ЧД, бегство животного от опасности). При этом деятельность организма протекает на пределе его возможностей, но не всегда обеспечивает необходимый эффект.
Долговременный этап формируется постепенно в результате длительного и многократного действия на организм факторов среды, т.е. на основе многократного повторения срочной адаптации.
В результате усиления физиологической функции клеток, специфически ответственных за адаптацию, происходит активация генетического аппарата: увеличивается синтез нуклеиновых кислот и белков, образующие важные структуры клетки. Так формируется системный структурный след - основа перехода ненадежной срочной адаптации в устойчивую долговременную.
23
///. Механизмы адаптации организма к ксенобиотикам. Феномен привыкания к лекарственным веществам:
Большинство фармакотерапевтических средств относятся к ксенобиотикам, то есть к веществам, чужеродным организму. Защищаясь от них, организм включает:
"1. Механизмы их инактивации:
повышенное разрушение в печени и других клетках (защитные синтезы),
микросомальное окисление. 2. Механизмы их выведения путем:
усиления канальцевой секреции в почках,
снижения всасывания в кишечнике,
реабсорбции в почечных канальцах.
Эффекты препаратов на организм при этом снижаются, требуется возрастающая доза. Возникает феномен привыкания к лекарственному средству.
