
- •Содержание
- •Часть 1. Предмет патологии. Учение о болезни (Куликов в.П., Доронина н.Л.)... 8
- •Часть 2. Механизмы развития болезней (Куликов в.П., Доронина н.Л.) 15
- •Часть 3* Патология органов и систем (Куликов в.П., Доронина н.Л.) 157
- •Часть 4. Ситуационные задачи (Куликов в.П., Костюченко л.А., Доронина н.Л,
- •Часть 5. Тестовые задания (Куликов в.П., Костюченко л.А., Воронцов в.В.,
- •Часть 6. Задания для подготовки к занятиям. Вопросы к экзамену (Куликов в.П.,
- •Часть 1. Предмет патологии. Учение о болезни.
- •I. Предмет патологии.
- •IIII Понятие болезни. Патологические реакции, процессы, состояния. Симптом и синдром. Классификация, стадии развития и исходы болезней.
- •IV. Умирание. Терминальные состояния.
- •VI. Патогенез заболеваний. Саногенез.
- •VII. Лечение заболеваний
- •Часть 2. Общая патология. 2.1 .Повреждение клетки.
- •IV. Общий адаптационный синдром. Схема развития симпато-адреналовой и гипоталамо-гипоФизарно-адреналовой реакций при стрессе. Стресс-реализующие и стресс-лимитирующие системы.
- •Стадии стресса или общего адаптационного синдрома:
- •V. Дистресс Болезни адаптации. Ятоогенные осложнения вследствие использования аналогов стресс-реализующих гормонов.
- •IV. Механизм Формирования патологии у плода при алкоголизме беременной женщины.
- •V. Методы изучения наследственных болезней.
- •2.4. Нарушение регионального кровообращения. Тромбозы и эмболии.
- •7. Характер движения крови по сосудам:
- •IV. Виды региональных нарушений кровообращения и их механизмы. Сладж-Феномен.
- •V. Методы оценки сосудистой гемодинамики.
- •2.5. Патология гемостаза.
- •V. Гипокоагуляиии. Связанные с дефицитом плазменных прокоагулянтов
- •2.6. Гипоксия.
- •I. Понятие гипоксии.
- •V. Адаптивные реакции организма: срочные и долговременные (дыхательные, гемодинамические, гемические, тканевые). Срочная адаптация к гипоксии (или 1-ая стадия долговременной адаптации)*
- •2.7. Патофизиология боли.
- •II. По характеру:
- •III. Понятия обморока и коллапса. Отличия от шока.
- •IV. Кома. Этиология и патогенез отдельных видов ком (печеночная, уремическая, диабетическая).
- •2.9. Воспаление.
- •III. Стадии опухолевого роста.
- •IV. Свойства опухолевого роста.
- •V. Опухолевые маркеры. Механизмы изменения иммунного надзора при
- •2.13. Патология углеводного обмена. Сахарные диабеты.
- •IV. Нарушение платочного метаболизма липидов. Жировая инфильтрация органов.
- •V Этиология и патогенез атеросклероза. Стадии развития атеросклероза и осложнения.
- •2.15. Патология белкового обмена.
- •IV. Вторичные нарушения обмена аминокислот. Патология конечных этапов белкового обмена, роль печени и почек е метаболизме аммиака. Нарушение обмена пуриновых и пиримидиноеых оснований.
- •Часть 3. Патология органов и систем. 3.1. Патология красной крови.
- •IV. Этиология и патогенез гемолитических анемий.
- •2. Липидзависимые мембранопатии:
- •3. Ферментопатии:
- •4. Гемоглобинопатии:
- •V. Этиология и патогенез дизэритропоэтических анемий.
- •VI. Компенсаторные реакции организма при анемиях.
- •3.2. Лейкоцитозы и лейкопении. Лейкозы.
- •I. Лейкоцитозы.
- •IV. Лейкемоидные реакции. Виды. Причины возникновения.
- •V. Лейкозы. Общая характеристика,
- •I. По виду клетки-«родоначальницы» лейкоза:
- •VI. Лабораторная характеристика лейкозов. Отличия лейкозов от лейке-моидных реакций.
- •VII. Общие изменения е организме при лейкозах.
- •3.3. Сердечная недостаточность.
- •2. Гипертрофия левого предсердия
- •1. Гипертрофия правого желудочка
- •2. Гипертрофия левого желудочка
- •1, Нервная регуляция.
- •1А} Норма
- •IV, Диагностика аритмий.
- •3.7. Патология артериального давления и сосудистого тонуса.
- •Резервный
- •VI. Компенсаторные процессы при недостаточности внешнего дыхания.
- •IV. Расстройства функции тонкого и толстого кишечника: секреции, переваривания, всасывания и моторики.
- •1. Усиление перистальтики кишечника.
- •2. Ослабление перистальтики кишечника.
- •V. Нарушение барьерной функции кишечника. Дисбактеоиоз.
- •I Повышение проницаемости мембранПовреждение мембран клеток с их частичной или полной деструкцией
- •Часть 4. Ситуационные задачи.
- •Часть 5. Тестовые задания.
- •Часть 6. План практических занятий. Вопросы к экзамену. 6.1. План практических занятий по патофизиологии.
III. Стадии опухолевого роста.
Стадии канцерогенеза:
Индукция (инициация) заключается в мутации одного из генов, регулирующих клеточное размножение (протоонкоген превращается в онкоген) —> клетка становится потенциально способной к неограниченному делению; инициирующими факторами являются различные канцерогены.
Промоция (ускорение) - стимуляция клеточного деления промоторами, благодаря которой создается критическая масса инициированных клеток Промоторы - это химические вещества, не вызывающие повреждения ДНК, не являющиеся канцерогенами. Свою деятельность начинают онкогены —> синтезируются онкобелки —> количество инициированных клеток увеличивается.
Прогрессия - наряду с увеличением массы опухоли она постоянно приобретает новые свойства, «озлокачествляется» - все большую автономность от регулирующих воздействий организма, деструктивный рост, инвазивность, способность к образованию метастазов (обычно отсутствующую на ранних этапах) и, наконец, приспособляемость к меняющимся условиям.
Опухоль представляет собой потомство (клон) одной первичной клетки, которая в результате многостадийного процесса приобрела способность нерегулируемого роста. Первичная трансформированная клетка передает свои свойства только своим потомкам, т.е. «вертикально». При этом окружающие опухоль нормальные клетки в процесс перерождения не вовлекаются. Это представление получило название положения о клональном происхождении опухоли.
Клональная гетерогенность опухоли развивается из-за генетической нестабильности опухолевой клетки. Это приводит к появлению новых клонов, различающихся генотипи-чески и фенотипич'ески. В результате селекции отбираются и выживают самые злокачественные клоны. После химиотерапии остается всего 0,1% клеток опухоли, но так как клеточный цикл равен 24 часам, то опухоль может восстанавливаться через 10 суток и быть резистентной к прежней химиотерапии.
IV. Свойства опухолевого роста.
Атипизм (от а + греч. typicos - образцовый, типичный) - совокупность признаков, отличающих опухолевую ткань от нормальной, и составляющих биологические особенности опухолевого роста.
101
Анаплазия или катаплазия (от апа - обратное, противоположное, каtа - вниз + греч. plasis - формирование) - изменение структуры и биологических свойств опухоли, делающее их похожими на недифференцированные ткани.
Биологические особенности, характерные для доброкачественных и злокачественных опухолей:
1. Атипизм размножения - бесконтрольное деление опухолевых клеток.
нерегулируемое размножение клеток (например, ослабление свойств опухолевых клеток тормозить митотический цикл и передвижение при контакте друг с другом, т.е. отсутствие контактного торможения);
утрата верхнего «лимита» числа делений клетки (так называемого лимита Хайфли-ка): нормальные клетки делятся до определенного максимального предела (у млекопитающих в условиях клеточной культуры до 30-50 делений), после чего они погибают, а опухолевые клетки приобретают способность к бесконечному делению (иммор-тализация - «бессмертие» данного вида клеток).
2. Атипизм регуляции роста и дифференцировки (дедифференцировка) - частичноеили полное подавление процесса созревания клеток.
Опухоль приобретает сходство с эмбриональными клетками, (мало митохондрий, рецепторов, особые белки-фетопротеины), при этом созревание остановлено, нет специализации, обучения клеток.
Этот атипизм резко выражен у злокачественных опухолей и слабо - у доброкачественных. Причинами его являются утрата опухолью факторов, стимулирующих дифферен-цировку ее клеток, или пониженная чувствительность клеток к ним.
Процессы роста, дифференцировки и деления в норме находятся под контролем центральной эндокринной регуляции, которая осуществляется соматотропным гормоном, гормонами щитовидной железы, инсулином.
Кроме этих общих факторов, в каждой ткани существуют свои факторы роста и дифференцировки (фактор роста эпидермиса, тромбоцитарный фактор, интерлейкины).
Индукция роста и дифференцировки начинается с взаимодействия фактора роста с рецептором фактора роста на клеточной мембране (в опухолевой клетке этот этап может быть нарушен). На следующем этапе образуются вторичные посредники - циклические аденозин- и гуанозинмонофосфат, причем для нормального роста и дифференцировки характерно преобладание цАМФ. Образование цГМФ сочетается с усилением пролиферации. В опухолевых клетках это типичный признак.
3. Биохимический атипизм новообразований включает:
• интенсивный синтез онкобелков («опухолеродных» или «опухолевых» белков).
Эти белки обусловливают появление у клеток обязательных опухолевых особенностей (бесконтрольное деление, утрата лимита деления, иммортализация и др.). Синтез онкобелков программируется активными клеточными онкогенами. Активные онкогены выявляются только в опухолевых клетках, протоонкогены - во всех нормальных клетках.
• уменьшение синтеза и содержания гистонов (белков-супресеоров синтезаДНК).
Дефицит гистонов способствует активации синтеза ДНК- и РНК-матриц, что в свою очередь приводит соответственно к удвоению генов, хромосом, белковой массы и к делению клеток.
• образование несвойственных здоровым клеткам белков (например, а-фетопротеина)и других веществ, называемых онкомаркерами (позволяют обнаружить рецидив, илиметастазы опухоли на 3,5 месяца раньше появления клиники).
а-фетопротеин (АФП) синтезируется в норме в антенатальном периоде гепа-тоцитами плода (от лат. fetus - плод), но почти не образуется постнатальными, «зрелыми» гепатоцитами.
102
• изменение способа ресинтеза АТФ заключается в увеличении доли АТФ, образуемой в ходе гликолиза (анаэробного и аэробного) и уменьшения, соответственно, доли АТФ, ресинтезируемой в процессе тканевого дыхания (аэробного окисления).
В нормальных клетках и тканях в анаэробных условиях усиливается гликолиз. В присутствии кислорода он ингибируется (положительный эффект Пастера). Напротив, в опухолевых клетках интенсивный анаэробный гликолиз при смене анаэробных условий на аэробные не снижается, а сохраняется (отрицательный эффект Пастера).
Усиление гликолиза в опухолевых клетках обусловливает их высокую выживаемость в условиях гипоксии.
Преобладание гликолиза приводит к повышению концентрации молочной кислоты в клетках опухоли, характерен ацидоз, приводящий к нарушению жизнедеятельности самой клетки (зона некроза расположена обычно в центре опухоли).
• феномен субстратных «ловушек» заключается в усиленном захвате и использованиисубстратов для энергообразования (глюкозы), для построения цитоплазмы (аминокислот - отсюда «ловушка азота»), мембран клеток (холестерина), для защиты от свободных радикалов и стабилизации мембран (например, антиоксиданта - токоферола).
Эта особенность повышает выживаемость опухолевых клеток при контакте их с нормальными клетками в условиях инвазивного роста и метаста-зирования.
• снижение содержания в клетках опухолей цАМФ, оказывающего, как правило, тормозное влияние на их деление и увеличение цГМФ, стимулирующего пролиферациюклеток.
4. Физико-химический атипизм проявляется увеличением содержания в опухолевыхклетках воды, ионов калия и уменьшением в них кальция и магния.
увеличение содержания воды облегчает диффузию субстратов метаболизма внутрь клеток и его продуктов наружу.
снижение содержания Са2+ уменьшает межклеточную адгезию, а это в свою очередь облегчает «отшнуровывание» клеток от ткани опухоли и движение их в окружающие нормальные ткани при инвазивном росте.
увеличение содержания К+ препятствует в определенной мере развитию внутриклеточного ацидоза в связи с усилением гликолиза и накоплением молочной кислоты.
повышается величина отрицательного заряда поверхности опухолевых клеток, что способствует увеличению их взаимоотталкивания и проникновению по межклеточным щелям в нормальные ткани. Увеличение отрицательного заряда поверхности клеток происходит вследствие накопления на ней анионов нейраминовой кислоты.
повышается электропроводность и снижается вязкость клеточных коллоидов.
опухолевые клетки излучают в большом количестве митогенетические лучи Гурвича (ультрафиолетовые лучи с длиной волны 190-325 нм, способные стимулировать деление соседних клеток).
5. Функциональный атипизм проявляется нарушением функций клеток:
снижение секреции желудочного сока при раке желудка, образования желчи при раке печени и т.д.
неадекватное, нецелесообразное усиление функций, например повышение синтеза инсулина инсулиномой - опухолью из клеток островков Лангерганса поджелудочной железы вызывает гипогликемическое состояние, а в ряде случаев - гипогликемиче-скую кому.
«извращение» функций, например синтез опухолевыми клетками при раке молочной железы гормона щитовидной железы кальцитонина; синтез клетками при раке легких некоторых гормонов передней доли гипофиза - АДГ, АКТГ и др.
6. Антигенный атипизм состоит в разнонаправленных изменениях антигенного составаопухолевых клеток (антигенном упрощении или появлении новых антигенов).
103
антигенное упрощение - утрата опухолевыми клетками антигенов, имеющихся в исходных нормальных клетках (например, утрата раковыми гепатоцитами органоспеци-фического печеночного антигена, h-антигена).
появление новых антигенов, отсутствовавших в нормальных (например, эмбрионального антигена а-фетопротеина в раковых гепатоцитах).
Утрата клетками новообразований органоспецифического антигена и появление в них эмбриональных антигенов (к которым не образуются антитела, так как они воспринимаются иммунной системой как свои) способствуют антигенной «маскировке» опухолевых клеток и «неузнаваемости» их иммунной системой.
7. Морфологический атипизм делят на тканевый и клеточный.
Тканевый атипизм заключается в нарушении нормального соотношения тканевых структур.
Клеточный атипизм проявляется полиморфизмом - разной формой и размерами клеток (клеточный полиморфизм) и ядер (ядерный полиморфизм); увеличением ядерно-цитоплазматического отношения; гиперхромией ядер; изменением числа, формы и размеров хромосом (хромосомные аберрации); увеличением количества свободноле-жащих в цитоплазме рибосом, участвующих в синтезе белков, увеличением размеров и числа ядрышек в ядрах, увеличением числа митоза, появлением различных по величине и форме митохондрий.
8. Атипизм «взаимодействия» клеток опухоли с организмом.
Опухоль - «ловушка» питательных веществ, таких как глюкоза, азот, витамины —» развитие гипогликемии, анемии.
Изменение иммунного надзора (см. ниже).
Опухоль - источник биологически активных веществ: ростовые и ангиогенные факторы, эктопические гормоны (АКТГ при раке легкого), гиперпродукция или угнетение синтеза гормонов при опухолях эндокринных желез.
Паранеопластический синдром - проявление генерализованного воздействия опухоли на организм. Его формы разнообразны: состояние иммунодепрессии, гиперкоагуляция, сердечно-сосудистая недостаточность, мышечная дистрофия, пониженная толерантность к глюкозе, острая гипогликемия при опухолях больших размеров и др.
Одним из проявлений паранеопластического синдрома является раковая кахексия, которая возникает в периоде, близком к терминальному. Она характеризуется потерей массы тела в основном из-за усиленного распада белков скелетных мышц (частично миокарда), а также истощения жировых депо.
В развитие раковой кахексии вносят вклад ряд явлений, развивающихся в организме опухоленосителя:
нарушение нервно-эндокринной регуляции обмена веществ;
усиление образования АТФ за счет гликолиза, что повышает расход субстратов энергообразования;
ингибирование липопротеинлипазы, катализирующей накопление липидов в организме;
снижение синтеза РНК, обеспечивающих синтез белков и дифференцировку адипо-цитов;
образование фактора некроза опухолей, он же - кахектин - цитотоксический полипептидный гормон, известный также как TNF (tumor necrosis factor — фактор некроза опухолей). Он секретируется макрофагами и опосредует, воспалительные реакции. Практически все клетки организма обладают рецепторами к этому гормону, эффекты которого поэтому могут быть весьма многообразными: шоковое состояние, падение артериального давления, расстройства липидного и углеводного обмена, метаболический ацидоз, активация нейтрофилов вплоть до гибели организма, состояния анорексии и истощения организма.
104
снижение синтеза каталазы -> накопление избытка продуктов свободно-радикального и перекисного окисления;
сопутствующие опухоли осложнения: боль, кровотечение, нарушение функций га-строинтестинальной системы; феномен улавливания опухолью субстратов из крови.
Кахексия может наблюдаться не только при злокачественных, но и при некоторых доброкачественных опухолях при их определенной локализации: в желудочно-кишечном тракте (вследствие развития непроходимости или резкого нарушения секреторной, моторной и всасывательной функций); в головном мозге, в области трофических центров (вследствие нарушения нервно-гормональной регуляции обмена веществ и энергии). Биологические особенности, характерные для злокачественных опухолей:
1. Инфильтративный (или инвазивный) рост заключается в проникновении клетокопухоли в окружающие нормальные ткани, сочетается с деструкцией этих тканей.Этому способствуют:
приобретение клетками способности к отделению от опухолевого узла и к активному перемещению.
образование опухолевыми клетками белковых веществ - «канцероагрессинов», проникающих в окружающие нормальные ткани и стимулирующих хемотаксис и благодаря этому - инвазию в них опухолевых клеток.
уменьшение сил клеточной адгезии - у опухолевых клеток уменьшается площадь поверхности соприкосновения, уменьшается количество нексусов - контактов, обеспечивающих адгезивность клеточных мембран, меняется состав мембранных гликопро-теидов, что облегчает отделение опухолевых клеток и их последующее движение.
уменьшение контактного торможения.
2. Ангионеогенез - образование новых сосудов в олухоли, имеет исключительное значение, поскольку без него рост опухоли ограничивается 1-2 мм.
Стимулирует процесс новообразования сосудов белок ангиогенин (кроме того, ФНО, ИЛ8 и др.). Сосуды содержат лишь базальную мембрану и эндотелий, мышечной оболочки нет, поэтому сосуды не могут менять просвет. При отставании васкуляризации в центре опухоли развивается некроз.
Тормозят васкуляризацию ангиостатины (а- и Р-интерфероны, гепариназа). Таким образом, опухоль сама регулирует свой ангионеогенез. Иногда хирургическое удаление опухоли провоцирует ангионеогенез.
3. Метастазирование (от греч. metastasis — перемена места, перемещение, перенос) -перемещение опухолевых клеток из первичной опухоли в органы и ткани, расположенные на расстоянии, и образование в них новых, вторичных, опухолевых узлов тойже гистологической структуры (рис. 2.12.1.).
Различают следующие пути метастазирования опухолевых клеток:
лимфогенный - перенос клеток лимфой по лимфатическим сосудам;
гематогенный - транспорт их кровью по кровеносным сосудам;
гематолимфогенный - перенос и лимфогенным и гематогенным путем;
«полостной» - перенос опухолевых клеток жидкостями в полостях тела, например цереброспинальной;
имплантационный - прямой переход опухолевых клеток с поверхности опухоли на поверхность органа или ткани, с которыми она контактирует (например, имплантация опухолевых клеток рака верхней тубы на нижнюю).
105
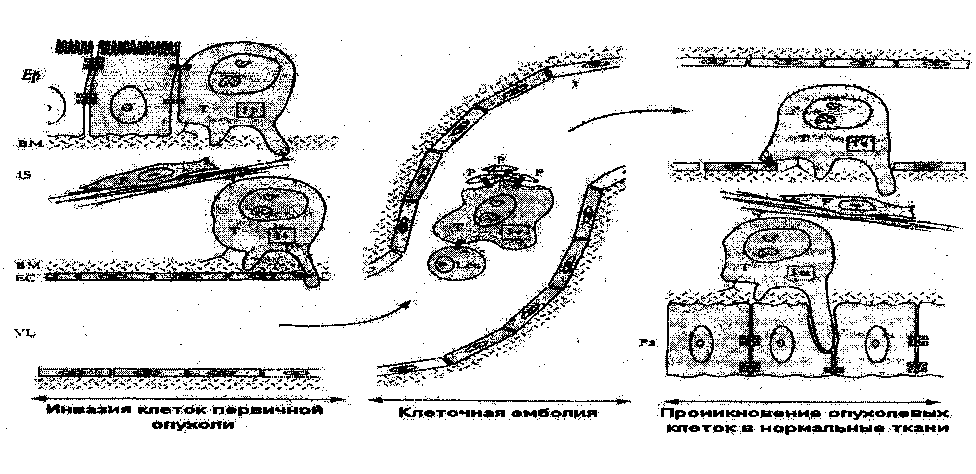
В развитии лимфогенных, гематогенных и гематолимфогенных матастазов различают три стадии:
Стадия инвазии - проникновение опухолевых клеток через стенку сосудов в их просвет.
Стадия клеточной эмболии - перенос током лимфы или крови, проникших в просвет сосудов опухолевых клеток, остановка их в просвете микрососудов с последующим образованием на их поверхности нитей фибрина, что ведет к превращению клеточного эмбола в клеточный тромбоэмбол, прикрепляющийся к эндотелию.
Стадия проникновения опухолевых клеток из клеточного тромбоэмбола через стенку сосудов в окружающие нормальные ткани, размножение их с образованием новых опухолевых узлов.
4. Рецидивирование. Причинами рецидивов являются;
неполное удаление опухолевых клеток, чему способствует инфильтративный рост новообразования;
имплантация опухолевых клеток в окружающую нормальную ткань при травматично выполненной операции с нарушением правил абластики;
проникновение нуклеиновых кислот (ДНК онкогенов) в клетки окружающих нормальных тканей;
иммунодепрессия, возникающая в части случаев после операции
