
- •Содержание
- •Часть 1. Предмет патологии. Учение о болезни (Куликов в.П., Доронина н.Л.)... 8
- •Часть 2. Механизмы развития болезней (Куликов в.П., Доронина н.Л.) 15
- •Часть 3* Патология органов и систем (Куликов в.П., Доронина н.Л.) 157
- •Часть 4. Ситуационные задачи (Куликов в.П., Костюченко л.А., Доронина н.Л,
- •Часть 5. Тестовые задания (Куликов в.П., Костюченко л.А., Воронцов в.В.,
- •Часть 6. Задания для подготовки к занятиям. Вопросы к экзамену (Куликов в.П.,
- •Часть 1. Предмет патологии. Учение о болезни.
- •I. Предмет патологии.
- •IIII Понятие болезни. Патологические реакции, процессы, состояния. Симптом и синдром. Классификация, стадии развития и исходы болезней.
- •IV. Умирание. Терминальные состояния.
- •VI. Патогенез заболеваний. Саногенез.
- •VII. Лечение заболеваний
- •Часть 2. Общая патология. 2.1 .Повреждение клетки.
- •IV. Общий адаптационный синдром. Схема развития симпато-адреналовой и гипоталамо-гипоФизарно-адреналовой реакций при стрессе. Стресс-реализующие и стресс-лимитирующие системы.
- •Стадии стресса или общего адаптационного синдрома:
- •V. Дистресс Болезни адаптации. Ятоогенные осложнения вследствие использования аналогов стресс-реализующих гормонов.
- •IV. Механизм Формирования патологии у плода при алкоголизме беременной женщины.
- •V. Методы изучения наследственных болезней.
- •2.4. Нарушение регионального кровообращения. Тромбозы и эмболии.
- •7. Характер движения крови по сосудам:
- •IV. Виды региональных нарушений кровообращения и их механизмы. Сладж-Феномен.
- •V. Методы оценки сосудистой гемодинамики.
- •2.5. Патология гемостаза.
- •V. Гипокоагуляиии. Связанные с дефицитом плазменных прокоагулянтов
- •2.6. Гипоксия.
- •I. Понятие гипоксии.
- •V. Адаптивные реакции организма: срочные и долговременные (дыхательные, гемодинамические, гемические, тканевые). Срочная адаптация к гипоксии (или 1-ая стадия долговременной адаптации)*
- •2.7. Патофизиология боли.
- •II. По характеру:
- •III. Понятия обморока и коллапса. Отличия от шока.
- •IV. Кома. Этиология и патогенез отдельных видов ком (печеночная, уремическая, диабетическая).
- •2.9. Воспаление.
- •III. Стадии опухолевого роста.
- •IV. Свойства опухолевого роста.
- •V. Опухолевые маркеры. Механизмы изменения иммунного надзора при
- •2.13. Патология углеводного обмена. Сахарные диабеты.
- •IV. Нарушение платочного метаболизма липидов. Жировая инфильтрация органов.
- •V Этиология и патогенез атеросклероза. Стадии развития атеросклероза и осложнения.
- •2.15. Патология белкового обмена.
- •IV. Вторичные нарушения обмена аминокислот. Патология конечных этапов белкового обмена, роль печени и почек е метаболизме аммиака. Нарушение обмена пуриновых и пиримидиноеых оснований.
- •Часть 3. Патология органов и систем. 3.1. Патология красной крови.
- •IV. Этиология и патогенез гемолитических анемий.
- •2. Липидзависимые мембранопатии:
- •3. Ферментопатии:
- •4. Гемоглобинопатии:
- •V. Этиология и патогенез дизэритропоэтических анемий.
- •VI. Компенсаторные реакции организма при анемиях.
- •3.2. Лейкоцитозы и лейкопении. Лейкозы.
- •I. Лейкоцитозы.
- •IV. Лейкемоидные реакции. Виды. Причины возникновения.
- •V. Лейкозы. Общая характеристика,
- •I. По виду клетки-«родоначальницы» лейкоза:
- •VI. Лабораторная характеристика лейкозов. Отличия лейкозов от лейке-моидных реакций.
- •VII. Общие изменения е организме при лейкозах.
- •3.3. Сердечная недостаточность.
- •2. Гипертрофия левого предсердия
- •1. Гипертрофия правого желудочка
- •2. Гипертрофия левого желудочка
- •1, Нервная регуляция.
- •1А} Норма
- •IV, Диагностика аритмий.
- •3.7. Патология артериального давления и сосудистого тонуса.
- •Резервный
- •VI. Компенсаторные процессы при недостаточности внешнего дыхания.
- •IV. Расстройства функции тонкого и толстого кишечника: секреции, переваривания, всасывания и моторики.
- •1. Усиление перистальтики кишечника.
- •2. Ослабление перистальтики кишечника.
- •V. Нарушение барьерной функции кишечника. Дисбактеоиоз.
- •I Повышение проницаемости мембранПовреждение мембран клеток с их частичной или полной деструкцией
- •Часть 4. Ситуационные задачи.
- •Часть 5. Тестовые задания.
- •Часть 6. План практических занятий. Вопросы к экзамену. 6.1. План практических занятий по патофизиологии.
2.9. Воспаление.
I. Виды воспаления в зависимости от причин, реактивности, течения, преобладания стадий. Стадии воспаления. Общие и местные признаки воспаления. Воспаление - типовой патологический процесс, защитно-приспособительная реакция, развивающаяся в ответ на действие флогогенного агента, направленная на устранение, локализацию этого агента и восстановление структуры ткани. Классификация воспаления: По участию микроорганизмов:
Инфекционное (септическое).
Неинфекционное (асептическое). По реактивности:
Гиперэргическое.
Нормэргическое.
Гипоэргическое. По течению:
Острое.
Подострое.
11 Хроническое. По преобладанию стадии:
■ Альтеративное (в последнее время отрицается).
■ Экссудативное (по характеру экссудата дифференцируется на крупозное, серозное, фибринозное, гнойное, гнилостное, геморрагическое, катаральное, смешанное).
■ Пролиферативное (продуктивное).Стадии воспаления:
70
I. Стадия альтерации (повреждение) бывает:
первичная,
вторичная.
П. Стадия экссудации в неё входят:
сосудистые реакции,
собственно экссудация,
маргинация и эмиграция лейкоцитов,
внесосудистые реакции (хемотаксис и фагоцитоз).
III. Стадия пролиферации (восстановление поврежденных тканей):
Аутохтонность - это свойство воспаления раз начавшись, протекать через все стадии до логического завершения (включается каскадный механизм, когда предыдущая стадия порождает последующую).
Местные признаки воспаления:
Покраснение (гиЪог) связано с развитием артериальной гиперемии и "артериализа-цией" венозной крови в очаге воспаления.
Жар (со1ог) обусловлен увеличенным притоком теплой крови, активацией метаболизма, разобщением процессов биологического окисления.
"Опухоль" ("припухлость", Штог) возникает вследствие развития экссудации и отека, набухания тканевых элементов, увеличения суммарного диаметра сосудистого русла,в очаге воспаления.
Боль (йо1ог) развивается в результате раздражения нервных окончаний различными биологически активньми веществами (гистамин, серотонин, брадикинин и др.), сдвига активной реакции среды в кислую сторону, возникновения дисиоиии, повышения осмотического давления и механического растяжения или сдавления тканей.
Нарушение функции воспаленного органа (functio laesa) связано с расстройством его нейроэндокринной регуляции, развитием боли, структурными повреждениями.
Общие признаки воспаления:
Изменение количества лейкоцитов в периферической крови: лейкоцитоз или значительно реже - лейкопения. Лейкоцитоз обусловлен активацией лейкопоэза и перераспределением лейкоцитов в кровеносном русле. К числу основных причин его развития относятся стимуляция симпатической активности, воздействие некоторых бактериальных токсинов, продуктов тканевого распада, а также ряда медиаторов воспаления (ИЛ1 фактор индукции моноцитопоэза и др.).
Лихорадка развивается под влиянием поступающих из очага воспаления пироген-ных факторов, таких как липополисахариды, катионные белки, ИЛ1 и др.
Изменение белкового "профиля"' крови выражается в том, что при остром процессе в крови накапливаются синтезируемые печенью так называемые "белки острой фазы" (БОФ) воспаления - С-реактивный белок, церулоплазмин, гаптоглобин, компоненты комплемента и др. Для хронического течения воспаления характерно увеличение в крови содержания а- и особенно у-глобулинов.
Изменения ферментного состава крови выражаются в увеличении активности трансаминаз (аланинтрансаминаза - при гепатите; аспартаттрансаминаза - при миокардите), гиалуронидазы, тромбокиназы и т.д.
Увеличение скорости оседания эритроцитов (СОЭ) из-за снижения отрицательного заряда эритроцитов, повышения вязкости крови, агломерации эритроцитов, изменения белкового спектра крови, подъема температуры.
Изменения содержания гормонов в крови заключаются, как правило, в увеличении концентрации катехоламинов, кортикостероидов.
Изменения в иммунной системе выражаются в нарастании титра антител, появлении сенсибилизированных лимфоцитов в крови, развитии местных и общих аллергических реакций.
71
//. Механизмы первичной и вторичной альтерации. Медиаторы воспаления, их происхождение и основные эффекты.
Первичная альтерация вызывается непосредственным действием повреждающего агента. Для неё характерны ацидоз повреждения, снижение макроэргов, нарушение работы насосов, накопление недоокисленных продуктов, изменение рН, повышение проницаемости мембранных структур, набухание клетки.
Вторичная альтерация возникает в динамике воспалительного процесса и обусловлена как воздействием флогогенного агента, так и факторов первичной альтерации (в основном нарушениями кровообращения). Для неё характерно непосредственное воздействие лизосомальных ферментов (гидролазы, фосфолипазы, пептидазы, коллагеназы и т.д.), их повреждающее влияние. Опосредованное действие оказывают медиаторы, система комплемента, кининовая система.
Проявления альтерации:
Нарушение биоэнергетических процессов в тканях, ацидоз.
Нарушение транспортных систем в поврежденной ткани (повреждение мембран, недостаток АТФ, необходимой для функционирования энергозависимых мембранных каналов)
Повреждение мембран лизосом и высвобождение ферменов, способных разрушить любые органические субстраты (образование новых биологически активных веществ, потенцирование альтерации до летальных повреждений клеток).
Большую роль в механизме воспаления играют медиаторы. Их делят на: провоспали-тельные и противовоспалительные, локальные (тканевые), циркулирующие и промежуточные.
1. Локальные (тканевые) медиаторы:
а) Гистамин выбрасывается при дегрануляции тучных клеток (расширение сосудовмикроциркуляторного русла, повышение проницаемости микрососудов).
Ь) Серотонин может выделяться из тучных клеток, но главным его источником являются тромбоциты (медиатор боли, сосудистые эффекты меняются в зависимости от количества: в физиологических условиях является вазоконстриктором; в высоких концентрациях, при воспалении, - вазодилататором, повышает проницаемость сосудов).
с) Простагландины - это местные гормоны, модуляторы клеточных процессов, коротко живущий чрезвычайно химически активный класс.
простагландины класса Е (Еь Е2) расширяют сосуды, повышают их проницаемости, являются медиаторами боли;
простагландины класса Р обладают противовоспалительным эффектом;
простациклин (простагландин I2), его источником являются тромбоциты (расширяет сосуды, препятствует тромбообразованию).
тромбоксан (стимулирует тромбообразование, вызывает вазоконстрикцию, способствует агрегации клеток крови).
б) Лейкотриены образуются в нейтрофилах, эозинофилах, Т-лимфоцитах (стимулируют хемотаксис, особенно активен лейкотриен В4).
2. Циркулирующие медиаторы (образуются из неактивных белковых предшественников):
е) Кинины (брадикинин и калидин) образуются из кининогенов под действием ферментов калликреинов. Брадикинин и калидин способствуют расширению микрососудов, повышению проницаемости. Брадикинин является важнейшим медиатором боли.
1) Система комплемента- отдельные элементы этой системы по-разному влияют на развитие воспаления. Хемотаксическим эффектом обладают Сз и С5 компоненты.
72
Кроме того, компоненты комплемента опосредовано влияют на проницаемость сосудистой стенки, и имеется их взаимосвязь с системой кининов. g) Система гемостаза и особенно фактор Хагемана относятся к пусковому механизму свертывания крови. Фактор Хагемана при воспалении активирует коагуляцию, кининогенез и систему комплемента, кроме того, он регулирует активность фибринолитической системы. 3. Промежуточные медиаторы:
Приносятся в очаг воспаления лейкоцитами. В очаг воспаления поступают нейтро-филы (микрофаги), они высвобождают лизосомальные ферменты, простагландины. Медиаторы, которые выделяют моноциты, объединены общим терминов монокины. Они высвобождают также защитные белки: интерфероны, стимуляторы иммунной системы - ин-терлейкины. Лимфоциты высвобождают лимфокины.
Иногда медиаторы называют собирательно (в зависимости от клетки-источника): лейкокины, монокины.
Классификация медиаторов по химической структуре:
I. Биогенные амины - самые ранние медиаторы (гистамин, адреналин, серотонин,полиамины - спермин, путресцин).
Гистамин образуется в тучных клетках из гистидина под влиянием гистидин-декарбоксилазы и находится в гранулах.
Серотонин (5-гидрокситриптамин) образуется при декарбоксилировании триптофана, в основном в клетках энтерохромафинной системы (ЖКТ, мозг), выделяется в основном из тромбоцитов.
Катехоламины играют значительную роль при стрессе.
Полиамины (путресцин, спермин) стимулируют пролиферацию.
II. Пептиды (олигопептиды и белки)
Калликренин-кининовая система.
Лизосомальные ферменты.
Система комплемента - система сывороточных белков, обозначающихся С1-С9, имеющих каскадный принцип активации. При этом наблюдается повреждение мембран, дегрануляция, хемотаксис, маргинация, опсонизация. Альтернативный путь можно увидеть при рассмотрении Сз, С5.
Свертывающая и фибринолитическая системы.
Лейкокинины - пептиды некининового происхождения, образующиеся из фрагментов иммуноглобулинов под влиянием нейтрофильной и макрофагальной лейко-кининогеназы. Тафтсин стимулирует фагоцитоз, пролиферацию Т-лимфоцитов
Лимфо- и монокины. Интерлейкины играют важную роль в пирогении, оказывают стимуляцию пролиферации. Интерфероны имеют противовирусную активность, стимулируют фагоцитоз.
Лизоцим обладает бактерицидным эффектом.
III. Липидные медиаторы.
Простагландины - их делят на констрикторы (действуют через кальцевые каналы) и дилятаторы (действуют через систему аденилатциклазы) сосудов, они по-разному влияют на гемостаз (агрегация тромбоцитов). Тромбоксан (А2), простациклин (I2), простагландин Е.
Лейкотриены - участвуют в хемотаксисе, увеличении проницаемости мембран.
Фактор активации тромбоцитов - способствует маргинации.
IV. Другие группы: гепарин, перекиси, свободные радикалы (оксид азота, супероксидный радикал).
Основные медиаторы альтерации:
Система комплемента.
Свободные радикалы.
Лизосомальные ферменты.
73
///. Механизмы экссудации: Основные медиаторы экссудации:
Гиетамин.
Кийины.
Серотонин.
Простагландины. Сосудистые реакции:
Ишемия - ангиоспаетическая кратковременная (из-за разрушения адреналина и но-
радреналина под влиянием МАО и КОМТ), возможна обтурационная вследствие
тромбоза. Артериальная гиперемия обуславливает развитие одного из классических признаков
воспаления (гаЬог) - красноты. Возможны все механизмы артериальной гипепере-
мии. Смешанная гиперемия. Венозная гиперемия - повышение проницаемости капилляров -> скопление жидкости
в интерстиции -» сдавление венул и лимфатических капилляров. Классический
признак - отек (tumor).Последствия:
Сгущение крови и повышение вязкости.
Активация гемостаза, адгезия и агрегация форменных элементов (монетные столбики, сладж), образование микротромбов, изменение физико-химических свойств крови, появление в крови некоторых белков (глобулины острой фазы), понижение альбумин-глобулинового коэффициента.
Маргинация (краевое стояние) лейкоцитов.
Набухание эндотелиальных клеток.
Стаз способствует гиперкоагуляции и тромбозу; возможны все виды стаза. Собственно экссудация:
Экстравазация жидкости из-за увеличения проницаемости сосудистой стенки. Другими словами происходит: разрушение стенки сосудов при альтерации; округление эндотелиальных клеток и появление межклеточных щелей (гистамин, брадикинин); мик-ровизикуляция эндотелия - эндоцитоз и трансцитоз компонентов плазмы; раздвигание эндотедиальных клеток лейкоцитами по типу "расстёгивание молнии"; увеличение фильтрационного давления и площади фильтрации.
Различают раннюю экссудацию, 5-30 мин. (действие биогенных аминов и ацетил-холина на посткапиллярные венулы) и позднюю экссудацию, от 1 часа до 7 суток (действие полипептидных и липидных медиаторов на венулы и капилляры). Также происходит выход форменных элементов. Отличием экссудата от транссудата является наличие более 2-3% белка.
Эмиграция:
Экстравазация форменных элементов - маргинация лейкоцитов, которая объясняется изменением заряда поврежденных клеток, фиксацией в межэндотелиальных щелях - "ловушках", движением с током жидкости, образованием мостиков, влиянием медиаторов (фибронектин, компоненты системы комплемента, XII фактор, каллекреин, брадикинин).
Движение лейкоцитов через сосудистую стенку. Лимфоциты и моноциты проникают через эндотелиальные клетки, не повреждая их. Полиморфноядерные лейкоциты - через эндотелиальные щели.
Движение клеток из сосуда в очаг воспаления по градиенту хемотаксинов называется хемотаксисом, в случае если это движение без градиента и беспорядочно -хемокинезоы.
Способность привлекать в очаг воспаления лейкоциты называется хемоамтракци-ещ ею обладают хемоаттрактанты (различные цитокины, микроорганизмы и продукты
74
их жизнидеятельности, система комплемента, некротаксины - деграданты коллагена, фиб-ронектин (гной лейкоцитов), иммунные комплексы).
Хемоаттрактанты воспринимаются рецепторами лейкоцитов. Движение лейкоцитов обеспечивается структурами цитоскелета: микрофиламетами и микротрубочками. При участии Са++ и Са-связывающего белка гельзолина, актина цитоскелета. Желатини-зация актина сопряжена с сокращением элементов цитоскелета.
//У, Стадии и механизмы Фагоцитоза.. "' Стадии фагоцитоза (рис 2.9.1):
Приближение (случайное и хемотаксис).
Контакт, распознавание и прилипание.
В процессе распознавания большую роль играет опсонизация - покрытие объекта фагоцитоза сыворочными факторами - опсонинами (антителами 1дО, М и Е «метят» объекты, подлежащие элиминации).
Прилипание осуществляется посредством связи опсонинов с рецепторами фагоцитов. Завершенный фагоцитоз идет только с участием опсонинов.
3. Поглощение (механизм: псевдоподии -» фагосомы -» фаголизосомы).
При поглощении живые микроорганизмы сначала должны быть убиты. В лейкоцитах существует 2 бактерицидных механизма:
зависящий от кислорода (связан с образованием активных метаболитов кислорода, продукция которых начинается после контакта фагоцитов с опсонизиро-ванными бактериями);
независящий от кислорода (связан с дегрануляцией и поступлением внутрь фагосомы бактерицидных веществ, которые содержатся во внутриклеточных гранулах фагоцитов - лизоцим, лактоферрин и др.).
4. Переваривание за счёт сильных эндогенных окислителей и ферментов, таких как
гидролазы, комплемент, лизоцим, аргиназа.
Растворённый
в
жидкости
материал
Опсонизация
Антитело
Хемотаксис
Присоединение
Нейтрофил
я
-4
Моноцит
— Макрофаг—Г
Разрушение
Кислород
Переваривание
ГКГС
II
Протеолитические-
ферменты
Рис. 2.9.1. Схема фагоцитоза.
75
Некоторые микроорганизмы (микобактерии, трипаносомы, лиетерии, сальмонеллы) ингибируют образование фаголизосом и возбудители персистируют в фагоците. Они сохраняются, оказываясь при этом «отгороженными» мембраной и цитоплазмой фагоцитов от противомикробных лекарств. Последняя (4-я) стадия фагоцитоза не развивается, формируется незавершенный фагоцитоз.
Причины незавершенного фагоцитоза: дефицит белка; дефицит витаминов; наследственные ферментопатии; иммунодефициты; особенности возбудителя (его размеры значительно превышают размеры самого фагоцита); объектом фагоцитоза являются комплексы антиген-антитело, находящиеся на плоской поверхности сосудистого эндотелия.
V. Механизмы пролиферации.
Пролиферация - репаративная стадия воспаления (размножение клеток, восстановление структуры межклеточного пространства).
Фибробласты - главные эффекторы репарации. Механизм - стимуляция пролиферации через синтез ДНК и митотическую активность.
Репарация начинается с 1 стадии воспаления и достигает пика в 3 стадию. Медиаторы, стимулирующие пролиферацию (трефоны): Ь Полиамины - путресцин, спермидин (продукты орнитиндекарбоксилазы). \.
Факторы роста фибробластов - тромбоцитарный и гапофизарный.
Эндотелиальный хемотаксический фактор (из макрофагов) - для врастания сосудов в грануляционную ткань.
Тканеспецифические стимуляторы - иммуноглобулины О и М.
Лимфокины (из Т-лимфоцитов) участвуют в пролиферации лимфоцитов и макрофагов.
Монокины (из макрофагов).
Эндотелиальный фактор роста.
Кейлоны - медиаторы, ингибирующие пролиферацию.
Эффекты кейлонов потенцируют адреналин, глюкокортикоиды, цАМФ; трефонов -
альдостерон, цГМФ.
VI Хроническое воспаление. Гранулема.
Хроническое воспаление развивается, когда повреждающий агент действует длительное время, или первично (при аллергических и аутоиммунных болезнях), и характеризуется преобладанием процессов пролиферации. Причины хронизации воспаления;
Слабая реактивность, чаще у детей и стариков.
Слабые сосудистые реакции.
Незавершённый фагоцитоз.
Устойчивые микроорганизмы (при туберкулёзе, проказе, листериозе, токсикоплаз-мозе).
5. Неперевариваемые объекты - инородные тела (металл, древесина).Гранулематозное воспаление - хроническое воспаление, вызванное нерастворимыми или медленно разрушающимися (персистирующими) раздражителями и сопровождающееся образованием гранулем, возникающих в результате пролиферации и трансформации способных к фагоцитозу клеток.
Этиологические факторы гранулематозного воспаления:
1. Эндогенные:
труднорастворимые продукты повреждения тканей, в первую очередь жировой ткани (мыла);
продукты нарушенного обмена (ураты);
2. Экзогенные:
■ биологические факторы (бактерии, грибы, простейшие, гельминты и т. д.);
76
■ органические и неорганические вещества (при пылевых болезнях - силикоз, талькоз, асбестоз, биссиноз и др.), в том числе лекарственные средства (гра-нулематозный гепатит, олеогранулематозная болезнь). Длительно раздражённые макрофаги выделяют монокины, которые и формируют гранулёму.
Гранулемы представляют собой компактное скопление макрофагов, эпителиоид-ных клеток, могут присутствовать лимфоциты, плазматические клетки, нейтрофильные и/или эозинофильные гранулоциты, фибробласты (склероз). Морфогенез гранулемы складывается из 4 стадий:
Накопление в очаге повреждения ткани юных моноцитарных фагоцитов;
Созревание этих клеток в макрофаги и образование макрофагальной гранулемы;
Созревание и трансформация моноцитарных фагоцитов и макрофагов в эпителио-идные клетки и образование эпителиоидной клеточной гранулемы;
Слияние эпителиоидных клеток (или макрофагов) и образование гигантских клеток (клеток инородных тел или клеток Пирогова-Лангханса) и эпителиоидно-клеточной или гигантоклеточной гранулемы. Гигантские клетки характеризуются значительным полиморфизмом: от 2-3-ядерных до гигантских симпластов, содержащих 100 ядер и более. В гигантских клетках инородных тел ядра располагаются в цитоплазме равномерно, в клетках Пирогова-Лангханса - преимущественно по периферии. Диаметр гранулем, как правило, не превышает 1-2 мм; чаще они обнаруживаются лишь под микроскопом. Исходом гранулемы является склероз.
VII. Методы диагностики воспалительных процессов.
Диагностика воспаления основывается на комплексе клинических, инструментальных и лабораторных методов исследования. Установление наличия воспаления в организме начинается, как правило, с его классических признаков (tumor, rubor, са1ог, dо1оr, functio lease). Однако, в случае патологии внутренних органов, далеко не все эти симптомы доступны для исследования.
Увеличение размера воспаленного органа (tumor) или наличие экссудата помогает установить рентгенологическое или ультразвуковое исследование. Кроме того, при ультразвуковом исследовании могут быть выявлены и другие признаки воспаления: утолщение стенок полого органа, изменение эхогенности (способности к отражению ультразвука).
Допплеровские ультразвуковые методы исследования (ультразвуковая допплеро-графия, цветное дуплексное сканирование) могут выявить характерные для воспаления нарушения регионального кровообращения (артериальная и венозная гиперемия, стаз).
Тепловидение в инфракрасном диапазоне помогает установить локализацию воспаления по местному увеличению поверхностной температуры в проекции пораженного органа, а в радиочастотном диапазоне и непосредственно в органе.
Важным для диагностики выраженности воспалительной реакции является установление нарушения функции поврежденного органа методами функциональной диагностики. Например, нарушение функции внешнего дыхания при пневмонии с помощью спи-роанализа, нарушение сократительной функции сердца при миокардите с помощью эхо-допплеркардиографии.
Поскольку в основе воспаления лежит повреждение клеток, для диагностики и установления локализации процесса используется исследование ферментов - маркеров повреждения, например, аспартатаминотрасфераз и аланинаминотрансфераз.
Большое значение для диагностики воспаления имеет исследование белой крови. Деструкция ткани при остром и особенно при инфекционном воспалении, сопровождается появлением в крови большого количества лейкопоэтинов, которые способствуют активации лейкопоэза, в результате в периферической крови выявляется лейкоцитоз и сдвиг лейкоцитарной формулы влево. Хронизация процесса в большей степени стимулирует рост
77
числа мононуклеарных лейкоцитов. Имеющаяся при этом интоксикация может проявиться в виде дегенеративных изменений гранулоцитов (токсическая зернистость, гиперсегментация, кариопикноз и т. д.). Однако, концентрация лейкоцитов в периферической крови при воспалении повышается далеко не всегда. Во-первых, хроническое или даже острое воспаление может сопровождаться токсическим действием на красный костный мозг продуктов воспаления. Во-вторых, усиленный лейкопоэз может маскироваться повышением адгезивных свойств лейкоцитов и эндотелия сосудов, что приводит в возрастанию процента маргинальных лейкоцитов. В третьих, возможно повышенное выделение лейкоцитов из организма, например, через свищевые ходы абсцесса.
Прогноз воспаления можно предположить но показателям функции лейкоцитов в тестах исследования активности их миграции в зону повреждения, спонтанной и стимулированной фагоцитарной активности, уровню секреции в кровь цитокинов.
Важным диагностическим признаком воспаления является диспротеинемия. При остром воспалении она возникает вследствие увеличения в крови концентрации белков острой фазы (альфа-1 и альфа-2 глобулиновая фракция). При хроническом воспалении -за счет увеличения синтеза белков гамма-глобулиновой фракции. В таблице 2.9.1 представлены примеры изменений соотношения белковых фракций сыворотки крови при воспалении.
|
Таблица 2.9.1. Белковые фракции сыворотки крови (в( |
Уо) |
| |
|
|
Норма |
Острое воспаление |
Хроническое воспаление |
|
Альбумины |
46,9-61,4 |
40 |
37 |
|
\ а-1-глобулины |
2,2 - 4,4 |
7 |
4 |
|
а-2-глобулины |
7,9-10,9 |
15 |
9 |
|
р-глобулины^ |
10,2-18,3 |
13 |
18 |
|
у-глобулины |
17,6-25,4 |
25 |
32 |
Диспротеинемия дает еще один важный признак воспаления - повышение СОЭ за счет нейтрализации мембранного заряда эритроцитов белками воспаления и снижения вследствие этого взаимоотталкивания клеток при оседании. Однако при этом необходимо учитывать другие возможные причины ускорения СОЭ, например, наличие эритропении или опухолевого процесса.
Особое значение в диагностике воспаления придается исследованию концентрации в крови белков острой фазы, которые усиленно синтезируются в ответ на повреждение или стресс, возникающий при воспалении. К белкам острой фазы относятся белки, участвующие в гемостазе (фибриноген, плазминоген), транспортные белки (церуллоплазмин, гаптоглобин, орозомукоид), опсонины (С-реактивный белок), антиферменты (альфа-1-антитрипсин, альфа-1-антихимотрипсин, альфа-2 макроглобулин), белки системы комплемента, сывороточный амилоидный протеин и другие (табл. 2.9.2). Непосредственными стимуляторами их синтеза являются цитокины фагоцитов, прежде всего ИЛ-1 и 6, а также фактор некроза опухолей (ФНО). Диагностическая ценность определения различных белков острой фазы неодинакова.
Наиболее чувствительным маркером воспаления является сывороточный амилоидный протеин. Правда, и здесь возможен ложноположительный результат, так как он входит в состав липопротеинов высокой плотности и его титр повышается при некоторых дислипопротеинемиях. Вторым по чувствительности, но первым по популярности является С-реактивный белок. К сожалению, титры его весьма вариабельны, поэтому диагностическая ценность этого показателя особенно велика не при однократном, а при динамичном исследовании. Далее по значимости можно поставить антихимотрипсин, церулоплаз-мин и орозомукоид. Другие острофазные белки надо оценивать с большой осторожностью из-за возможности артефакта. Так, достаточно часто встречается врожденная недостаточность антитрипсина, что, кстати, предрасполагает к хроническим воспалениям, Гап-
78
тоглобин и фибриноген значительно потребляются в процессе воспаления и покидают кровяное русло.
|
Сывороточный амилоидный протеин |
. 1,0-3.0 г/д |
|
С - реактивный белок |
0,1-8,0 мг/л |
|
Антихимотрипсин |
0,2-0,5 г/л | |
|
Антитрипсин |
2,0-4,0 г/л |
|
Церулоплазмин |
0,2-0,5 г/л |
|
Трансферрин |
1,7-4,0 г/л |
|
Фибриноген |
2-4,5 г/л |
Ценным для диагностики воспаления является исследование экссудата. Поскольку многие отеки и водянки могут быть невоспалительного происхождения, такой признак воспаления как припухлость, требует дифференциальной диагностики экссудата и транссудата по классическим отличительным признакам (рН, концентрации белка и клеточному составу). Нормальная величина рН в межклеточной жидкости равна 7,34. В очаге воспаления, вследствие гипоксии, повреждения митохондрий, накопления лейкоцитов, нарастает ацидоз. Величина рН экссудата при этом снижается при хроническом воспалении до рН 7,1 - 6,6, а при остром, особенно гнойном воспалении до рН 6,5 - 5,4. Концентрация белка в транссудате обычно невелика (не превышает 2 - 3%), он достаточно прозрачен, присутствуют единичные полиморфноядерные лейкоциты. В экссудате по мере повышения капиллярной проницаемости и разрушения клеток возрастает концентрация белка, появляется даже крупномолекулярный белок - фибриноген, привлекается все больше лейкоцитов, иногда появляются эритроциты, исчезает прозрачность.
79
2,10. Ответ острой фазы. Лихорадка.
I Ответ острой Фазы, его проявления:
Ответ острой фазы - общая реакция организма на воспаление, сопровождающаяся увеличением его резистентности к инфекциям. Проявления острой фазы:
Лихорадка (антибактериальный эффект);
Активация фагоцитоза и иммунитета (выработка цитокинов, нейтрофильный лейкоцитоз со сдвигом влево);
Диспротеинемия: увеличение концентрации a1- и а2~глобулинов (преимущественно при остром воспалении), у-глобулинов (преимущественно при хроническом воспалении), фибриногена, прокоагулянтов и плазминогена, гипоальбуминемия, отрицательный азотистый баланс;
Увеличение синтеза АКТГ и кортизола (неспецифическая резистентность);
Гиперлипидемия (за счет выброса адреналина и его действия на (b-адренорецепторы жировой ткани с последующим липолизом);
Увеличение концентрации К+ (повреждение клеток). Белки острой фазы:
С-реактивный белок (является опсонином);
Сывороточный амилоид;
Транспортные белки (церуллоплазмин, гаптоглобин, орозомукоид);
Антиферменты (он-антитрипсин и агантихимотрипсин, а2-макроглобулин);
Фибриноген и плазминоген;
Компоненты системы комплемента.
Противовоспалительный эффект оказывают: агаититрипсин, агантихимотрипсин, церулоплазмин, кортизол.
Основные медиаторы: ИЛ1 ИЛб, ФНО - эндогенные пирогены, стимулирующие синтез белков острой фазы.
//. Значение температурного гомеостаза для организма. Основы физиологии терморегуляции,
Температура тела является побочным продуктом всех биохимических процессов метаболизма первичных субстратов и макроэргических соединений (АТФ). Все процессы распада биологических субстратов приводят к выделению тепла. От температуры зависит изменение проницаемости клеточных мембран, возбудимости нервных и мышечных тканей.
Постоянная температура тела может быть тогда, когда существует равенство между процессами теплопродукции и теплоотдачи.
Образование тепла (теплопродукция) при химических процессах называется химической терморегуляцией.
Химическая теплопродукция реализуется за счет:
Несократителъного термогенеза (энергетический обмен в тканях). Большое количество тепла, в частности, выделяется в процессе липолиза. Скорость окисления жирных кислот в бурой жировой ткани в 20 раз выше, по сравнению с белой жировой тканью. Ли-полиз стимулируется при активации р-адренорецепторов жировой ткани. Кроме того, повышению температуры тела сособстует разобщение процессов окислительного фосфори-лирования (мощный разобщитель - тироксин).
Сократительного термогенеза (термозависимое изменение тонуса, позы, мышечная дрожь).
Регуляция теплоотдачи - физическая терморегуляция. Теплоотдача происходит главным образов за счет радиации (45-55% тепла при температуре комфорта), 15-30% теп-
80
ла выводится конвекцией (нагреванием окружающего тело воздуха), испарение (пот с поверхности тела) и до 5% составляет кондукция или теплопроводность.
Процессы теплоотдачи во многом определяются функционированием сердечнососудистой системы, потому что она способна к перемещению потоков крови от глубоких тканей к поверхностным.
Температура тела в разных его участках разная. Система терморегуляции должная поддерживать постоянной температуру ядра тела (то есть всех тканей глубже 2 см от кожи), которая приблизительно равняется 37°С. Температура «оболочки» при этом 24,4-36,7°С.
Рецепторы терморегуляции расположены в организме фактически везде, но они могут иметь перепад температуры до 30 градусов. Периферические рецепторы оценивают разнообразную информацию о температуре, причем Холодовых, то есть активирующихся при понижении температуры рецепторов больше. Интерорецепторы также оценивают неодинаковые параметры в зависимости от функциональной активности органов. Центральные терморецепторы оценивают неодинаковую температуру, которая может еняться в пределах 1-2 градуса.
Информация о состоянии терморегуляции анализируется в гипоталамусе, где суммируются все термические сигналы. Передняя часть центра терморегуляции отвечает за теплоотдачу, задняя - за теплопродукцию, т.е. химическую терморегуляцию.
III. Этиология и патогенез лихорадки. Виды пиоогвнов, их химическое
строение, свойства и происхождение. Лихорадка - типовой патологический процесс, характеризующийся изменением терморегуляции и повышением температуры тела в ответ на действие пирогенных веществ.
Лихорадка относится к гипертермиям и имеет особое значение в патологии, поскольку сопровождает и участвует в сано- и патогенезе многих патологических процессов. Возникновение всех остальных гипертермии, помимо лихорадки, не связано с действием пирогенов.
Классификация гипертермии.
Пирогенно обусловленная (лихорадка).
Непирогенно обусловленные:
эндогенные гипертермии (психогенные, центрогенные, рефлексогенные, эндокринные, «злокачественная гипертермия»);
экзогенные гипертермии (перегревание, лекарственная);
■ поведенческая (при интенсивной физической нагрузке).Этиология лихорадки:
Экзогенные (инфекционные и неинфекционные) агенты.
Эндогенные (обломки клеток организма при травме, повреждении). Первичные пирогены чаще всего представлены липополисахаридами и липоидом
А клеточных мембран грамм-отрицательных микроорганизмов, белками и нуклеиновыми кислотами.
Учитывая положительное значение повышенной температуры для организма, существуют лекарственные препараты не для снижения, а для повышения температуры организма (пирогенал). Пиротерапия применяется для ускорения скорости всех химических реакций, в частности, иммуннных (синтез интерферона, лизоцима, интерлейкинов, ФНО, антител, усиление фагоцитоза) при хронических инфекционных и опухолевых заболеваниях, повышения детоксикационных функций организма.
Вторичные пирогены образуются в фагоцитах (нейтрофилах, моноцитах, тканевых макрофагах) при фагоцитозе токсинов и имеют пептидную природу. К ним относятся ИЛ1 и ИЛ6, ФНО, интерферон.
Патогенез лихорадки.
81
Вторичные пирогены пересекают гематоэнцефалический барьер и достигают термочувствительных нейронов переднего отдела гипоталамуса, там они меняют функцию в первую очередь холодочувствительных нейронов.
Начинается процесс образования простагландинов группы Е из арахидоновой кислоты. Простагландины этой группы ингибируют фосфодиэстеразу и тем самым увеличивают внутриклеточную концентрацию цАМФ, наблюдается снижение проницаемости клеточной мембранытдля кальция, в результате возбудимость клеток термостата снижается (смещение термоуетановочной точки гипоталамуса на более высокий уровень), что влечет за собой увеличение теплопродукции и снижение телоотдачи.
IV. Стадии лихорадки. Соотношение теплопродукции и теплоотдачи в разные стадии. Механизмы действия жаропонижающих препаратов. Стадии лихорадочного процесса (рис. 2.10.1.):
I. Подъем температуры:
В первую очередь резко уменьшается теплоотдача. Активация симпатоадреналовой системы приводит к снижению кровообращения периферических отделов организма -кожные покровы бледные (возбуждение а-адренорецепторов). Возбуждение р-адренорецепторов сопровождается учащением дыхания и сердцебиений, увеличением скорости кровотока. Увеличение частоты сердечных сокращений обусловлено также повышением возбудимости синусового узла при повышении температуры «ядра».
Симпатоадреналовая реакция сопровождается увеличением артериального давления (АД), а в следствие этого растет фильтрационное давление в почках и увеличивается диурез.
Возбуждение р-адренорецепторов бурой жировой ткани также сопровождается увеличением теплопродукции.
Активация Холодовых рецепторов вызывает возбуждение центра теплопродукции -» начинается процесс мышечного сокращения ~ озноб, мышечная дрожь.
Выработка тиролиберина в гипоталамусе сопровождается увеличением продукции ТТГ в щитовидной железе (разобщение окисления и фосфорилирования).
Теплопродукция превышает теплоотдачу. Температура тела начинает увеличиваться. II. Стояние температуры.
Температура стабилизируется на постоянном высоком уровне. Происходит увеличение теплоотдачи ровно на столько, чтобы уравновесить теплопродукцию при повышенной температуре. На этой стадии наблюдаются сосудистые реакции: расширение периферических сосудов, в результате чего бледность сменяется гиперемией. Больные реагируют в этой стадии на тепло и холод соответствующими реакциями, как и здоровые.
АД постоянное, а усиление секреции альдостерона вызывает снижение диуреза, III. Снижение температуры (разрешение).
Центр терморегуляции возвращается к своему прежнему уровню активности. Нормализуется функция симпатического отдела вегетативной нервной системы. Теплоотдача преобладает над теплопродукцией за счет потоотделения (активация парасимпатического отдела вегетативной нервной системы). Наблюдается снижение температуры, АД, диурез возрастает.
Если температура падает слишком быстро (критически), развивается сосудистая недостаточность - коллапс. Наблюдается дефицит объема циркулирующей крови по отношению к объему резко расширенного сосудистого русла. Поэтому легче переносится больным постепенное снижение температуры (литическое).
82

Рис. 2.10.1. Варианты соотношений теплопродукции и теплоотдачи в разные стадии лихорадки. Примечание: 1 - температура тела, 2 - теплопродукция, 3 - теплоотдача.
Типы лихорадок:
Субфебрильная - повышение температуры 37-38°С
Умеренная (фебрилъная) - до 38-39°С
Высокая (пиретическая) - до 39-41°С
Чрезмерная (гиперпиретическая) - свыше 41 °С
Типы температурных кривых по величине суточных колебаний температуры представлены на рисунке 2.10.2.
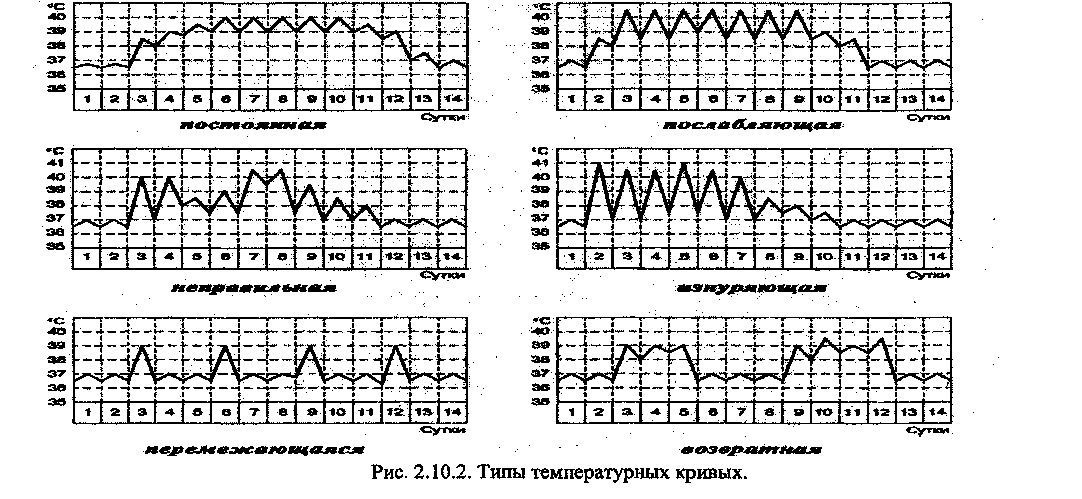
83
Febris continua(постоянная) - колебания температуры не превышают 1°С.
Febris remittens (послабляющая, ремиттирующая) - не превышает 2°С.
Febris intermittens (перемежающая, интермиттирующая) - кратковременные периоды высокой температуры сочетаются с периодами нормальной температуры тела.
Febris hectica (изнуряющая, пектическая) - колебания температуры составляют 3-5°С.
Febris athypica (атипичная) - незакономерные чередования температуры.
Febris reccurrens (возвратная) - чередование лихорадочных приступов (2-7 дней) с периодами нормальной температуры тела.
Механизмы действия жаропонижающих препаратов
Чрезмерная лихорадка, а в случае длительного периода и высокая и даже умеренная опасны для организма из-за возможных нежелательных последствий - конформационных изменений белковых молекул (особенно ферментов) или из-за истощения энергетических запасов организма (гликоген и жиры), а также вследствие нарушения работы ряда систем организма (особенно сердечно-сосудистой и пищеварительной). Поэтому, лихорадка нередко требует патогенетической коррекции жаропонижающими средствами.
Практически существует два фармакологических подхода к снижению температуры
снижение активности терморегулирующего центра (термостата),
снижение уровня термогенеза путем уменьшения интенсивности обменных процессов в клетках; можно снизить даже нормальный уровень температуры организма, применяется для искусственного охлаждения организма (гибернации) при некоторых операциях с целью замедления процессов гибели и саморазрушения клеток (фенотиазиновые нейролептики).
Наиболее распространен первый путь. Он достигается блокадой синтеза фосфоли-пазы А для предотвращения образования арахидоната, необходимого, в свою очередь, для синтеза простагландинов (глюкокортикоидные препараты), а также циклооксигеназы для предотвращения синтеза главного медиатора лихорадки - простагландина Е в термо-регулирующем центре на втором этапе синтеза (ацетилсалициловая кислота, бутадион и
ДРО-
Выраженность лихорадки могут ослабить средства, снижающие уровень секреции щитовидной железой тироксина (антитиреоидные препараты), надпочечниками адреналина (ганглиоблокаторы) или блокирующие адренорецепторы.
V. Обмен веществ при лихорадке. Изменение функции органов при лихорадке. Положительное и отрицательное значение лихорадки. Обмен веществ при лихорадке.
I. Белковый обмен
Введение пирогенных веществ не вызывает нарушений белкового обмена. В то же время при заболеваниях, сопровождающихся лихорадкой, часто обнаруживается отрицательный азотистый баллоне - увеличивается выделение с мочой азотистых продуктов обмена, в частности мочевины ц мочевой кислоты. Однако параллелизма между усилением распада белка и высотой температуры часто не наблюдается, и значительное усиление катаболизма обычно связано с инфекционной интоксикацией, в том числе с ее отрицательным влиянием на пищеварительную систему.
Причиной распада белка при ряде инфекционных заболеваний является интоксикация и дегенеративные изменения в тканях, а таксисе сопутствующее голодание из-за пониженного аппетита и ухудшения усвоения пищи. И. Углеводный обмен
Изменения в углеводном обмене происходят за счет активации гипоталамо-гипофизарно-надпочечниковой системы. В печени активируется гликогенолиз, снижаются запасы гликогена, в крови отмечается гипергликемия. Содержание гликогена в сердце не изменяется.
III. Жировой обмен
Изменения в жировом обмене происходят за счет активации гипоталамо-гипофизарно-надпочечниковой системы. При уменьшении углеводных резервов отмечается усиленное использование жиров для теплопродукции. При истощении в печени запасов гликогена окисление жира идет не до конечных продуктов, накапливаются кетоновые тела, с мочой выделяется ацетон.
IV. ВОДНО-ЭЛЕКТРOЛИТНЫЙ ОБМЕН
84
В первой стадии усиление почечного кровотока сопровождается повышением диуреза. Во второй стадии диурез снижается, происходит задержка воды в ряде органов, мышцах и воспалительных очагах (в виде экссудата). В связи с повышенной секрецией альдостерона ограничивается выведение из организма ионов натрия. Вместе с натрием задерживаются ионы хлора. В третьей стадии лихорадки диурез повышается, увеличивается секреция воды потовыми железами, с мочой и потом выделяется значительное количество хлорида натрия.
Изменение функции органов при лихорадке. I. Центральная нервная система
Наиболее частыми жалобами у лихорадящих больных являются головная боль, сонливость, разбитость, апатия, гиперестезия. Механизм этих проявлений связывают с эффектами ИЛ1 Могут быть бред, галлюцинации. Заболевания, сопровождающиеся лихорадкой, могут протекать как с явлениями угнетения высшей нервной деятельности, так и ее активации. II. Сердечно-сосудистая система
При лихорадке, как правило, увеличиваются частота и сила сердечных сокращений, что приводит к увеличению ударного и минутного объема. Повышение температуры на 1°С сопровождается обычно учащением сердцебиения на 8-10 ударов в 1 мин., которое обусловлено повышением тонуса симпатического отдела вегетативной нервной системы и прямым действием нагретой крови на синусовый узел сердца.
Длительная непрерывная гипердинамия сердца, особенно при высокой лихорадке и ранее пораженном каким-либо патологическим процессом сердце, может привести к перегрузочной форме его недостаточности.
Артериальное давление в начале лихорадки несколько повышено за счет спазма периферических сосудов. Приток крови к внутренним органам увеличивается за счет ограничения периферического кровообращения. На этом, в частности, основана пиротера-пия почечной гипертонии. В период критического падения температуры давление может резко снизиться из-за ослабления тонуса сосудов.
III. Система дыхания
В первой стадии лихорадки частота дыхания несколько снижается. Во второй стадии частота дыхательных движений увеличивается, но легочная вентиляция при этомпрактически не изменяется, так как глубина дыхания уменьшается. Отмечено, что повышение температуры головного мозга вызывает учащенное дыхание. Вместе с тем, потребление кислорода тканями мозга в диапазоне изменений температуры 38-42°С практически не изменяется.
IV. Система пищеварения
Одной из постоянных жалоб больных с лихорадочными заболеваниями является потеря аппетита. У них происходит снижение секреции слюны, язык становится сухим, обложенным. Снижается секреторная деятельность всех пищеварительных желез. Отмечаются также двигательные расстройства желудка и кишечника. Преобладание возбуждения симпатического или парасимпатического отдела нервной системы в разные стадии лихорадки приводит к изменению тонуса кишечника, возникают спастические или атонические запоры.
Защитные реакции при лихорадке.
При лихорадке активно увеличиваются процессы антителообразования. Стимулируется иммунитет, активируется фагоцитоз.
Увеличивается ферментативная активность, что обеспечивает энергетическую эффективность различных процессов при минимальных расходах энергии.
Повышается дезинтоксикационная функция органов (в том числе печени).
Подавляется активность возбудителей инфекции.
Активируется стрессовая реакция - развивается общий адаптационный синдром.
85
Отрицательное значение лихорадки.
Истощение энергетических ресурсов.
Гипоксия и ацидоз.
Дисфункция сердечно-сосудистой системы.
Угнетение центральной нервной системы.
VI. Лихорадка и перегревание: сходства и различия.
Пирогенно необусловные гипертермии принято называть лихорадоподобными состояниями (ЛПС, перегревание).
При перегревании реакция аппарата терморегуляции не имеет системного характера, повьппение температуры тела обычно связано с влиянием на отдельные звенья терморегуляции или непосредственно на обмен веществ в тканях.
Неврогенные ЛПС подразделяют на центрогенные, психогенные и рефлексогенные.
Центрогенные ЛПС могут возникать при повреждении различных отделов головного мозга (кровоизлияниях, опухолях, травме, отеке мозга и т.п.). Причиной развития психогенных ЛПС могут быть,функциональные нарушения высшей нервной деятельности (невроз, психические расстройства), значительное эмоционально-умственное напряжение; описаны случаи возникновения гипертермии под влиянием гипнотического внушения.
Рефлексогенные ЛПС могут наблюдаться при почечнокаменной болезни, желчнокаменной болезни, раздражении брюшины, катетеризации уретры и т.д. При этом, как правило, возникает болевой синдром; нельзя исключить в некоторых случаях и микроповреждения тканей, приводящего к образованию первичных неинфекционных пирогенов. В таких случаях, очевидно, наряду с рефлекторным механизмом будет участвовать и обычный механизм действия пирогенных веществ.
Эндокринные ЛПС наблюдаются при некоторых эндокринопатиях, в частности, при гипертиреозах.
Лекарственные ЛПС возникают при энтеральном или парентеральном введении некоторых фармакологических препаратов (кофеина, эфедрина, метиленовой сини, гипе-росмолярных растворов и др.
Дифферениальные признаки лихорадки и перегревания представлены в таблице 2.10.1.
|
Таблица 2.10.1. Отличительные признаки перегревания организма и лихорадки | ||
|
Признак |
Перегревание организма |
Лихорадка |
|
Этиология |
Уменьшение теплоотдачи. Травмы, кровоизлияния, опухоли, инфекции головного мозга. Химические соединения, нарушающие сопряженность между свободным дыханием и фосфорилированием. |
Воздействие пирогенных веществ на центр терморегуляции. |
|
Патогенез |
Формирование функциональной системы, поддерживающей гипертермию при действии высокой температуры окружающей среды или факторов, затрудняющих термолиз. |
Функциональная перестройка ценра терморегуляции, наблюдающаяся в результате действия пирогенных веществ. |
|
Состояние терморегуляции |
Температура тела начинает повышаться после того, как теплоотдача оказывается меньше теплопродукции. |
Температура тела активно регулируется на новом уровне. |
|
Направленность изменений терморегуляции |
На термолиз. |
На термогенез. |
|
Чем определяется степень повышения температуры |
Физическими условиями теплообмена организма с окружающей средой. |
Уровнем смещения «установочной точки» в центре терморегуляции, 1 |
86
|
Признак |
Перегревание организма |
Лихорадка |
|
Озноб |
Отсутствует. |
Отмечается в I стадии. |
|
Усиленное потоотделение |
Как правило, есть. |
Отмечается в III стадии. |
|
Эффективность жаропонижающей терапии |
Не эффективна. |
Эффективна. |
2.11. Иммунопатология.
Иммунитет - это система защиты организма от всего генетически чужеродного, прежде всего многочисленных микроорганизмов и генетически измененных собственных клеток, включая раковые или отжившие свой срок.
Антигены (Аg) - чужеродные вещества.
Иммунный ответ осуществляется иммунокомпетентными клетками, продуктами их жизнедеятельности - цитокинами и направлен на элиминацию Аg (рис 2.11 Л),
Если в элиминации Аg ведущую роль играют секреторные продукты В-клеток -антитела, то говорят о гуморальной форме иммунного ответа. Если же элиминация А§ осуществляется с непосредственным участием Т-лимфоцитов - о клеточном иммуном ответе.
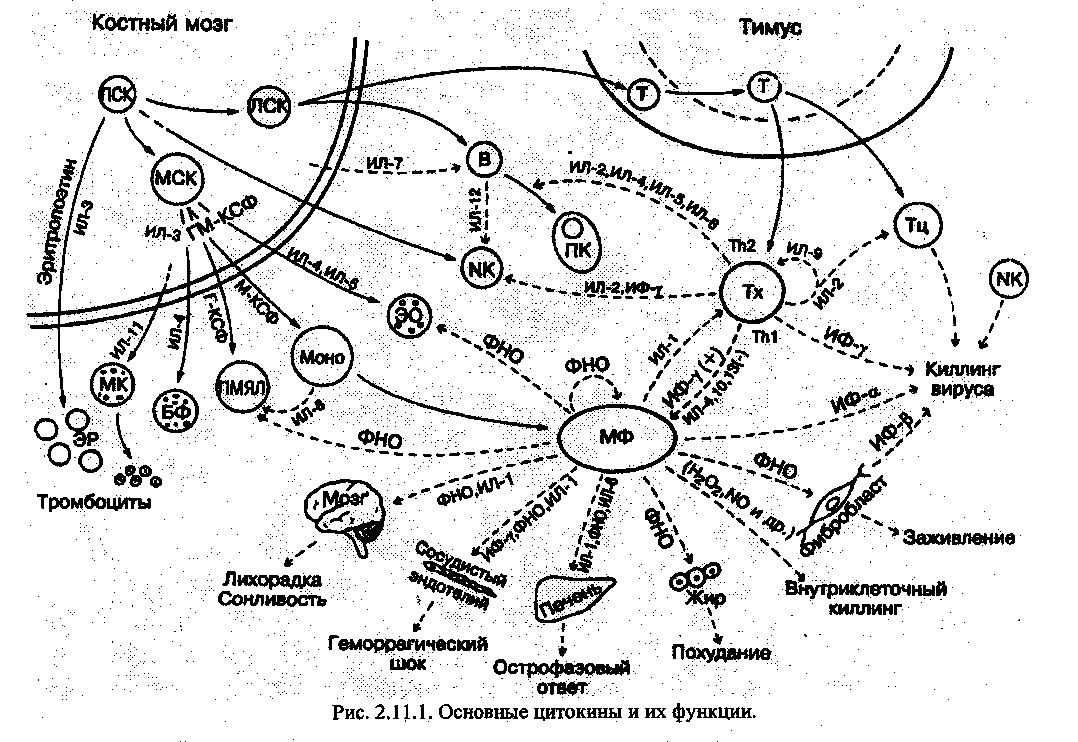
Тип иммунного ответа диктует сам Аg. Если Аg находится на клетке (трасплантант, опухолевая клетка, клетка, инфицированная вирусами или бактериями и т.д.), - в основном развивается клеточный иммунный ответ. На растворимые антигены (белки, полисахариды, а также бактерии, паразиты) формируется гуморальный иммунный ответ, и он осуществляет антибактериальную защиту и нейтрализацию токсинов.
87
Включение иммунных механизмов начинается с момента проникновения А§ организм (пути проникновения могут быть различные: чрезкожные, дыхательные пути, через желудочно-кишечный тракт, парентеральный, трансплацентарный).
С Аg взаимодействует антигенпрезинтирующая клетка (АПК), К АПК относятся макрофаги различного происхождения (моноциты, гистиоциты, клетки Купфера, мезанги-альные, альвеолярные, эндотелиальные, микроглия, кл. Лангерганса и др.). После обработки Аg и выявления его детерминантных групп в виде фрагмента пептида АПК выставляют эти детерминантные группы на своей поверхности в комплексе со своими антигенами гистосовместимости 2 класса для презентации Аg Т-хелперам. При этом выделяются цитокины и сигнальные адгезивные молекулы (ИЛь ИЛ4 ИЛ6, ИЛ12, ИЛ 15, ФИО, интер-фероны, СД4, СД8, СД8о, СД86 и др.).
На следующем этапе кооперации осуществляется взаимодействие Т-лимфоцитов с В-лимфоцитами (в случае гуморального иммунного ответа), в ходе которого В-лимфоцит распознает А§ на поверхности АПК и получает стимуляцию от АПК ИЛь от Т-хелпера ИЛ2 для последующего деления и дифференцировки в клетки памяти или плазматические клетки, которые синтезируют антитела. Вначале это 1§ М - низкоспецифические, затем, под влиянием лимфокинов, секретируемых Т-хелперами, - высокоспецифические 1§ О и А.
Иммуноглобулины различных классов имеют разное строение и соответственно различные свойства, но все они вступают во взаимодействие с Аg, способствуя в дальнейшем его элиминации (активируя комплемент, что способствует лизису корпускулярного антигена или привлекая фагоциты -~ опсонызация).
Для формирования клеточного иммунного ответа необходимы те же этапы кооперации. Т-хелперы выделяют ИЛ2 и др. цитокины, необходимые для созревания и дифференцировки цитотоксических лимфоцитов, теперь они называются Аg реактивные и способны расправиться с Аg-несущей клеткой с помощью своих цитокинов: ФИО, интерфе-роны. Много лимфокинов действует на фагоциты, например, МУФ - миграцию угнетающий фактор и др. привлекают их к Аg и стимулируют их активность.
Таким образом, при клеточном иммунном ответе цитотоксические лимфоциты через фагоциты, ТЧК-клетки и цитокины разрушают генетически чужеродные клетки.
Иммунопатология включает иммунодефициты, аллергические заболевания, аутоиммунные заболевания и лимфопролиферативные заболевания.
/. Иммунодефицитные состояния: первичные и вторичные. Патогенез СПИДа.
Иммунодефициты - нарушения нормального иммунологического статуса, которые обусловлены дефектом одного или нескольких механизмов иммунного ответа. Они подразделяются на первичные (врождённые, генетически обусловленные) и вторичные.
Вторичные иммунодефициты - это недостаточность иммунной системы, возникшая как следствие какого-то заболевания у ранее здорового человека, эта недостаточность может быть обратимой при устранении вызвавшей её причины.
Вторичный иммунодефицит встречается значительно чаще, чем первичный, почти каждое серьёзное заболевание с длительным течением в какой-то степени ослабляет иммунную систему, а также различные виды лечения химио- и лучевая терапия; все без исключения препараты, которые используют для лечения сердечно-сосудистой системы, ЖКТ, нервной системы оказывают седативное воздействие и на иммунные клетки.
Одним из наиболее клинически значимых вторичных иммунодефицитов является синдром приобретенного иммунодефицита (СПИД) обусловленный инфицированием вирусом иммунодефицита человека (ВИЧ) (рис. 2.11.2.). Следует отметить, что термином СПИД обозначается лишь последняя стадия (по клиническому течению) ВИЧ-инфекции, поскольку иммунодефицит формируется только на заключительном этапе болезни.
88
Впервые синдром описан в научной литературе в 1981 г. американскими исследователями. Однако ретроспективный анализ позволяет утверждать, что СПИД поражал людей и ранее. Первые случаи синдрома официально были зарегистрированы в США, Африке, на Гаити. В последние годы, когда были налажены методы диагностики СПИДа, выяснилось, что каждые 12-14 месяцев число зарегистрированных случаев синдрома удваивается. Соотношение инфицированных лиц к заболевшим колеблется от 50:1 до 100:1.
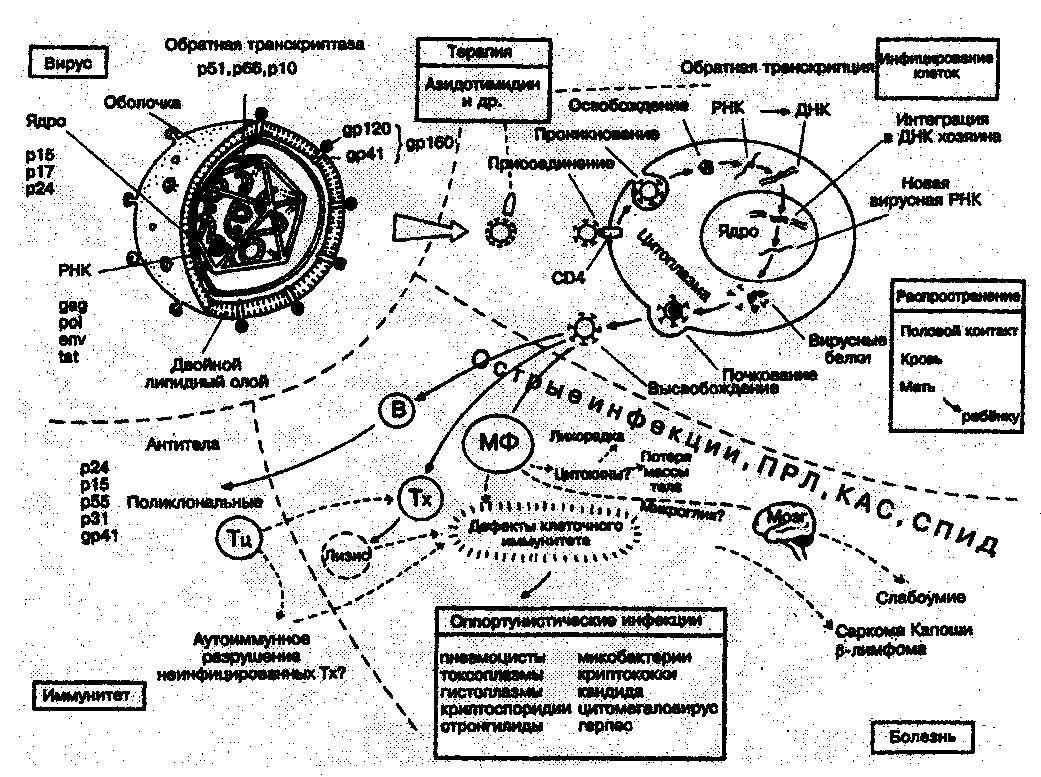
Рис. 2.11.2. Схема развития и проявлений ВИЧ-инфекции и СПИДа.
Наибольшее распространение ВИЧ-инфекция имеет среди гомо- и бисексуальных мужчин, наркоманов, вводящих наркотики внутривенно и пользующихся "коллективными" шприцами; реципиентов гемотрансфузий (больные анемиями); детей родителей, больных ВИЧ-инфекцией.
Возбудитель ВИЧ-инфекции относится к группе ретровирусов подсемейства ленти-вирусов. Они содержат однонитчатую линейную РНК и фермент ревертазу (РНК-зависимая ДНК полимеразу). Репликация вирусной нуклеиновой кислоты идет через стадию синтеза двунитчатой ДНК на матрице РНК. В клетку-мишень проникает ДНК-копия с РНК вируса, котрая интегрируется с клеточным геномом. Транскрипция информации вирусной ДНК осуществляется при участии клеточной РНК-полимеразы. Созревание вириона путем почкования идет на клеточных мембранах. В организм вирус проникает с кровью и ее дериватами, клетками при пересадке тканей и органов, переливании крови, со спермой и слюной через поврежденную слизистую или кожу. Проникнув в организм, возбудитель ВИЧ-инфекции внедряется в клетки, имеющие рецепторы СD4, к которым гликопротеиды вирусной оболочки имеют высокий аффинитет. Наиболее богаты рецепторами СD4 Т-лимфоциты-хелперы, в которые в основном и проникают вирусы. Однако
89
помимо этого вирус способен внедряться и в моноциты, фагоцитирующие клетки, нейроны, клетки нейроглии, слизистой прямой кишки.
Вирус обнаруживается в крови, в ткани слюнных желез, простаты, яичек. Через 6-8 недель (реже - через 8-9 месяцев) после инфицирования появляются антитела к ВИЧ.
Существует несколько версий о механизме лизиса клеток, пораженных ВИЧ,
Одно из допущений (Р.Галло,1983) заключается в разрушении мембран лимфоцитов, моноцитов, нейронов при "отпочковывании" вируса от клетки с последующим их лизисом. Вероятность гибели клеток пропорциональна количеству рецепторов СD4 на их поверхности. Наибольшее их число имеют Т-хелперы, в связи, с чем их количество значительно уменьшается.
В качестве другого механизма лизиса инфицированных ВИЧ клеток рассматривается возможность встраивания белков вирусной оболочки в клеточные мембраны. В связи с этим клетки распознаются ИКС как чужеродные и уничтожаются (Р.Курт, Х.Бреде,1984).
Гибель клеток связана не только с непосредственным цитопатогенным действием вируса, но и с индукцией апоптоза клеток вследствие перекрестного связывания СD4 белком gр 120.
Полагают также, что инкорпорация ДНК вируса (провируса) в геном Т-хелпера лишает их способности к трансформации и реагированию на регуляторные стимулы, в частности - на ИЛ2.
Допускается также регуляторное подавление Т-хелперов растворимыми факторами супрессии, которые выделяют мононуклеары крови больных СПИДом (Дж. Ло-уренс,1983).
Эти и другие механизмы действия ВИЧ на клетки обуславливают их лизис, вызывая уменьшение их числа. В наибольшей мере это относится к Т-хелперам. Именно по этому развивается лимфопения. Кроме того, подавляется способность Т-хелперов продуцировать ИЛ2.
Одновременно наблюдается снижение (примерно на 80-90%) количества и функциональной активности естественных киллеров (NК-клетки).
Число В-клеток, как правило, остается в пределах нормы, но функциональная активность их нередко снижается.
Количество макрофагов обычно не изменяется, однако выявляется нарушение хемотаксиса и внутриклеточного переваривания чужеродных агентов. Отмечается также расстройство механизма "презентации" макрофагом антигена Т- и В-лимфоцитам.
Указанные изменения создают предрасположенность больных СПИДом к инфекциям, лимфоретикулярным опухолям (саркома Капоши), а также - неспособности к развитию аллергических реакций замедленного типа.
Первичные иммунодефициты подразделяют на 4 главные группы, в зависимости от того, какой компонент иммунной системы неполноценен: дефекты В- или Т- лимфоцитов, фагоцитирующих клеток или комплемента. Лидирует патология В-клеток, т. е. дефекты выработки антител, она составляет более 50% случаев первичного иммунодефицита, патология Т - клеток - 30%, дефекты системы фагоцитов менее 18%, недостаточность комплемента - приблизительно 2%, т. е. наиболее уязвимы те отделы иммунитета, которые эволюционно сформировались позднее. I. Патология В-клеток
Агаммаглобулинэмия характеризуется отсутствием В-клеток (болезнь Брутона), неспособностью В-лимфоцитов дифференцироваться в плазматические клетки.
Гипогаммаглобулинэмш или избирательная неспособность к продукции какого-либо одного класса иммуноглобулинов, чаще Ig А - селективный имунодефицит Ig А, встречается 1:400. У этих больных часто развиваются аллергия и полиартрит. Страдают рецидивирующими бактериальными инфекциями: стафилококк, стрептококк, пневмококк, нейсерии.
90
II. Дефекты с преимущественным поражением Т-клеток
Синдром Ди-Джорджи - гипоплазия тимуса и паращитовидных желез вследствие недоразвития 3-4 жаберных карманов (характерны гипокальциемическая тетания, врождённая патология сердца), рецидивирующие инфекции появляются уже вскоре после рождения. Инфекции для Т-иммунодефицита другие: вирусные: корь, цито-мегаловирусные, туберкулёз, БЦЖ, грибы, пневмоцисты, кандидоз,
Тяжёлый комбинированный иммунодефицит ТКИД (дефекты Т и В-лимфоцитов). Выраженное функциональное нарушение гуморального и клеточного иммунитета. Имеются многообразные дефекты в развитии иммунокомпетентных клеток. Характерны выраженная лимфопения и агаммаглобулинемия. Болеют в основном дети, которые погибают в раннем возрасте.
ИД с атаксией-телеангиэктазией, синдром Вискотта-Олдрича - иммунный дефект проявляется в нарушении клеточного иммунитета и снижении антителообра-зования, имеется триада клинических признаков - экзема, тромбоцитопения и инфекционные осложнения.
III. Дефекты миелоидных клеток
1; Хроническая гранулёматозная болезнь - дефект генерации активных форм кислорода.
2. Синдром Чедиака-Хигаси - не формируют фаголизосомы, в других случаях нарушается хемотаксис - «ленивые лейкоциты».
IV. Дефекты системы комплемента (возможен генетически обусловленный дефицитлюбого компонента комплемента)
Дефект инактиватора - например ингибитора С1 (наследственный ангионевротиче-ский отёк).
Дефекты С1С4,С2 обуславливают предрасположенность к болезням иммунных комплексов (СКВ), С5-С9 - предрасположенность к инфекции, вызванной нейсериями.
//- Типы аллергических реакций. Стадии аллергии. Основные проявления аллергии.
Под аллергией понимается форма иммунного ответа организма на вещества антигенной или гаптеновой природы, сопровождающаяся повреждением структуры и функции собственных клеток, тканей и органов.
Аллерген - вещество (антиген, гаптен), вызывающее развитие аллергической реакции.
Протекание реакции на антиген как аллергической связано, во-первых, с характером антигена, его свойствами и количеством, во-вторых, с особенностями реактивности организма.
Повышенной реактивности способствуют:
Повышенная проницаемость кожных или слизистых барьеров, ведущая к поступлению в организм антигенов, которые в обычных условиях либо не поступают, либо их поступление ограничено (пыльца растений при поллинозах);
Выработка преимущественно 1% класса Е.
Нарушение инактивации биологически активных веществ. Например, при низкой активности плазмы крови связывать гистамин (так называемое гистаминопексическое свойство плазмы) освобождение его даже в небольших количествах может привести к патогенному эффекту и тем самым к развитию аллергической реакции.
Многие из этих особенностей детерминированы генетически, другие являются приобретенными.
Аллергены обладают всеми свойствами антигенов (макромолекулярность, преимущественно белковая природа, чужеродность для данного организма и др.).
Многие молекулярные соединения, например, лекарственные препараты, простые химические вещества (бром, йод, хром, никель и др.), а также более сложные продукты
91
небелковой природы (некоторые микробные продукты, полисахариды и др.), их называют гаптенамщ при попадании в организм, не включает иммунных механизмов, но становятся антигенами после соединения с белками тканей организма. Однако не каждое соединение химического вещества с белком приводит к образованию антигена.
Все аллергены принято делить на две группы: экзо- и эндоаллергены (или аутоал-лергены) образующиеся в самом организме.
Существует классификация, в основе которой лежит способ попадания аллергена в организм:
воздушные, ингаляционные аллергена (бытовая и производственная пыль, пыльца растений, эпидермис и шерсть животных и др.);
пищевые аллергены;
контактные аллергены, проникающие через кожу и слизистые оболочки (химические вещества, лекарства);
инъекционные (сыворотки, лекарства)
Классификация экзогенных аллергенов по происхождению:
аллергены неинфекционного происхождения: бытовые, эпидермальные, пыльцевые, пищевые, промышленные.
инфекционного происхождения: бактериальные, грибковые вирусные.
Домашняя пыль - сложный по своему составу аллерген, в который входят пылевые частицы одежды, постельного белья, мебели, грибы (в сырых помещениях), домашние насекомые, бактерии; основной компонент - клещи вида Dermatophagoideus, обитающие в постелях, подушках, питаясь чешуйками рогового слоя эпидермиса.
Эпидермальные: перхоть, шерсть животных, перья птиц, чешуя рыб.
Лекарственные.
Пыльцевые. Пыльца не всех видов растений, а только достаточно мелкая (диаметр не более 30 мкм), обладающая хорошими летучими свойствами. В каждой климатогео-графической зоне свои виды растений (береза, полынь, тимофеевка и др.).
Различные виды пыльцы могут иметь общие аллергены (пыльца злаковых) и поэтому могут давать перекрестные реакции. Лицам, страдающим поллинозами, не стоит увлекаться применением внутрь лечебных трав.
Классификация аллергических реакций.
Наибольшее распространение получила классификация, в которой выделены аллергические реакции немедленного типа (гиперчувствительность немедленного типа, ГНТ) и аллергические реакции замедленного типа (ГЗТ). В основу классификации положено время появления реакции после контакта с аллергеном. Реакции немедленного типа развивались в течении 15-20 мин. (обусловлены антителами), замедленного типа - через 1-2 суток (обусловлены лимфоцитами).

Выделяют еще 5 тип - рецепторноопосредованный или антирецепторный (иммунный тип сахарного диабета, иммунные заболевания щитовидной железы, гипофиза).
92
Классификация, предложенная Р. Уе11, К. СооотЬз (1968), основана на патогенетическом принципе. В соответствии с этой классификацией выделено 4 типа иммунных реакций (табл. 2.11.1.).
I. Реагиновый тин повреждения тканей или анафилактический. Связан с образованием особого типа антител цитотропных или цитофильных Ig Е или C4 имеющих высокое сродство к определенным клеткам (тучными, базофилами). Антиген, вступая во взаимодействие с фиксированным на клетках антителами, приводит к секреции предсущест-вующих (гистамин, серотонин, эозинофильные хемотакеичные факторы) и вновь образующихся (простагландины, лейкотриены) медиаторов, это классический путь. Они действуют на сосуды и клетки-мишени, опосредованно включая в развитие аллергической реакции эозинофилы, нейтрофилы, тромбоциты, которые в свою очередь также начинают выделять медиаторы, обозначаемые как вторичные -фосфолипаза Д, арилсульфатаза В, гис-таминаза, лейкотриены, катионные белки гранул эозинофилов.
Целый ряд других клеток (моноциты, эозинофилы и тромбоциты) также имеют на своей поверхности рецепторы для фиксирования реагинов, но их концентрация меньше, чем на тучных клетках и они низкоаффинные, с ними тоже взаимодействуют аллергены, в результате чего клетки высвобождают целый ряд различных медиаторов, обладающих провоспалительной активностью- это дополнительный путь.
Классический путь приводит к появлению немедленных реакций, развивающихся в первые полчаса. Дополнительный путь приводит к развитию так называемой поздней (или отсроченной) фазы аллергической реакции немедленного типа, развивающейся через 4-8 часов. Циркулирующий Ig Е метаболизируется довольно быстро, его период полужизни 2,4 суток. Фиксированный на клетках Ig Е сохраняется намного дольше около 28 суток.
Организм идёт по пути реагиновой гиперчувствительности при введении очень малых доз аллергена.
На малые дозы антигена макрофаги не реагируют и он представляется В-лимфоцитами Тн2, который увеличивает секрецию ИЛ4, а он стимулирует образование этих же клеток (В-клеток), идущих по пути образования Ig Е.
Атопические заболевания: атопическая форма бронхиальной астмы, поллиноз, ато-пический дерматит, и соответствующие формы крапивницы, пищевой и лекарственной аллергии, а также ряд гельминтозов, в процессе эволюции Ig Е-механизм выработался для потивопаразитной защиты.
Процесс секреции медиаторов требует энергетического обеспечения. В этом процессе определенную роль играют циклические нуклеотиды клеток: цАМФ и цГМФ. От их соотношения зависит освобождение медиаторов.
Все стимулы, приводящие к накоплению цАМФ, тормозят высвобождение гистамй-на и некоторых других медиаторов. Поэтому эффективны адреналин и {3-адреномиметики. При анафилактическом шоке необходимо вводить адреналин. Ацетилхолин -> 1цГМФ -» выброс медиаторов. Поэтому эффективны холинолитики.
II. Цитотоксическии тип, так его называют потому, что образовавшиеся к антигенам клеток антитела соединяются с клетками и вызывают их повреждение или даже лизис.
Повреждение может быть вызвано тремя путями:
За счет активации комплемента - комплемент-опосредованная цитотоксичность. Сз-С9 комплемента образуют перфорины в клетках и содержимое клетки вытекает.
За счет активации фагоцитоза клеток, покрытых антителами (опсонизация).
Через активацию антител-зависимой клеточной цитотоксичности.
Для того чтобы включился этот механизм, клетки должны приобрести аутоаллер-генные свойства. Это могут быть химические вещества, лекарственные и бактериальные энзимы, вирусы, лизосомальные ферменты фагоцитов могут повреждать клетки, придавая им антигенные свойства. Поэтому многие паразитарные, бактериальные и особенно вирусные инфекционные заболевания сопровождаются образованием аутоантител к различным клеткам тканей и развитием гемолитической анемии, тромбоцито-лейкопении. При гепатите В, антитела, а не сам вирус вызывают гибель клеток печени, на поверхности которой и имеются антигены вируса гепатита В. Этот же механизм включается при попада-
93
нии в организм аллоантигенов, например, при переливании крови, несовместимой по групповым или резус антигенам.
В зависимости от характера антител (их класс, подкласс) и их количества включаются различные пути повреждения. Антитела класса М, G1 G2 меньше G2 обладают способностью активировать комплемент. Другие антитела обладают опсонизирующими свойствами и обычно не фиксируют или слабо фиксируют комплемент. В третьем случае к Fc-фрагменту антитела присоединяются К-клетки, осуществляющие повреждающее действие на клетки мишени.
III. Поврезвдение иммунными комплексами (ИК). В норме в организме человекапостоянно образуются иммунные комплексы и разрушаются ретикуло-эндотелиальной ифагоцитарной системой. Это один из способов элиминации антигена. АО в этих случаяхприсутствует в растворимой форме (бактериальные, вирусные, грибковые, лекарственныепрепараты, пищевые вещества). Образующиеся антитела относятся главным образом кклассам Ig О, М.
В определенных условиях такой ИК может откладываться в тканях, чему способствует:
повышение проницаемости сосудистой стенки;
образование комплекса в небольшом избытке Аg, что делает его не фагоцитабель-ным;
снижение активности фагоцитирующих клеток, что ведет к угнетению процесса очищения организма от ИК,
большое поступление или образование в организме антигенов.
ИК могут образовывать место в тканях или кровотоке, в зависимости от пути поступления или места образования.
ИК взаимодействует с комплементом. Образующие его активные фрагменты обладают хемотаксической активности, стимулирует активность нейтрофилов, повышают проницаемость сосудов и способствуют развитию воспаления. Нейтрофилы фагоцитируют ИК и при этом регенерируют супероксидные радикалы, выделяют лизисомные ферменты. Активирует калликреин-кининовая система, система свертывания и т. д. В результате происходит повреждение тканей - реакция на повреждение воспаление,
3 тип аллергических реакций является ведущим в развитии сывороточной болезни, некоторых случаев лекарственной и пищевой аллергии, ряда аутоаллергических заболеваний (ревматоидный артрид, системная красная волчанка).
IV. Аллергические реакции замедленного типа. Этот тип реакции наблюдается,когда Аg располагается внутриклеточно (микобактерии, бруцеллы, листерии, вирусы) иликогда антигеном являются сами клетки (микробы, простейшие, грибы, клетки собственных тканей при приобретении или аутоантигенных свойств опухолевые стареющие клеткипри включении гаптенов в белки клеток кожи при контактном дерматите и т д.). В ответна аллерген образуется сенсибилизированные или Аg реактивные Т~лимфоциты.
При повторном попадании аллерген соединяется с сенсибилизированными лимфоцитами. Под влиянием лимфокинов с хемотоксической активностью происходит привлечение макрофагов и полиморфно-ядерных клеток к месту нахождения аллергена, они задерживаются в этой области, происходит активация их фагоцитарной активности.
Особый вид лимфокинов оказывает токсическое, угнетающее действие на клетки -мишени. Накопление клеток и клеточная инфильтрация области, где произошло соединение лимфоцита с соответствующим аллергеном, развивается на протяжении многих часов и достигает максимума через 1-3 суток. В этой области идет разрушение клеток-мишеней, их фагоцитоз, повышение проницаемости сосудов. Всё это проявляется в виде воспалительной реакции продуктивного типа, которая обычно проходит после элиминации аллергена. Если не происходит элиминации Аg, то вокруг них начинают образовываться гранулемы, с помощью которых идёт отграничение аллергена от окружающих тка-
94
ней. В состав гранулем могут входить различные мезенхимальные клетки - макрофаги, эпителиоидные клетки, фибробласты, лимфоциты.
Обычно лимфоцитов, сенсибилизированных к данному аллергену, образуется небольшое количество - 1-2%, а остальные клетки рекрутируются из числа не сенсибилизированных за счёт действия лимфокинов местно.
ГЗТ лежат в основе реакции отторжения трансплантанта, аутоиммунного энцефаломиелита, аутоиммунного тиреоидита, инфекционно-зависимой бронхиальной астмы. Они играют ведущую роль в развитии инфекционно - аллергических заболеваний (туберкулез, лепра, бруцеллез).
V. Рецеп горно-опосредованный (антирецепторный) тип связан с наличием антител, главным образом Ig О к физиологически важным детерминантам клеточной мембраны - рецепторам (а-адренорецепторы, ацетилхолиновые, инсулиновые, рецепторы для ТТГ). Реакция Аg (рецептор) + Аt может вести либо к стимуляции (Аt к ТТГ - тиреотоксикоз) либо к блокаде эффекта (иммунный тип сахарного диабета, гипотиреоз).
Стадии развития аллергии:
1. Иммунологическая - охватывает все изменения в иммунной системе, возникающие смомента поступления аллергена в организм, образования антител или сенсибилизированных лимфоцитов и соединения их с повторно поступившим или персистирующим ворганизме аллергеном.
Сенсибилизация - иммунологическое опосредованное повышение чувствительности к антигену, т. е. образование антител или сенсибилизиронных лимфоцитов.
Патохимическая, или стадия образования медиаторов - образование биологически активных веществ; стимулом к их возникновению является соединение аллергена с антителами или сенсибилизированных лимфоцитов в конце иммунологической стадии.
Патофизиологическая или стадия клинических проявлений - характеризуется патогенным действием образовавшихся медиаторов на клетки, органы и ткани организма.
///. Понятие об аллергоидных заболеваниях.
Помимо истинных: аллергических реакций существуют ещё псевдоаллергические или неиммунные, аллергоидные - клинически похожие на аллергию, но неимеющие иммунной стадии своего развития; остальные 2 стадии освобождения медиаторов - пато-химическая и стадия клинических проявлений при псевдоаллергии и истинной аллергии совпадают.
Вместе с тем необходимо различать псевдоаллергические реакции и сходные состояния, при которых отсутствует патохимическая стадия и, следовательно, не относящаяся к псевдоаллергическим. Например, при дефиците лактазы в составе кишечного сока люди не переносят молоко, его прием вызывает диарею. Клиническая картина похожа на таковую при аллергии и псевдоаллергии. Однако механизм разный. Это может быть энзи-мопатия.
Причиной псевдоаллергии является какое-либо вещество, действующее непосредственно на клетки-эффекторы (тучные клетки, базофилы) и вызывает освобождение из клеток медиаторов. Довольно часто такие реакции дают рентгеноконтрастные вещества, многие лекарственные и пищевые вещества.
На каждый случай пищевой аллергии приходится до 8 случаев цсевдоаллергии. Причем причиной могут быть как сами пищевые вещества, так и многочисленные химические; красители, консерванты, антиокислители, добавляемые в продукты. Самой частой реакцией является хроническая крапивница.
В процессе псевдоаллергии 3 группы механизмов:
гистаминовый
нарушение активации системы комплемента
нарушение метаболизма арохидоновой кислоты.
95
IV. Понятие об аутоиммунных заболеваниях.
Аутоиммунные (аутоаллергические) болезни представляют собой группы заболеваний, основным механизмом развития которых являются реакции сенсибилизированных лимфоцитов и аутоантител с тканями организма. В роли аутоантигенов могут выступать; ■ естественные, первичные антигены (неизменная ткань хрусталика глаза, щитовидной железы, яичка, нервной ткани); ■:.- приобретенные, вторичные (патологически измененные ткани) антигены как инфекционной, так и не инфекционной природы. Основной причиной аутоиммунизации считают нарушения в центральном органе иммуногенеза - тимусе, которые приводят к потере способности естественных иммуноде-прессантов подавлять функцию Т-клеток.
Классификация аутоиммунных болезней.
Органоспецифические аутоиммунные болезни (болезнь Хашимото, энцефаломиелит, полиневрит, рассеяный склероз, идиопатическая аддисонова болезнь, асперма-тогения, симпатическая офтальмия). Их возникновение провоцирует инфекция, особенно вирусная, хроническое воспаление и др. Аутоиммунизация развивается в связи с повреждением физиологических барьеров иммунологически обособленных органов, что позволяет иммунной системе реагировать на их антигены выработкой аутоантител и сенсибилизированных лимфоцитов. При этом в органах развиваются изменения, характерные преимущественно для реакции ГЗТ.
Органонеспецифические аутоиммунные болезни (системная красная волчанка, ревматоидный артрит, системная склеродермия, дерматомиозит, вторичная гемолитическая анемия и тромбоцитопения). В этих случаях нарушения контроля иммунологического гемостаза лимфоидной системы связаны с генетическими факторами, вирусной и бактериальной инфекцией, ионизирующим излучением. Аутоиммунизация развивается к антигенам многих органов и тканей, не обладающих органной специфичностью. В органах и тканях при этих заболеваниях наблюдаются изменения, характерные для реакций ГЗТ и
гнт.
2Л2. Патофизиология опухолевого роста.
Опухоль - это патологическое разрастание клеток, характеризующееся их бесконтрольным делением, а также рядом других биологических особенностей, называемых атипизмом или анаплазией (А.Х. Коган).
Для обозначения любой опухоли используется чаще всего один из латино-греческих терминов: (tumor,blastoma, пеoplasma, опсоs.
Существует два основных типа опухолей - доброкачественные и злокачественные.
Доброкачественные опухоли растут, раздвигая прилежащие ткани, иногда сдавливая их, но, обычно не повреждая (экспансивный рост); в некоторых случаях они инкапсулируются. Доброкачественные опухоли, как правило, не оказывают неблагоприятного системного воздействия на организм, поэтому их можно рассматривать как местные разрастания, не препятствующие отправлению жизненно важных функций. Их клиническое значение невелико. Исключение составляют лишь те случаи, когда локализация опухоли является фактором, угрожающим жизнедеятельности организма, например, при ее возникновении в головном мозге и сдавлении вследствие этого нервных центров.
Злокачественные опухоли - многочисленная группа тяжелых, хронических заболеваний, заканчивающихся, как правило, летальным исходом, если отсутствовала или запоздала лечебная помощь. Злокачественные опухоли характеризуются инвазивным ростом, они инфильтрируют прилегающие ткани, образуют перифокальные очаги воспаления, часто метастастазируют в близлежащие лимфатические узлы и отдаленные ткани, оказывают генерализованное воздействие на весь организм, расстраивая его гомеостаз.
96
Гистологические типы опухолей.
Для обозначения злокачественной опухоли к одному из терминов (tumor,blastoma, пеорlasma, опсоs) добавляют слово malignus, а доброкачественной опухоли - слово benig-nus.
Для обозначения доброкачественных опухолей используются также термины, которые образуются из корня латино-греческого названия ткани и окончания «ома»: например, доброкачественная опухоль из мышечной ткани - миома, из фиброзной ткани - фиброма, из костной ткани - остеома, из железистой ткани - аденома и т.д.
В зависимости от типа трансформированных клеток опухоли подразделяются на раки (происходят из клеток эпителия) и саркомы (происходят из клеток соединительной ткани).
Злокачественные опухоли обозначают специальными терминами: рак - carcinoma, сапсег - злокачественная опухоль из эпителиальных тканей; саркома (греч. sarkos - рыбье мясо) - злокачественная опухоль из соединительной ткани.
Существует много форм раков, например аденокарцинома (рак железистый, возникающий из эпителия желез), рак папиллярный (образует сосочковые структуры), бронхо-альвео-лярный (из эпителия бронхов), раки плоскоклеточные, перстневидно клеточные, овсяноклеточные, мелкоклеточные, гиган-токлеточные (по форме образующих их клеток), рак медуллярный (по внешнему сходству с тканью мозга), скирр («твердый» рак с преобладанием стромальных элементов), рак эпидермоидный (по сходству с многослойным плоским эпителием кожи) и т.д.
Саркомы подразделяются (по своей локализации) на саркомы костей, мягких тканей и органов, а по типу исходных клеток - на фибросаркомы, липосаркомы, лейомиосар-комы и рабдосаркомы (происходят из мышечных элементов), а также лимфосаркомы, хондросаркомы и т.д.
/. Особенности пролиФератиеных процессов в различных тканях организма. Изменения их в онтогенезе.
Частота возникновения опухолей из тканей различных видов зависти от интенсивности их пролиферации и регенерации.
Регенерация - восстановление утраченных тканей и органов может быть физиологической и патологической. Если физиологическая - процесс постоянного восстановления эпителия и других клеток организма, то патологическая регенерация связана с восстановлением тканей после их повреждения.
В регенерирующей ткани образуются вещества, стимулирующие размножение клеток - продукты повреждения, протеазы, полипептиды. Выявлено и стимулирующее действие продуктов распада лейкоцитов (трефоны). Важное значение в регенерации имеет нервная трофика, физиологическое соотношение гормонов, влияние температурного фактора, адекватного обеспечения аминокислотами, витаминами.
Лучше регенерируют и наиболее интенсивно делятся эпителиальная и соедини-тельная ткани, слабее мышечная. В нервной ткани высокая регенерационная способность отмечается только у нейроглии. Поэтому чаще всего, в 95% всех случаев, возникают опухоли эпителия (раки, аденомы и др.), опухоли белой крови - лейкозы (соединительная ткань).
По распространенности чаще всего возникают злокачественные новообразования легких (13-16%), простаты (32%), молочных желез (32%), кишечника (12-13%).
В каком-то смысле опухоль - это расплата за хорошую регенерацию повреждений.
Предрак - патологическое состояние, характеризующееся длительным существованием атрофических, дистрофичесих и пролиферативных процессов, которые предшествует злокачественной опухоли и в большом числе случаев с наростающей вероятностью в нее переходит.
97
Выделяют облигатные формы перехода в злокачественные (пигментная ксеродер-ма и дерматоз Боуэна) и факультативные формы - необязательного перехода.
Часто предраки сочетаются с длительно текущей воспалительной пролиферацией, причем сопровождающейся атрофией и дистрофией.
Частота возникновения злокачественных опухолей растет с возрастом («болезнь пожилых»), хотя нередки случаи их появления в относительно раннем и даже детском и младенческом возрасте. Если учесть то обстоятельство, что клиническим проявлениям опухоли предшествует очень длительный, занимающий годы и десятилетия латентный период, то вполне вероятно предположение, что неопластические «ростки» на разных стадиях формирования присутствуют в любом организме: в молодом организме - в меньшем числе и менее продвинутые, в пожилом - в большем числе и более «зрелые». С этой точки зрения, имеет право на существование мнение о неизбежности опухолевого перерождения - просто «не каждый доживает до своего рака».
Канкрофилия - увеличение вероятности развития опухоли в зрелом и старческом возрасте.
После 40 лет заболеваемость новообразованиями растет в геометрической прогрессии.
II. Этиология опухолей. Теории канцерогенеза. Условия возникновения опухолей (факторы риска).
1) Дурные привычки
Табакокурение (около 90% случаев рака легкого - наиболее частой формы рака у мужчин, 5% общей медицинской смертности); смертность от рака легкого прямо пропорциональна числу выкуриваемых в день сигарет: у людей, выкуривающих 16-25 сигарет в день, риск заболеть раком легкого в 30 раз выше, чем у некурящих.
Чрезмерное употребление алкоголя (опухоли желудка, полости рта, глотки, печени), вместе с курением дает кумулятивный эффект (синканцерогенез),
Факторы питания: диета, богатая жирами животного происхождения и копчеными продуктами, с высоким содержанием соли и низким содержанием грубых растительных волокон, с высокой концентрацией нитратов и пестицидов способствует новообразованиям; напротив, диета, включающая овощи, фрукты и витамины (С, А, р-каротин), оказывает защитный эффект.
Многочисленные случайные половые связи (промискуитет), повышающие вероятность опухолей с вирусной этиологией (например, инфицирование вирусом папилломы человека при раке шейки матки).
Чрезмерный загар (высокий риск возникновения меланом, особенно у лиц с пониженной способностью к образованию меланина - у голубоглазых блондинов).
2) Условия труда - около 100 веществ, с которыми человек сталкивается в своей трудовой деятельности, являются предположительно канцерогенными (анилиновое производство, производство асбеста, асфальта и т.д.).
Классическим примером профессионального рака является описанный в 1897 г. рак мошонки у трубочистов в Лондоне.
3) Экологические факторы - к их числу относятся загрязнение водоемов и атмосферыпромышленными отходами, содержащими канцерогены и радиоактивные соединения;загрязнение пищевых продуктов пестицидами и нитратами; строительство промышленных зданий и жилых помещений с использованием материалов, содержащих канцерогенные вещества (радон, фенолы и т.п.).
Канцерогенез (бластомогенез) - это процесс возникновения опухолей.Канцерогены (канцерогенные или бластомогенные факторы) - это все факторы,вызывающие опухоли.
98
Коканцерогены - это агенты, усиливающие действие канцерогенов, но сами не вызывающие опухоли или вызывающие их крайне редко (например, лечение глюкокор-тикоидами и иммунодепрессантами).
Синканцерогены - это совместно действующие канцерогены с возможным потенцированием эффектов.
Проканцерогены (преканцерогены) - соединения, которые могут превращаться в канцерогены в организме (например, нитриты и нитраты под влиянием НС1 желудка превращаются в нитрозамины; полициклические ароматические углеводороды эндогенно превращаются в эпоксиды).
Теории канцерогенеза. I. Вирусно-генетическая теория Зильбера объясняет развитие опухолей под воздействием биологических канцерогенов - вирусов.
На сегодняшний день существует три «доказанных» онковируса:
ДНК-вирус Эпштейн-Барра (вызывает лимфому Беркитта и рак носоглотки или на-зофарингеальный рак);
вирус паппиломы человека (вызывает рак шейки матки);
ретровирус Human - N - leukemia virus, НТLV-1 (вызывает Т-клеточный лимфолей-коз).
ретровирус Human - N - leukemia virus, НТLV-3 (вызывает предположительно саркому Калоши);
вирус гепатита В (вызывает предположительно рак печени).
ДНК-вирусы могут сразу внедряться в геном, начиная разрушительную работу, инициируя некотролируемое деление и др.
РНК-вирусы (онкорновирусы), чаще всего это ретровирусы, имеющие фермент обратная транскриптаза (синтез молекул ДНК на информационной РНК вируса). II. Физико-химическая теория Вирхова. Физические канцерогены:
• Высокая (реже низкая) температура.
Повторные ожоги могут вызвать так называемый «ожоговый» бытовой рак «кан-гри» (в северных областях Индии при использовании для согревания глиняных горшков с горячими углями, укрепляемых под одеждой на животе).
У северных народов наблюдается более высокая частота заболеваемости раком пищевода в связи с употреблением очень горячей пищи - горячей рыбы.
Механическое раздражение (например, зубными протезами).
Ионизирующая радиация,
К ионизирующей радиации относятся рентгеновское излучение (квантовое электромагнитное излучение), а-излучение (поток положительно заряженных ядер гелия, обладает высокой ионизирующей, но малой проникающей способностью), р-излучение (поток электронов со сравнительно высокой проникающей, но низкой ионизирующей способностью), у-излучение (квантовое электромагнитное излучение с длиной волны, меньшей, чем у рентгеновского излучения). Поток нейтронов (электрически нейтральных частиц) обладает высокой проникающей способностью и, сталкиваясь с атомами различных веществ, вызывает вторичное а-, b-, у-излучение.
У людей рентгеновские лучи могут быть причиной профессионального («рентгеновский» рак кожи и лейкоз у рентгенологов) и ятрогенного рака (опухоли, возникающие после врачебного лечения).
• Солнечная и ультрафиолетовая радиация. Длительное воздействие УФ спектра солнечных лучей является основным индуктором меланом на открытых участках кожи(голова, шея, руки).
Химические канцерогены:
99
а) Органические канцерогены:
полициклические ароматические углеводороды (ПАУ) - наиболее важные из них, «сильные» канцерогены, бенз(а)пирен (содержится в сигаретах, в почве, в выбросах вулканов) и диметилбенз(а)антрацен; становятся конечными канцерогенами в организме, превращаясь в соответствующие эпоксиды;
ароматические амины и амиды - нафтиламин, бензидин вызывают профессиональный рак мочевого пузыря;
аминоазосоединения - ортоаминоазотолуол, диметиламиноазобензол;
нитрозосоединения - диметилнитрозамин, диэтилнитрозамин, этил- и диэтилнит-розомочевина; могут синтезироваться в организме из нитритов (нитратов) и вторичных аминов, содержащихся в пище; кроме того, вторичные амины могут образовываться в толстой кишке при участии бактериальной флоры, которая в то же время способна переводить нитраты в нитриты
афлатоксины - вещества, образуемые плесенью Aspergilus flavus, поражающей пищевые продукты (особенно арахис);
другие органические канцерогенные вещества, относящиеся к различным классам соединений - уретан, этионин, четыреххлористый углерод, хлорэтиламины, эпоксиды, лактоны, винилхлорид, пластмассы, липидные перекиси и др.
Ь) Неорганические канцерогены: хром, мышьяк (примесь его в сигаретах в 15 раз превышает его максимально допустимое количество), кобальт, никель (содержится в табачном дыме), бериллий, свинец, кадмий и др.
Асбест широко использовался как изоляционный и огнеупорный материал, найден почти во всех постройках, возведенных в США с 1940 по 1970 год. Самое большое индивидуальное поражение асбестом происходило у рабочих верфей во время второй мировой войны, с) Лекарственные канцерогены:
Рентгеноконтрастный препарат торотраст (включавший окись тория) применялся в 1930-1945 годах для диагностических целей при заболеваниях печени и селезенка и способствовал спустя 15-20 лет возникновению злокачественных опухолей. Отлагаясь в костях близ кроветворных тканей, природный торий-232 становится источником гораздо более опасных для организма изотопов - мезото-рия, тория-228, торона.
Противоопухолевые лекарства - некоторые лекарства, используемые для лечения опухолей (алкилирующие агенты, типа циклофосфамида, хлорамбуцила, бисульфата и тиотефа) воздействуют на синтез нуклеиновых кислот и в опухолевых клетках, и в нормальных клетках и могут вызывать онкогенные мутации (например, лейкемия - наиболее частое неопластическое осложнение химиотерапии рака).
Эстрогены - вызывают гиперплазию эндометрия, которая сопровождается сначала цитологической дисплазией, переходящей затем в рак эндометрия.
Предполагаемый механизм образования ДНК-повреждающих реактивных метаболитов в процессе обмена эстрогенов (J.Liehr, 1990) заключается в том, что благодаря ферментативным реакциям в тканях-мишенях (молочная железа, эндометрий и др.) из классических эстрогенов типа эстрадиола или эстрона образуются катехолэстрогены, в ходе метаболического восстановительного цикла возникают свободные радикалы, в частности семихиноны и их производные, которые в свою очередь индуцируют образование других свободных радикалов, включая супероксидный анион и перекиси липидов, которые могут повреждать белки и ДНК.
Диэтилстилбэстрол - синтетический эстроген, использовался в высоких дозах с 1950 по 1960 год для лечения угрожающего выкидыша. У детей, которые внутриутробно были подвержены влиянию диэтилстилбэстрола, было определено значительное увеличе-
100
ние заболеваемости светлоклеточной аденокарциномой, которая является редким раком влагалища и развивается у молодых женщин между 15 и 30 годами.
Стероидные гормоны - использование оральных контрацептивов и анаболических стероидов иногда связывают с возникновением доброкачественных печеночнокле-точных аденом, описано несколько случаев возникновения печеночноклеточного рака.
Препараты различных групп, вызывающие гинекомастию (некоторые с известным стероидным эффектом, механизм действия других неясен), которая является предраковым заболеванием (рак молочной железы у мужчин): изониазид, ранитидин, метронидазол, метилдофа, эналаприл, амиодарон.
Полиэтиологическая теория объединяет две выше упомянутые теории.
Генотоксическая (современная) теория
Превращение нормальной клетки в опухолевую является результатом стойких изменений в геноме клетки. То есть все канцерогены генотоксичны, поскольку вызывают повреждение ДНК. С открытием молекулярных механизмов канцерогенеза появился новый взгляд на этиологию - генотоксическая теория. Вирусы, физические факторы и химические вещества - это только виды канцерогенов.
