
- •Содержание
- •Часть 1. Предмет патологии. Учение о болезни (Куликов в.П., Доронина н.Л.)... 8
- •Часть 2. Механизмы развития болезней (Куликов в.П., Доронина н.Л.) 15
- •Часть 3* Патология органов и систем (Куликов в.П., Доронина н.Л.) 157
- •Часть 4. Ситуационные задачи (Куликов в.П., Костюченко л.А., Доронина н.Л,
- •Часть 5. Тестовые задания (Куликов в.П., Костюченко л.А., Воронцов в.В.,
- •Часть 6. Задания для подготовки к занятиям. Вопросы к экзамену (Куликов в.П.,
- •Часть 1. Предмет патологии. Учение о болезни.
- •I. Предмет патологии.
- •IIII Понятие болезни. Патологические реакции, процессы, состояния. Симптом и синдром. Классификация, стадии развития и исходы болезней.
- •IV. Умирание. Терминальные состояния.
- •VI. Патогенез заболеваний. Саногенез.
- •VII. Лечение заболеваний
- •Часть 2. Общая патология. 2.1 .Повреждение клетки.
- •IV. Общий адаптационный синдром. Схема развития симпато-адреналовой и гипоталамо-гипоФизарно-адреналовой реакций при стрессе. Стресс-реализующие и стресс-лимитирующие системы.
- •Стадии стресса или общего адаптационного синдрома:
- •V. Дистресс Болезни адаптации. Ятоогенные осложнения вследствие использования аналогов стресс-реализующих гормонов.
- •IV. Механизм Формирования патологии у плода при алкоголизме беременной женщины.
- •V. Методы изучения наследственных болезней.
- •2.4. Нарушение регионального кровообращения. Тромбозы и эмболии.
- •7. Характер движения крови по сосудам:
- •IV. Виды региональных нарушений кровообращения и их механизмы. Сладж-Феномен.
- •V. Методы оценки сосудистой гемодинамики.
- •2.5. Патология гемостаза.
- •V. Гипокоагуляиии. Связанные с дефицитом плазменных прокоагулянтов
- •2.6. Гипоксия.
- •I. Понятие гипоксии.
- •V. Адаптивные реакции организма: срочные и долговременные (дыхательные, гемодинамические, гемические, тканевые). Срочная адаптация к гипоксии (или 1-ая стадия долговременной адаптации)*
- •2.7. Патофизиология боли.
- •II. По характеру:
- •III. Понятия обморока и коллапса. Отличия от шока.
- •IV. Кома. Этиология и патогенез отдельных видов ком (печеночная, уремическая, диабетическая).
- •2.9. Воспаление.
- •III. Стадии опухолевого роста.
- •IV. Свойства опухолевого роста.
- •V. Опухолевые маркеры. Механизмы изменения иммунного надзора при
- •2.13. Патология углеводного обмена. Сахарные диабеты.
- •IV. Нарушение платочного метаболизма липидов. Жировая инфильтрация органов.
- •V Этиология и патогенез атеросклероза. Стадии развития атеросклероза и осложнения.
- •2.15. Патология белкового обмена.
- •IV. Вторичные нарушения обмена аминокислот. Патология конечных этапов белкового обмена, роль печени и почек е метаболизме аммиака. Нарушение обмена пуриновых и пиримидиноеых оснований.
- •Часть 3. Патология органов и систем. 3.1. Патология красной крови.
- •IV. Этиология и патогенез гемолитических анемий.
- •2. Липидзависимые мембранопатии:
- •3. Ферментопатии:
- •4. Гемоглобинопатии:
- •V. Этиология и патогенез дизэритропоэтических анемий.
- •VI. Компенсаторные реакции организма при анемиях.
- •3.2. Лейкоцитозы и лейкопении. Лейкозы.
- •I. Лейкоцитозы.
- •IV. Лейкемоидные реакции. Виды. Причины возникновения.
- •V. Лейкозы. Общая характеристика,
- •I. По виду клетки-«родоначальницы» лейкоза:
- •VI. Лабораторная характеристика лейкозов. Отличия лейкозов от лейке-моидных реакций.
- •VII. Общие изменения е организме при лейкозах.
- •3.3. Сердечная недостаточность.
- •2. Гипертрофия левого предсердия
- •1. Гипертрофия правого желудочка
- •2. Гипертрофия левого желудочка
- •1, Нервная регуляция.
- •1А} Норма
- •IV, Диагностика аритмий.
- •3.7. Патология артериального давления и сосудистого тонуса.
- •Резервный
- •VI. Компенсаторные процессы при недостаточности внешнего дыхания.
- •IV. Расстройства функции тонкого и толстого кишечника: секреции, переваривания, всасывания и моторики.
- •1. Усиление перистальтики кишечника.
- •2. Ослабление перистальтики кишечника.
- •V. Нарушение барьерной функции кишечника. Дисбактеоиоз.
- •I Повышение проницаемости мембранПовреждение мембран клеток с их частичной или полной деструкцией
- •Часть 4. Ситуационные задачи.
- •Часть 5. Тестовые задания.
- •Часть 6. План практических занятий. Вопросы к экзамену. 6.1. План практических занятий по патофизиологии.
2.15. Патология белкового обмена.
Белок - высокомолекулярный органический биополимер, состоящий в основном из аминокислот, соединенных пептидной связью. Классификация белков. I. По растворимости:
водорастворимые,
солерастворимые,
спирторастворимые,
нерастворимые,
прочие.
П. По конформационной структуре:
фибриллярные (коллагены, эластины, кератины),
глобулярные: альбумины, глобулины, гистоны (все ферменты и большинство БАВ).
III. По химическому строению:
1. Простые (протеины) - состоят только из аминокислот.
1.1. Глобулярные
а) Альбумины - растворимы в воде, не растворимы в концентрированных растворах
солей. b) Глобулины - не растворимы в воде, растворимы в солевых растворах, с) Гистоны - растворимы в воде, в слабоконцентрированных кислотах. Обладают
выраженными основными свойствами. Это ядерные белки, они связаны с ДНК и
РНК. d) Протамины - ассоциациированы с нуклеиновыми кислотами.
1.2. Фибриллярные (склеропротеины) ■- белки опорных тканей (хрящей, костей), шерсти, волос. Не растворимы в воде, слабых кислотах и щелочах.
коллагены - фибрилярные белки соединительной ткани. При длительном кипячении они растворяются в воде и при застудневании образуется желатин.
эластины — белки связок и сухожилий. По свойствам похожи на коллагены, но подвергаются гидролизу под действием ферментов пищеварительного сока;
кератин - входит в состав волос;
2. Сложные (протеиды) - помимо аминокислот имеют в составе небелковую часть(глико-, липо-, металло-, фосфо-, нуклео-, хромопротеиды)
а) Нуклеопротеиды ~ простетическая група - нуклеиновые кислоты. Среди многочисленных классов нуклеопротеидов наиболее изученными являются рибосомы, состоящие из нескольких молекул РНК и рибосомных белков, и хроматин - основной нуклеопротеид эукариотических клеток, состоящий из ДНК и структурообразующих белков - гистонов (содержатся в клеточном ядре и митохондриях).
b) Гемопротеиды - небелковый компонент этих протеидов — тем, построен из четырех пиррольных колец, с ними связан ион двухвалентного железа (через атомы азота). К таким белка относятся: гемоглобин, миоглобин, цитохромы. Этот класс белков еще называют хромопротеиды, поскольку гем является окрашенным соединением. Гемоглобин - транспорт кислорода. Миоглобин - запасание кислорода в мышцах. Цитохромы (ферменты) — катализ окислительно-восстановаительных реакций и электронный транспорт в дыхательной цепи.
130
с) Металлопротеиды - в состав простетической группы входят металлы. Цитохром а - содержит медь, сукцинатдегидрогеназа и др. ферменты содержат негеминовое железо (ферродоксин).
d) Липопротеиды ~ содержат липиды, входят в состав клеточных мембран
е) Фосфопротеиды - содержат остаток фосфорной кислоты
f) Глюкопротеиды - содержат сахара
Функции белков: структурная (пластическая), каталитическая, транспортная, ме-ханохимическая, регуляторная, защитная, опорная, энергетическая, рецепторная.
Потребность в белках. Дети 0,88-0,77 г/кг массы тела. Подростки 0,72-0,64 г/кг массы тела. Взрослые 0,59 г/кг массы тела.
Человек массой 70 кг ежедневно потребляет с пищей около 80-100 г белка. Кроме того, 10-20 г белка секретируется в виде ферментов и еще приблизительно 20 г белка дают клетки слизистой оболочки, слущивающиеся с поверхности пищеварительного тракта. Практически весь этот белок переваривается и всасывается.
Переваривание белков
На первой стадии переваривания пища подвергается механическому измельчению в полости рта, что увеличивает площадь поверхности для последующих стадий.
Соляная кислота, секретируемая париетальными клетками желудка убивает бактерии и вызывает денатурацию белков, что увеличивает поверхность, на которую воздействуют пищеварительные ферменты. Пищеварительные ферменты выделяются в полость желудочно-кишечного тракта в неактивной форме (зимогены), поэтому они не повреждают слой эпителиальных клеток слизистой оболочки, выстилающей полость изнутри.
Пепсиноген (предшественник пищеварительного фермента пепсина) секретируется зимогенпродуцирующими клетками желудка. Пепсин сохраняет стабильность только в кислой среде желудочного содержимого, где он расщепляет пептидные связи. Возникающие в результате большие пептидные фрагменты и отдельные аминокислоты стимулируют секрецию пищеварительных ферментов в тонкую кишку.
Переваривание белков в тонкой кишке начинается с регулируемого выделения эн-терокиназы эпителиальными клетками двенадцатиперстной кишки и зависит от секреции ионов бикарбоната, которые нейтрализуют кислоту, поступающую с желудочным содержимым. Энтерокиназа отщепляет гексапептид от молекулы трипсиногена (одного из зи-могенов, секретируемых поджелудочной железой), превращая его в трипсин. Трипсин обладает аутокаталитической активностью и, кроме того, активирует другие панкреатические зимогены, отщепляя от них пептидные фрагменты. Активированные ферменты поджелудочной железы гидролизуют пептидные связи в различных участках полипептидных цепей. Трипсин, химотрипсин и эластаза относятся к эндопептидазам, расщепляющим связи внутри цепи. Две карбоксипептидазы отщепляют аминокислоты от Оконца молекул белка.
Олигопептиды, образующиеся в результате действия панкреатических ферментов, подвергаются дальнейшему расщеплению с помощью аминопептидаз и дипептидаз, расположенных на поверхности эпителиальных клеток кишечника. Конечными продуктами переваривания белков в полости кишечника являются аминокислоты, дипептиды и три-пептиды, которые всасываются клетками эпителия. Дальнейший гидролиз пептидных связей происходит внутри клеток эпителия перед окончательным транспортом аминокислот в кровь воротной системы.
В целом все ди- и три- пептиды распадаются на составляющие их аминокислоты внутри клеток эпителия. Исключением являются пептиды, содержащие пролин, гидрокси-пролин или необычные аминокислоты.
Всасывание аминокислот происходит в тонком отделе кишечника. Это активный процесс и требует затраты энергии. Аминокислоты попадают в портальный кровоток —> в
131
печень
и в общий кровоток. Печень и почки
поглощают аминокислоты интенсивно;
мозг избирательно
поглощает метионин, гистидин, глицин,
аргинин, глутамин, тирозин.
В толстом отделе кишечника, не всосавшиеся по каким-либо причинам пептиды и аминокислоты, подвергаются процессам гниения. При этом образуются такие продукты как фенол, крезол, сероводород, метилмеркаптан, индол, скатол, кадаверин, путресцин. Эти вещества всасываются в кровь и поступают в печень, где подвергаются конъюгации с глюкуроновой кислотой и другим процессам обезвреживания. Затем они выводятся из организма с мочой.
Пути использования аминокислот в организме,
1. Синтез собственных белков организма. Скорость синтеза и деградации белка400 г/сутки у взрослого массой тела 70 кг» Распад катализируют протеиназы (катепсины) ипептидазы. Синтез осуществляется в соответствии с генетической программой. Периодполуобновления белков организма около 3 недель.
Участие в образовании биологически активных веществ путем декарбоксилиро-вания аминокислот.
Глюконеогенез и выработка энергии при использовании альфа-кетокислот, получаемых путем трансаминирования аминокислот.
Метаболизм аминокислот.
Основные процессы метаболизма аминокислот включают трансаминирование, окислительное дезаминировани и декарбоксилирование.
Переаминирование (трансаминирование) - происходит обмен аминогруппы (— NН2) на кетогруппу между амино- и кетокислотой. Процесс происходит с участием ферментов трансаминаз (аминотрансфераз). Коферментом аминотрансфераз является производное витамина В6 - пиридоксальфосфат, играющий роль переносчика NН2-группы от аминокислоты к кетокислоте.
Важную роль играют две реакции трансаминирования:АК + а-кетоглутаровая кислота > а-кетокислота + глутаминовая кислота
В результате образуется глутаминовая кислота, которая единственная активно дезаминируется с образованием аммиака.
глутаминовая кислота + щавеливоуксусная кислота > а-кетокислота + аспарагино-
вая кислота
В результате образуется аспарагиновая кислота, которая, как и аммиак, участвует в образовании мочевины в орнитиновом цикле.
Все аминокислоты в процессе переаминирования отдают аминогруппу на аминокислоту и через них на мочевину.
Кетокислоты, образовавшиеся в процессе переаминирования, служат предшественниками глюкозы или кетоновых тел. Кетокислоты вовлекаются в цикл трикарбоновых кислот и расщепляются до СО2 и Н2О.

Окислительное дезаминировние или отщепление аминогруппы катализируется ферментами класса аминооксидаз. Они очень специфичны и малоактивны. Единственный высокоактивный фермент работает в печени и мозге - это глутаматдегидрогеназа. Он катализирует превращение глутаминовой кислоты в альфа-иминоглутаровую, затем происходит ее гидролиз (без участия ферментов) в алъфа-кетоглутаровую и образование аммиака.
RСНСООН _ 2н RССООН нон R—ССООН +NH3I — —> II — —> II
NH2 о о
Декарбоксилирование или отщепление карбоксильной группы с образованием С02 и амина. Катализируют реакцию декарбоксилазы. В тканях этим процессам подвергаются в основном гистидин, тирозин, глутаминовая кислота, Из них образуются гистамин, тира-мин, гамма-аминомаслянная кислота.
132
кснсоон
ксн2
+ со2
I—
I
ын2 о
I —> I
NH2 о
Гистамин - продукт декарбоксилирования гистидина. Накапливается в тучных клетках. В слизистой желудка активирует синтез пепсина и соляной кислоты. Является одним из медиаторов воспаления.
Серотонин образуется из триптофана преимущественно в нейронах гипоталамуса и стволе мозга. Является медиатором этих нейронов. Разрушается под действием моноами-ноксидазы обычно в печени.
Дофамин - производное тирозина. Он является медиатором проведения нервного импульса, а также предшественником меланина, норадреналина и адреналина.
Гамма-аминомаслянная кислота образуется из глутаминовой кислоты. Является тормозным медиатором ЦНС.
/. Положительный и отрицательный азотистый баланс. Нарушение усвоения белков пиши.
Азотистое равновесие - количество потребляемого азота с пищей соответствует количеству азота выводимого из организма.
Положительный азотистый баланс - накопление азота в организме, вследствие повышения биосинтеза белков и нуклеотидов, что наблюдается в растущем организме, при беременности, при введении гормонов анаболического действия, в период реконва-лесценции после болезни, при активном росте опухолей.
Отрицательный азотистый баланс - снижение количества азота в организме, что имеет место при потере белков или большом расходе их организмом. Количество выводимого из организма азота выше поступающего. Подобное может наблюдаться при голодании, тиреотоксикозе, инфекционной лихорадке, ожогах, поносах, кровопотере, заболеваниях почек с выраженной протеинурией.
Гормоны анаболического действия активируют в организме синтез белков - СТГ, ФСГ, ЛГ, половые стероидные гормоны, инсулин.
Лекарственные препараты анаболического действия - нуклеинат натрия, оро-тат калия, метилурацил, витамин А, витамин В12, ретаболил, метандростенолон и др.
Гормоны катаболического действия активируют протеолиз и формируют отрицательный азотистый баланс в организме - тироксин, глюкокортикоиды.
Лекарственные препараты катаболического действия - цитостатики, левоми-цетин и др.
Нарушения поступления, переваривания и всасывания белков. 1. Количественная или качественная белковая недостаточность первичного (экзогенного) происхождения, обусловленная ограничением поступления экзогенных белков при полном или частичном голодании, низкой биологической ценностью пищевых белков, дефицитом незаменимых аминокислот (валин, изолейцин, лейцин, лизин, метио-нин, треонин, триптофан, фенилаланин, гистидин, аргинин).
Квашиоркор - это тяжелое заболевание, вызванное белковым голоданием, которому нередко предшествует инфекция. Слово "квашиоркор" происходит из языка западноафриканского народа га (Ga), проживающего на территории современной Ганы. Оно означает "болезнь первенца после рождения младшего". После отнятия от груди первенец лишается источника полноценного белка и его питание, субдостаточное в калорическом отношении, становится, преимущественно, углеводистым. Это приводит к развитию характерной отёчной формы несбалансированной белково-энергетической недостаточности, сопровождаемой ранней потерей протеинов из висцерального пула организма. Основные симптомы: общая слабость, отеки, депигментация кожи (следствие дефицита тирозина),
133
замедление роста, анемия, гипопротеинемия, отек, жировая инфильтрация печени (дефицит ЛПОНП), атрофия поджелудочной железы, диарея, стеаторея.
Алиментарный маразм (мумифицированная или сухая форма алиментарной дистрофии) - сбалансированная форма белково-энергетического дефицита. Характеризуется длительным компенсированным течением, когда нутриенты мобилизуются из соматического отсека тела, а висцеральный пул белка дольше сохраняется. При этом значительной степени достигает атрофия мышц и жировой клетчатки, долго не возникает заметных отёков.
Дефицит пепсина может возникать при частичной резекции желудка за счет уменьшения секреции пепсиногена главными клетками слизистой, кроме того, при пониженной кислотности пепсиноген плохо активируется до пепсина. В результате этого белки не полностью расщепляются до пептидов и вся нагрузка по их дальнейшему перевариванию ложится на тонкий отдел кишечника.
Дефицит трипсина, энтеропептидазы, карбоксипептидазы может быть обусловлен смещением рН в более кислую сторону, патологией поджелудочной железы, нарушением секреции желудком гастрина (регулирует секреторную активность панкреаса). В результате негидролизованные белки не могут резорбироваться из просвета кишечника и подвергаются массовому гниению, возникает аутоинтоксикация организма на фоне низкого содержания в крови аминокислот.
Усиление перистальтики кишечника (энтероколиты) или уменьшение площади всасывания (оперативное удаление значительных участков тонкого кишечника) вызывает недостаточное действие пищеварительных ферментов на белки. Это ведет к резкому сокращению времени контакта содержимого химуса с апикальной поверхностью энтероцитов, незавершенности процессов энзиматического распада и процессов активного и пассивного всасывания.
Повреждение стенки тонкого кишечника (отек слизистой оболочки, воспаление) или неравномерное по времени всасывание отдельных аминокислот являются причинами нарушения всасывания аминокислот* Это ведет к нарушению соотношения аминокислот в крови и дефектам синтеза белка, поскольку незаменимые аминокислоты должны поступать в организм в определенных количествах и соотношениях. Чаще всего отмечается нехватка метионина, триптофана, лизина и ряда других аминокислот.
//. Нарушение синтеза белка.
I. Нарушения синтеза белка приобретенного характера обусловлены преимущественно следующими причинами:
Различные виды алиментарной недостаточности (полное, неполное голодание, отсутствие в пище незаменимых аминокислот).
Дефицит энергии при гипоксии.
Дефицит анаболических гормонов,
Избыток катаболических гормонов.
Опухоли.
Дефицит витаминов.
Нарушение иннервации вызывает дефицит трофогенов и развитие трофических язв.
Нарушение синтеза белка вызывают некоторые антибиотики (стрептомицин, не-омицин и др.).
II. Изменение активности ферментных систем клеток, участвующих в синтезе белка, носят в основном наследственный характер.
■ Гемоглобинопатии - аномалии, связанные с нарушением механизма синтеза белкового компонента гемоглобина при нормальной структуре гема. Выявлено более 15 видов аномальных молекул гемоглобина, где в альфа- или бета-цепи произошла замена одной из аминокислот (пример, серповидно-клеточная анемия).
134
■ Глютеновая энтеропатия (целиакия) - заболевание тонкой кишки с гиперрегенераторной атрофией слизистой в ответ на употребление белка злаков - глютеина. При этой патологии обнаружен наследственный дефект белков главного комплекса гистосовместимости. Повреждает слизистую глиадин - один из основных компонентов белка глютеина. К антигенам поврежденных энтероцитов образуются цитотокси-ческие лимфоциты и антитела, что приводит к атрофии слизистой, ее инфильтрации лимфоцитами, нарушению функциональной активности желудочно-кишечного тракта, интоксикации.
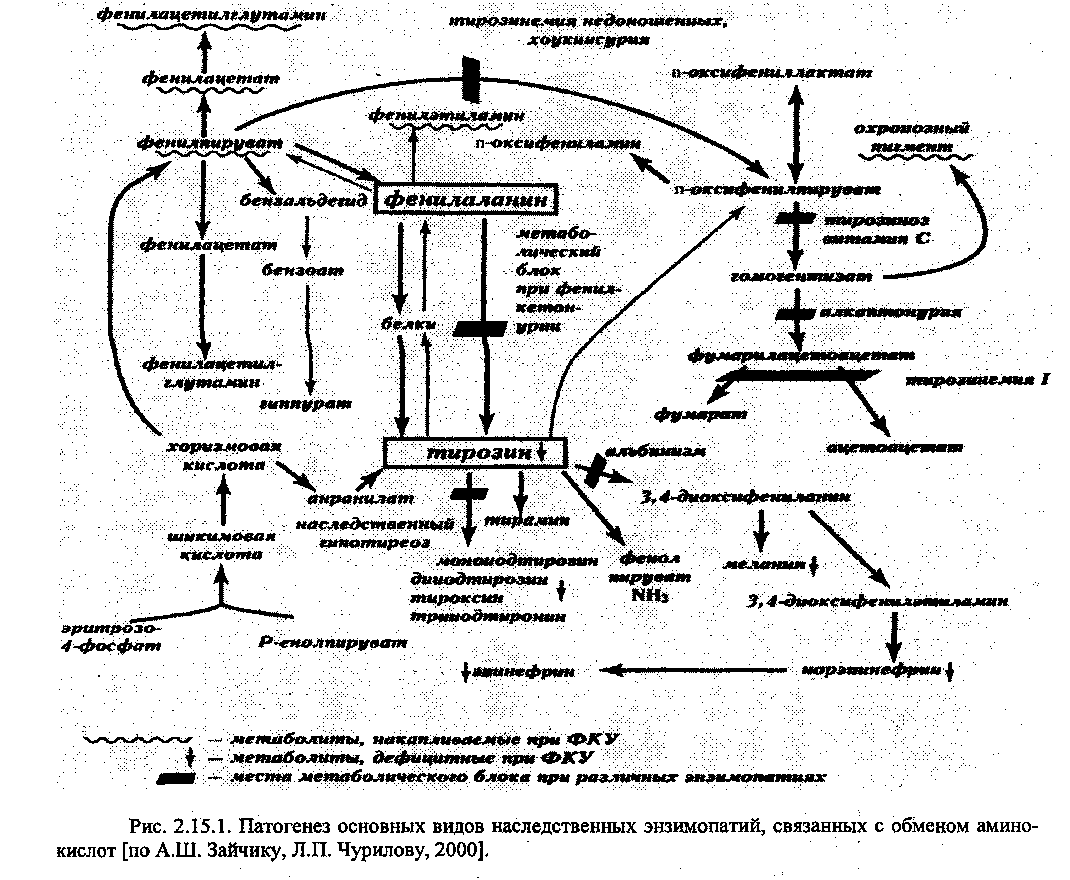
///. Наследственные энзимопатии, связанные с нарушением обмена аминокислот.
Схематически патогенез основных видов наследственных энзимопатии, связанных с обменом аминокислот представлен на рисунке 2.15.1.
Алкаптонурия («болезнь темных пеленок») - заболевание с аутосомно-рецессивным типом наследования, обусловленное дефект оксидазы промежуточного продукта распада фенилаланина и тирозина - гомогентизиновой кислоты.
Накопление гомогентизиновой кислоты ведет к ее превращению в хиноновые полифенолы, составляющие охронозный пигмент, выводимый почками. Это обусловливает потемнение мочи больных на воздухе.
Гомогентизиновая кислота ингибирует фермент лизилгидроксилазу, участвующий в синтезе коллагена, а охронозный пигмент (алкаптон) не полностью экскретируется с мочой, откладывается в основном веществе хрящей и других соединительнотканных образованиях, что со временем (после 30-ти лет) определяет появление клиники полиартрита, пигментации склер и хрящей.
Фенилкетонурия. Фенилаланин - незаменимая аминокислота. Помимо включения в процесс биосинтеза белков, фенилаланин метаболизируется в печени. В норме большая часть фенилаланина превращается в тирозин. Реакция катализируется феншаланингид-роксилазой при участии тетрагидробиоптерина.
Известны две группы наследственных нарушений обмена фенилаланина, сопровождающихся фенилаланинемией: обусловленные дефектом фенилаланингидроксилазы (ау-тосомно-рецессивный тип наследования) и являющиеся следствием генетически детерминированных дефектов ферментов, участвующих в синтезе и метаболизме тетрагидро-биоптержа.
Фенилкетонурия проявляется характерным симптомокомплексом: умственная отсталость, судорожный синдром, склонность к экземе, нарушение пигментного обмена. От больных исходит специфический «мышиный» запах, обусловленный высоким содержанием фенольных кислот в биологических жидкостях. Эти симптомы появляются в первый год жизни. При отсутствии лечения больные, как правило, не доживают до 30 лет.
В патогенезе симптомов фенилкетонурии основную роль играют нарушения обмена циклических аминокислот:
• увеличение концентрации фенилаланина ограничивает транспорт тирозина итриптофана через гематоэнцефалический барьер и тормозит синтез неиромедиаторов;
накопление фенилаланина в клетках мозга нарушает реакции синтеза церебро-зидсульфатов, участвующих в защите мозга от демиелинизации;
фенилаланин и его производные фенольные кислоты оказывают нейротоксиче-ское действие. Они являются ингибиторами тирозингидроксилазы и триптофангидрокси-лазы - ключевых ферментов синтеза неиромедиаторов: дофамина, норадреналина, серото-нина.
Для предотвращения токсического действия фенилаланина и фенилпирувата белковая пища заменяется набором аминокислот без фенилаланина.
Коферментзависимая гиперфенилаланинемия поддается фармакотерапии тетра-гидробиоптерином.
135
Альбинизм - врождённый дефицит или отсутствие пигмента в коже, волосах, радужке и сетчатке глаза за счёт нарушения обмена тирозина при синтезе меланинов (отсутствие или дефицит тирозиназы). Принято различать генерализованные (кожно-глазные), изолированные (глазные) и смешанные типы альбинизма.
Цистинурия - заболевание, наследуемое по аутосомно-рецессивному типу. Характеризуется нарушением реабсорбции цистина, а также и других аминокислот (лизина, ор-нитина, аргинина) в почечных канальцах. При этом заболевании формируются цистеино-вые камни в почках, обьгчно в возрасте 10-20 лет. В норме с мочой выделяется около 30 мг цистеина в сутки.
Болезнь Фанкони - заболевание, наследуемое по аутосомно-рецессйвному или аутосомно-доминантному типу. В основе болезни лежит ферментопатия, йрийодящая к снижению реабсорбции аминокислот, глюкозы,фосфатов в проксимальное отделе почечных канальцев. Болезнь проявляется в начале второго года жизни.
Гипергомоцистеинурия - ферментопатия, Наследуемая по аутосомно-рецессивному типу, связанная с недостаточностью фермента цистатионин-р-синтазы. При гомозиготной форме характеризуется очень высоким уровнем гомоцистеина в крови (более 100 мкМ/л, при норме 5-15 мкМ/л). При гетерозиготной форме концентрация гомоцистеина в плазме умеренно повышена. Гомоцистеин быстро окисляется в плазме крови с образованием свободных радикалов кислорода. В результате повреждается эндотелий, на-
136
рушается метаболизм липопротеидов и свертывание крови, что приводит к ускоренному развитию атеросклероза и венозным тромбозам.
