
- •Методы исследования свойств и продуктов питания
- •Методы исследования свойств сырья и продуктов питания
- •ВвЕдение
- •1. Измерения и их классификация
- •1.1. Единицы измерения величин
- •1.2. Системы единиц
- •Кратные и дольные единицы по гост 1052-78
- •2. Статистический анализ измерений
- •2.1. Погрешности приближенных величин
- •2.2. Математическая статистика измерений
- •2.2.1. Параметры точности ряда измерений
- •Интегральная функция Лапласа
- •2.2.2. Анализ результатов экспериментов
- •2.3. Нахождение оптимальных параметров, применение методов планирования экспериментов
- •2.3.1. Схема Зайделя–Гаусса
- •2.3.2. Метод Бокса
- •2.3.3. Нахождение оптимальных параметров с помощью эвм
- •2.3.4. Пример оптимизации процесса приготовления пивного сусла
- •Матрица экспериментальных данных
- •2.3.5. Пример оптимизации использования питательной среды при культивировании пекарских дрожжей
- •Матрица экспериментальных данных
- •2.3.6. Аппроксимация экспериментальных данных
- •3. Отбор проб сырья, полуфабрикатов и пищевых продуктов для проведения исследований
- •3.1. Отбор проб сыпучих продуктов
- •3.1.1. Отбор проб из вагонов
- •3.1.2.Отбор проб из автомашин
- •3.1.3. Отбор проб из танкеров и барж
- •Размеры проб
- •3.1.4. Отбор проб от партии затаренных сыпучих продуктов
- •3.2. Отбор проб сыпучих продуктов при хранении
- •3.2.1. Отбор проб из бунтов
- •3.2.2. Отбор проб из силосов элеваторов
- •3.2.3. Отбор проб в производстве
- •4. Приемы подготовки проб к анализу
- •4.1. Подсушивание (высушивание)
- •4.2. Измельчение
- •4.2.1. Ступки
- •4.2.2. Терочные машины
- •4.2.3. Дисковые мельницы
- •4.2.4. Фрезерные измельчители
- •4.2.5. Комбинированные мельницы
- •4.2.6. Измельчители в жидкой среде
- •4.2.7. Выбор типа измельчительных устройств
- •4.3. Извлечение растворимых компонентов из твердых и пластичных материалов
- •4.3.1. Отжим
- •4.3.2. Извлечение растворителями
- •4.3.3. Специальные приемы извлечения растворимых компонентов
- •4.4. Разделение смеси различных веществ на компоненты
- •4.4.1. Простая перегонка
- •4.4.2. Ректификация
- •4.4.3. Молекулярная перегонка
- •4.4.4. Фракционирование кристаллизацией из растворов
- •5. Измерение кислотности и окислительно-восстановительного потенциала
- •5.1. Определение активной кислотности
- •5.2. Электрометрический метод определения рН
- •5.3. Определение рН при помощи рН-метра марки лпу-01
- •5.4. Колориметрический метод определения рН
- •Характеристика индикаторов для определения рН
- •5.5. Определение титруемой кислотности
- •5.5.1. Титрование с помощью индикаторов
- •5.5.2. Электрометрическое титрование
- •5.6. Определение окислительно-восстановительного потенциала
- •5.6.1. Электрометрический метод
- •5.6.2. Колориметрический метод
- •6. Рефрактометрия
- •6.1. Измерение показателя преломления
- •6.2. Измерения с помощью рефрактометров
- •6.3. Прецизионный рефрактометр
- •6.4. Погружаемый рефрактометр
- •7. Поляриметрия
- •7.1. Устройство поляриметров
- •Удельные вращения сахаров
- •7.2. Приготовление и осветление раствора анализируемого продукта
- •7.3. Методы поляриметрического определения
- •7.4. Определение крахмала методом Эверса
- •8. Колориметрия
- •8.1. Визуальные методы
- •8.2. Фотоэлектрический метод
- •Характеристика светофильтров спектрофотометров фэк-56
- •8.3. Люминесцентный анализ
- •8.3.1. Техника эксперимента и общие приемы анализа
- •8.3.2. Применение люминесцентного анализа в исследовании пищевых продуктов
- •8.4. Цвет и его измерение
- •8.4.1.Общие понятия и приемы измерения цвета
- •8.4.2. Методики определения цветности пищевых продуктов
- •Приготовление серии растворов йода
- •9. Хроматография
- •9.1. Адсорбционная молекулярная хроматография
- •9.2. Распределительная хроматография
- •9.2.1. Хроматография на бумаге
- •9.2.2. Хроматография на колонках
- •9.2.3. Газожидкостная хроматография
- •Характеристика неподвижной фазы
- •10. Электрофорез
- •11. Спектроскопия
- •11.1. Общие понятия и терминология
- •11.2. Эмиссионный спектральный анализ
- •11.3. Анализ элементов методом пламенной фотометрии
- •11.4. Анализ элементов в дуге
- •12. Молекулярный спектральный анализ
- •12.1. Общие сведения об электронных спектрах молекул
- •12.2. Приборы для регистрации электронных спектров поглощения и техника эксперимента
- •12.2.1. Ультрафиолетовая область
- •12.2.2. Видимая область
- •12.2.3. Использование инфракрасных спектров поглощения
- •12.3. Количественный анализ по спектрам поглощения в ультрафиолетовой, видимой и инфракрасной областях спектра
- •12.3.1. Анализ однокомпонентной смеси
- •12.3.2. Анализ двухкомпонентной смеси
- •13. Масс-спектРометрия
- •14. Спектроскопия электронного парамагнитного и ядерного магнитного резонанса
- •14.1. Электронный парамагнитный резонанс
- •14.2. Ядерный магнитный резонанс
- •Контрольные вопросы
- •Список рекомендуемой литературы
- •Содержание
- •Методы исследования свойств сырья и продуктов питания
11.2. Эмиссионный спектральный анализ
Спектры испускания атомов, так же как и их химические свойства, определяются строением наиболее удаленных от ядра электронных оболочек, т. е. свойствами наименее связанных с ядром внешних (валентных) электронов.
Испускание света атомами происходит за счет изменения внутриатомной энергии, обусловленной взаимным расположением ядра и окружающих его электронов. При этом атомы могут находиться только в определенных энергетических состояниях. Для атомов каждого элемента (точнее, для совокупности ядра, окруженного внутренними электронами, и каждого внешнего электрона) характерен свой набор дискретных значений энергии.
Атомы, находясь в нормальном состоянии (на нулевом энергетическом уровне Е0), не излучают. Для того чтобы вызвать излучение атома, его необходимо возбудить, т. е. перевести один из его внешних электронов на более высокий энергетический уровень Е. Длительность возбужденного состояния невелика (10–7…10–8 с), и электрон возвращается в исходное Е0 или промежуточное Е состояние с меньшей энергией. Энергия, равная разности значений энергии этих уровней, излучается в виде кванта с частотой
=
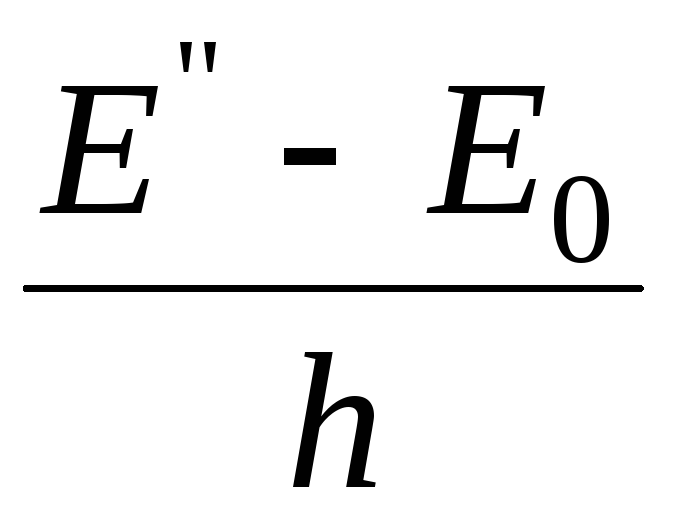 или =
или =

и соответствует одной спектральной линии.
Совокупность изменений всех возможных энергетических состояний множества атомов данного элемента составляет его спектр. О количестве возможных энергетических состояний атомов различных элементов можно судить по числу линий в их спектрах. Так, спектр железа в области 2100…6600 А состоит приблизительно из 4600 линий.
Энергия атома в нормальном состоянии условно принимается за нуль. Энергия возбужденных уровней (потенциал возбуждения) измеряется в электрон-вольтах (эв) или обратных сантиметрах (см–1)
1эВ = 1,60207 · 10–18 Дж = 23,05 ккал/моль = 8067,5 см–1.
Уровень, ближайший к нормальному, называют резонансным, а линию, соответствующую переходу с него на нормальный уровень, – резонансной линией данного элемента. Состояние с максимальной энергией возбуждения соответствует энергии ионизации (потенциалу ионизации) атома, т. е. энергии отрыва электрона от атома. При удалении из атома одного электрона заряд атомного остатка, а следовательно, и притяжение электронов возрастает. Поэтому для удаления последующего электрона из атома требуется большая энергия. При наличии нескольких электронов на внешней оболочке, имеющих разные энергии связи с ядром, имеется несколько значений соответствующих потенциалов ионизации. Так, потенциал ионизации нейтрального атома железа равен 7,86 эВ. Ионизационный атом железа будет иметь спектр, обусловленный совокупностью энергетических состояний второго валентного электрона с потенциалом его ионизации 16,24 эВ. Спектр двукратно ионизованного атома железа обусловлен состояниями третьего валентного электрона, имеющего потенциал ионизации 30,6 эВ.
Возбуждение атомов и ионов, т. е. перевод их в состояние с повышенной внутренней энергией, может быть проще всего осуществлено при соударении с быстро летящими частицами (электронами, ионами, атомами), обладающими большой кинетической энергией. Эти условия имеют место в таких источниках света, как электрическая дуга, высоковольтная искра, разрядная трубка, пламя и др., в которых вещество находится в состоянии плазмы и представляет собой смесь нейтральных (атомов и молекул) и заряженных (электронов, ионов) частиц.
Спектр дуги представляет собой в основном излучение нейтральных атомов, спектр искры – ионов. При возбуждении наиболее вероятным является переход на резонансный и близкие к нему уровни (термы). Поэтому в спектре излучения наиболее интенсивными являются линии, соответствующие переходам именно с этих термов. Эти линии, как правило, и выбираются в качестве аналитических, так как обеспечивают наибольшую чувствительность анализа. Однако интенсивность этих линий в спектрах различных элементов различна и тесно связана с особенностями строения электронных оболочек, характеризующих прочность связи внешних электронов с ядром. Чем менее прочна эта связь, тем ниже потенциал возбуждения, тем больше заполненность возбужденного уровня и выше вероятность излучения соответствующей линии, а следовательно, выше и чувствительность определения элемента.
В физике существуют специальные таблицы данных о чувствительности определения ряда элементов по некоторым аналитическим линиям при проведении качественного анализа.
Выбор источника возбуждения спектра зависит от свойств элемента. Так, источником возбуждения свечения элементов с низкими потенциалами возбуждения служит газовое пламя; для анализа газовых смесей пригодны газоразрядные трубки низкого давления, в которых свечение атомов инертных газов, водорода, кислорода, азота и других, имеющих высокие потенциалы возбуждения основных линий, вызывается столкновениями с электронами высокой энергии. Электрическая дуга является более распространенным источником возбуждения, так как она позволяет получить спектры почти всех элементов. Дуга широко применяется при анализе руд, минералов, порошкообразных проб и т. д. Высоковольтная конденсированная искра в основном применяется при количественном анализе металлов.
В исследовании пищевых продуктов интерес представляет эмиссионный анализ, как один из методов определения содержания в них микроэлементов.
Поставленная задача и специфика анализируемых образцов определяют выбор метода получения спектров. При определении содержания щелочных и щелочноземельных элементов используют метод пламенной фотометрии; при определении содержания тяжелых элементов – анализ порошкообразных проб (золы) в дуге между угольными электродами.
