
- •Тверской государственный технический университет
- •Е.А. Панкратов, н.Ю. Старовойтова
- •Химия и физика полимеров
- •Часть 1
- •Химия и физика полимеров
- •Часть I
- •Учебное пособие
- •170026, Г. Тверь, наб. А. Никитина, 22
- •Список условных сокращений
- •Введение в специальность
- •Основные понятия и определения
- •1.2. Молекулярная масса и молекулярно-массовое распределение
- •1.3. Важнейшие свойства полимерных веществ
- •1.4. Классификация полимеров
- •1.5. Номенклатура полимеров
- •Основные принципы номенклатуры регулярных линейных однотяжных органических полимеров
- •Основные принципы номенклатуры сополимеров
- •2. Синтез полимеров: поликонденсация
- •Основы теории поликонденсации
- •Характеристика процесса
- •Функциональность мономера
- •Классификация поликонденсационных процессов
- •Гомо- и гетерополиконденсация
- •Типы химических реакций, используемых при поликонденсации
- •И типы полимеров, образующихся при поликонденсации
- •Возможность образования низкомолекулярных гетероциклических соединений при поликонденсации
- •Равновесная поликонденсация
- •Особенности равновесной поликонденсации
- •Начало роста цепи
- •Процесс роста цепи
- •Остановка роста цепи
- •1. Наличие в системе выделяющегося низкомолекулярного продукта реакции и установление равновесия между прямой и обратной реакциями.
- •Механизмы реакций равновесной поликонденсации
- •Кинетика равновесной поликонденсации
- •Неравновесная поликонденсация
- •Особенности неравновесной поликонденсации
- •Кинетика неравновесной поликонденсации
- •Способы проведения поликонденсации
- •Поликонденсация в твердой фазе, расплаве, растворе
- •Поликонденсация в эмульсии
- •Межфазная поликонденсация
- •Трехмерная поликонденсация
- •Совместная поликонденсация
- •3. Синтез полимеров: полимеризация
- •3.1. Основы теории полимеризации
- •Характеристика процесса
- •Цепные и ступенчатые реакции полимеризации
- •Термодинамика полимеризации
- •Миграционная полимеризация
- •3.3. Радикальная полимеризация
- •3.3.1. Характеристика радикальных процессов
- •Мономеры
- •Инициирование
- •Рост цепи
- •Обрыв цепи
- •Кинетический анализ радикальной полимеризации Вывод общего кинетического уравнения радикальной полимеризации
- •Типичная кинетическая кривая радикальной полимеризации
- •Ингибиторы и замедлители радикальной полимеризации
- •Влияние различных факторов на скорость полимеризации и молекулярную массу полимера
- •Методы проведения полимеризации
- •Полимеризация в массе мономера
- •Полимеризация в растворителе
- •Полимеризация в суспензии
- •Эмульсионная полимеризация
- •Радикальная сополимеризация
- •Характеристика процесса
- •Уравнение состава сополимера
- •Константы сополимеризации, их физический смысл
- •Ионная полимеризация
- •Характеристика ионных процессов
- •Активные центры ионной полимеризации
- •Катионная полимеризация
- •Инициаторы катионной полимеризации
- •Реакционная способность мономеров
- •Механизм катионной полимеризации
- •Анионная полимеризация
- •Механизм действия анионных инициаторов. В зависимости от типа взаимодействий можно выделить 2 механизма инициирования анионной поликонденсации.
- •Ионно-координационная полимеризация
- •Алфиновые катализаторы
- •Катализаторы Циглера-Натта
- •Оксидные катализаторы
- •Ионная сополимеризация
- •4. Химические превращения
- •Особенности химических реакций полимеров
- •Полимераналогичные превращения
- •Реакции, приводящие к увеличению молекулярной массы
- •Реакции, приводящие к уменьшению молекулярной массы
- •Старение полимеров
- •Библиографический список
2. Синтез полимеров: поликонденсация
Основы теории поликонденсации
Характеристика процесса
Поликонденсация – процесс образования ВМС, при котором рост полимерных цепей происходит путем химического взаимодействия функциональных групп как исходных мономеров, так и макромолекул, получающихся в ходе реакции, и сопровождается выделением низкомолекулярного побочного продукта.
Схематически химизм процесса поликонденсации можно изобразить следующим образом:
a(Mi)a + b(Mj)b → a(Mi+j)b +ab
или
a(Mi)b + a(Mj)b → a(Mi+j)b +ab,
где Mi , Mj , Mi+j – соответственно i, j –меры (i, j – любые целые числа, начиная с 1; например, если i = 1, то Mi = M1, т.е. это мономер); а и b – молекулярные фрагменты, отщепляемые в ходе реакции.
Отличительные особенности поликонденсации:
процесс поликонденсации – ступенчатый; рост цепи происходит в результате взаимодействия молекул мономера друг с другом, с промежуточными продуктами – олигомерами или полимерными молекулами – и взаимодействия олигомерных и полимерных макромолекул между собой; при этом в каждом элементарном акте роста цепи происходит гибель реакционных центров взаимодействующих молекул с выделением простейших низкомолекулярных соединений (воды, аммиака, углекислого газа, хлороводорода и др.), поэтому элементный состав полимера отличается от элементного состава исходных веществ;
в качестве мономеров могут использоваться только соединения, содержащие не менее двух реакционных центров (реакционный центр – часть молекулы, которая принимает участие в химической реакции и претерпевает изменения);
после начала поликонденсации почти сразу исчезают мономеры: образуются небольшие олигомерные молекулы, которые затем реагируют между собой;
молекулярная масса и выход полимера зависят от продолжительности реакции;
ВМС образуется, как правило, только при практически полном завершении реакции (при степени завершенности более 0,98).
Степень завершенности реакции определяется отношением функциональных групп, вступивших в реакцию, к числу исходных функциональных групп.
Степень завершенности реакции определяется уравнением
![]() ,
(6)
,
(6)
где
![]() - исходная концентрация функциональных
групп; c
– текущая концентрация, т.е. концентрация
свободных непрореагировавших
функциональных групп на момент
определения степени завершенности
реакции
- исходная концентрация функциональных
групп; c
– текущая концентрация, т.е. концентрация
свободных непрореагировавших
функциональных групп на момент
определения степени завершенности
реакции
![]() .
.
Перепишем уравнение (6) в виде
![]() ,
(7)
,
(7)
где
![]() – величина, обратная средней степени
полимеризации
– величина, обратная средней степени
полимеризации
![]() .
.
Тогда выражение (7) можно преобразовать
![]() .
.
Отсюда
![]() (8)
(8)
Выражение (8) называется уравнением Карозерса.
Функциональность мономера
Функциональность
мономера
![]() определяется
числом его реакционных центров
(функциональных групп, способных
участвовать в процессе поликонденсации).
определяется
числом его реакционных центров
(функциональных групп, способных
участвовать в процессе поликонденсации).
При конденсации монофункциональных соединений образуются только низкомолекулярные продукты, т.к. при таком взаимодействии образуются вещества, лишенные свободных функциональных групп.
Пример. Получение этилацетата из этилового спирта и уксусной кислоты:
С2Н5ОН
+ СН3СООН
![]() СН3СООС2Н5
+ Н2О
СН3СООС2Н5
+ Н2О
При конденсации бифункциональных соединений образуются линейные полимеры, т.к. в каждом акте взаимодействия образуется соединение, имеющее на концах функциональные группы, следовательно, способное к дальнейшему взаимодействию.
Бифункциональные мономеры, вступающие в поликонденсацию, могут иметь группы одинакового строения (гомофункциональная поликонденсация) или различного (гетерофункциональная поликонденсация).
Пример гомофункциональной поликонденсации. Синтез простых полиэфиров из гликолей:
nНО-R-OH + nHO-R′-OH H-[-O-R-O- R′-]n-OH + (2n-1)H2O
Пример гетерофункциональной поликонденсации. Взаимодействие этиленгликоля и терефталевой кислоты. Процесс протекает постадийно. На первой стадии происходит образование димера:
HOOCC6H4COOH + HOCH2CH2OH HOOC-C6H4-COOCH2CH2OH + Н2О
На второй стадии происходит образование более высокомолекулярных продуктов:
HOOC-C6H4-COO(CH2)2OH + HOOC-C6H4-COO(CH2)2OH →
HOOC-C6H4-COO(CH2)2OOC-C6H4-COO(CH2)2OH + Н2О и т.д.
В бифункциональной поликонденсации могут участвовать молекулы, содержащие в одной молекуле функциональные группы различного строения. Например, конденсация аминокислот с образованием полиамидов:
nН2N-R-COOH H-[-HN-R-CO-]n-OH + (n-1)H2O
Принцип эквивалентности: для бифункционального реагента реакционная способность двух функциональных групп одинакова и не меняется в течение всего процесса.
Принцип Флори: реакционная способность функциональной группы не зависит от размера молекулы, к которой она относится.
Для большинства процессов поликонденсации экспериментально установлено, что принцип Флори соблюдается при степени полимеризации n510.
При конденсации три- и тетрафункциональных соединений, а также их смесей с бифункциональными соединениями образуются разветвленные или трехмерные продукты. Такая поликонденсация называется трехмерной. При этом обычно первой стадией реакции является образование олигомеров линейного и разветвленного строения, способных при углублении процесса переходить в сшитые трехмерные структуры.
Пример. Поликонденсация глицерина с терефталевой кислотой протекает по схеме:
- образование димера
HOOC-C6H4-COOH + HOCH2-CHOH-CH2OH
HOOC-C6H4-COOCH2-CHOH-CH2-OH + Н2О
- образование разветвленных продуктов
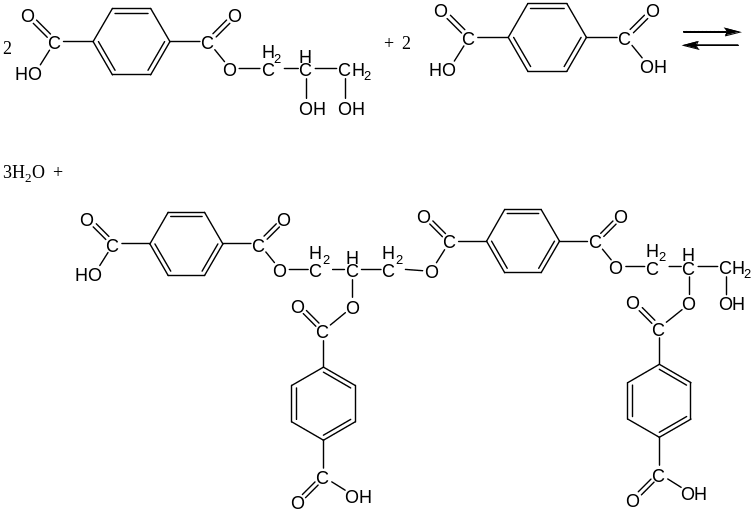
- образование трехмерных структур из разветвленных продуктов
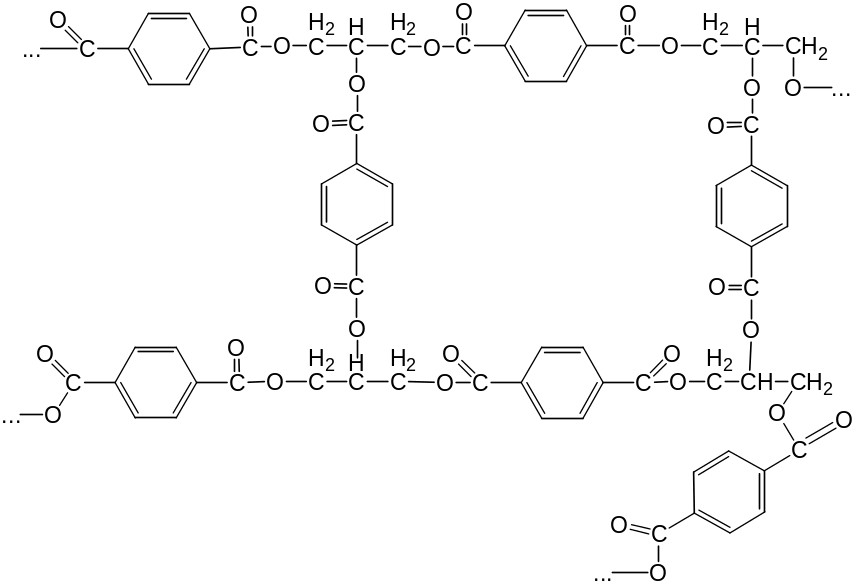
При поликонденсации важное значение имеет средняя функциональность системы
![]() ,
(9)
,
(9)
где
![]() -
функциональность (количество
функциональных групп) в молекулах
исходного мономера i;
-
функциональность (количество
функциональных групп) в молекулах
исходного мономера i;
![]() – число моль мономера i
с функциональностью
.
– число моль мономера i
с функциональностью
.
Пример. При
конденсации этиленгликоля и терефталевой
кислоты образуются полимеры линейного
строения: у этиленгликоля f
= 2, у
терефталевой кислоты f
= 2,
![]() .
.
При конденсации
глицерина (f
= 3) и фталевой
кислоты (f
= 2) образуются
трехмерные полимеры:
![]() .
.
Приведенное уравнение (9) справедливо только в случае стехиометрического соотношения компонентов (функциональных групп). Если же один из компонентов находится в избытке, то средняя функциональность равна удвоенной функциональности вещества, содержащегося в меньшем количестве, к общему числу всех молекул:
![]() ,
(10)
,
(10)
где NA – количество молей мономера, находящегося в недостатке; NB – количество молей мономера, находящегося в избытке.
Пример. Реакция
между одним молем глицерина (f
= 3) и пятью
молями фталевой кислоты (f
= 2):
![]() ,
т.е. образуется очень низкомолекулярный
продукт, причем процесс заканчивается
значительно раньше, чем прореагирует
основное количество функциональных
групп.
,
т.е. образуется очень низкомолекулярный
продукт, причем процесс заканчивается
значительно раньше, чем прореагирует
основное количество функциональных
групп.
Вывод
Если
![]() =1,
поликонденсации не происходит, образуются
только низкомолекулярные вещества;
если
=1,
поликонденсации не происходит, образуются
только низкомолекулярные вещества;
если
![]() ,
образуются линейные или разветвленные
полимеры; если
,
образуются линейные или разветвленные
полимеры; если
![]() >2,
образуются трехмерные сшитые полимеры.
>2,
образуются трехмерные сшитые полимеры.
В процессе поликонденсации не всегда создаются возможности для реализации полной функциональности, заложенной в исходных соединениях. Поэтому различают теоретическую функциональность (максимально возможную согласно формуле соединения) и практическую функциональность (зависящую от условий реакции).
Пример. Теоретическая
функциональность системы
глицерин-терефталевая кислота
![]() ;
;
при T>180ºC
![]() образуются
трехмерные структуры;
образуются
трехмерные структуры;
при T<180ºC
![]() –
линейные полимеры.
–
линейные полимеры.
Относительная функциональность мономеров (В.В. Коршак) – отношение теоретической функциональности к практической. Причины уменьшения практической функциональности по сравнению с теоретической:
влияние условий проведения процесса на реакционную способность функциональных групп;
возможность образования циклов;
возможность химических изменений функциональных групп в процессе реакции.
