
- •Тверской государственный технический университет
- •Е.А. Панкратов, н.Ю. Старовойтова
- •Химия и физика полимеров
- •Часть 1
- •Химия и физика полимеров
- •Часть I
- •Учебное пособие
- •170026, Г. Тверь, наб. А. Никитина, 22
- •Список условных сокращений
- •Введение в специальность
- •Основные понятия и определения
- •1.2. Молекулярная масса и молекулярно-массовое распределение
- •1.3. Важнейшие свойства полимерных веществ
- •1.4. Классификация полимеров
- •1.5. Номенклатура полимеров
- •Основные принципы номенклатуры регулярных линейных однотяжных органических полимеров
- •Основные принципы номенклатуры сополимеров
- •2. Синтез полимеров: поликонденсация
- •Основы теории поликонденсации
- •Характеристика процесса
- •Функциональность мономера
- •Классификация поликонденсационных процессов
- •Гомо- и гетерополиконденсация
- •Типы химических реакций, используемых при поликонденсации
- •И типы полимеров, образующихся при поликонденсации
- •Возможность образования низкомолекулярных гетероциклических соединений при поликонденсации
- •Равновесная поликонденсация
- •Особенности равновесной поликонденсации
- •Начало роста цепи
- •Процесс роста цепи
- •Остановка роста цепи
- •1. Наличие в системе выделяющегося низкомолекулярного продукта реакции и установление равновесия между прямой и обратной реакциями.
- •Механизмы реакций равновесной поликонденсации
- •Кинетика равновесной поликонденсации
- •Неравновесная поликонденсация
- •Особенности неравновесной поликонденсации
- •Кинетика неравновесной поликонденсации
- •Способы проведения поликонденсации
- •Поликонденсация в твердой фазе, расплаве, растворе
- •Поликонденсация в эмульсии
- •Межфазная поликонденсация
- •Трехмерная поликонденсация
- •Совместная поликонденсация
- •3. Синтез полимеров: полимеризация
- •3.1. Основы теории полимеризации
- •Характеристика процесса
- •Цепные и ступенчатые реакции полимеризации
- •Термодинамика полимеризации
- •Миграционная полимеризация
- •3.3. Радикальная полимеризация
- •3.3.1. Характеристика радикальных процессов
- •Мономеры
- •Инициирование
- •Рост цепи
- •Обрыв цепи
- •Кинетический анализ радикальной полимеризации Вывод общего кинетического уравнения радикальной полимеризации
- •Типичная кинетическая кривая радикальной полимеризации
- •Ингибиторы и замедлители радикальной полимеризации
- •Влияние различных факторов на скорость полимеризации и молекулярную массу полимера
- •Методы проведения полимеризации
- •Полимеризация в массе мономера
- •Полимеризация в растворителе
- •Полимеризация в суспензии
- •Эмульсионная полимеризация
- •Радикальная сополимеризация
- •Характеристика процесса
- •Уравнение состава сополимера
- •Константы сополимеризации, их физический смысл
- •Ионная полимеризация
- •Характеристика ионных процессов
- •Активные центры ионной полимеризации
- •Катионная полимеризация
- •Инициаторы катионной полимеризации
- •Реакционная способность мономеров
- •Механизм катионной полимеризации
- •Анионная полимеризация
- •Механизм действия анионных инициаторов. В зависимости от типа взаимодействий можно выделить 2 механизма инициирования анионной поликонденсации.
- •Ионно-координационная полимеризация
- •Алфиновые катализаторы
- •Катализаторы Циглера-Натта
- •Оксидные катализаторы
- •Ионная сополимеризация
- •4. Химические превращения
- •Особенности химических реакций полимеров
- •Полимераналогичные превращения
- •Реакции, приводящие к увеличению молекулярной массы
- •Реакции, приводящие к уменьшению молекулярной массы
- •Старение полимеров
- •Библиографический список
Мономеры
В радикальной ПМ обычно участвуют мономеры – производные этилена с различными заместителями у двойной связи. Природа заместителя оказывает существенное влияние на реакционную способность мономера и образующегося радикала (рис. 5).

Рис. 5. Эффекты, вызываемые заместителем у двойной связи
Эффект сопряжения приводит к смещению -электронов двойной связи в сторону заместителя. Из-за смещения уменьшается степень взаимного перекрывания -облаков. Благодаря этому снижаются энергетические затраты на поляризацию двойной связи, облегчается ее раскрытие. Как следствие, возрастает реакционная способность мономера.
Пример. Сопряжение характерно для таких мономеров, как стирол и бутадиен:

Индукционный эффект приводит к поляризации двойной связи и возникает в результате смещения электронной плотности в сторону двойной связи или в сторону заместителя. В первом случае считается, что заместитель оказывает положительный (+I) индукционный эффект; во втором случае - отрицательный (-I) (табл. 9).
Положительный индукционный эффект (+I) проявляют заместители-доноры электронов. В результате появляется избыточная электронная плотность на атоме углерода, не связанном с заместителем.
Отрицательный индукционный эффект (-I) проявляют заместители-акцепторы электронов. В результате появляется избыточная электронная плотность на атоме углерода, связанном с заместителем.
Таблица 9. Положительный и отрицательный индукционные
эффекты, общая характеристика
Вид индукционного эффекта |
+I |
-I |
Причина |
Заместители-доноры электронов |
Заместители-акцепторы электронов |
Место расположения избыточной электронной плотности |
Атом углерода, не связанный с заместителем |
Атом углерода, связанный с заместителем |
Схема эффекта |
СН2=СНХ |
СН2=СНХ |
Пример |
СН2=СНСН3 |
СН2=СНCl |
Влияние на реакционную способность мономера |
Увеличивает |
|
Стерические эффекты вызываются пространственным влиянием заместителей. Объемные заместители экранируют двойную связь, что приводит к снижению реакционной способности мономера.
Чем больше заместителей у одного углеродного атома и чем они объемнее, тем ниже реакционная способность мономера.
Существует правило антибатности реакционной способности мономеров и радикалов: чем активнее мономер, тем менее активен образующийся из него радикал. Повышение реакционной способности мономеров вследствие влияния заместителей сопровождается снижением реакционной способности образующихся радикалов.
Инициирование
Инициирование описывается двумя последовательными реакциями:
разложение инициатора (I) с образованием свободных радикалов (R):
![]() ;
;
взаимодействие радикала с мономером (М) с образованием активного центра свободнорадикального типа:
![]() ,
,
где
![]() и
и
![]() - константы скоростей соответствующих
реакций.
- константы скоростей соответствующих
реакций.
Скорости
реакций
![]() и
и
![]() подчиняются уравнениям
подчиняются уравнениям
![]()
![]() .
.
В большинстве случаев реакция разложения инициатора протекает значительно медленнее, чем реакция взаимодействия свободного радикала с мономером, т.е. << . Тогда второй реакцией можно пренебречь, считая, что лимитирующей стадией инициирования является стадия разложения инициатора. Так как не все образующиеся при этом радикалы участвуют в реакции взаимодействия с мономером, а некоторая часть их расходуется на соединение друг с другом («эффект клетки» - см. ниже), взаимодействие с примесями и т.д., следует учитывать величину эффективности инициирования f.
«Эффект клетки». При диссоциации инициатора в жидкой среде образовавшаяся пара радикалов оказывается как бы в «клетке», состоящей из молекул мономера и (или) растворителя, окружающих пару со всех сторон. В такой «клетке» радикалы находятся 10-10с. В течение этого времени они находятся в непосредственной близости друг от друга и могут рекомбинировать. Подобное явление называется первичной рекомбинацией или клеточным эффектом (эффект Франка-Рабиновича) и может приводить к образованию исходной молекулы инициатора или других продуктов нерадикальной природы.
Эффективность инициирования – отношение количества радикалов, вступивших во взаимодействие с мономером, к общему числу образовавшихся радикалов.
С учетом эффективности инициирования уравнение скорости реакции инициирования примет вид
![]() .
.
Инициирование радикальной полимеризации возможно несколькими способами. Различают термическое, фото-, радиационное и химическое инициирование.
Термическое инициирование – процесс образования свободных радикалов из молекул мономера только под действием тепла.
В чистом виде термическое инициирование встречается редко, сопровождается побочными процессами. В наибольшей степени исследовано термическое инициирование стирола и метилметакрилата.
Пример. Термическое инициирование полимеризации стирола.
Двухступенчатый процесс.
Первая стадия – обратимое бимолекулярное образование бирадикала:

Вторая стадия – быстрая реакция передачи на мономер:

Термическое инициирование характеризуется высоким значением энергии активации, низкой скоростью, сильно зависящей от температуры.
Фотоинициирование – процесс образования свободных радикалов из мономерных молекул под действием света.
Молекула мономера, поглотившая квант света, переходит в возбужденное состояние, после чего может распасться на радикалы либо отщепить электрон.
Существуют 2 вида фотоинициирования – с добавлением сенсибилизаторов и без. Сенсибилизаторы, или фотоинициаторы – специальные вещества, легко распадающиеся на свободные радикалы.
Без добавления сенсибилизаторов фотоинициирование возможно для мономеров, имеющих основную полосу поглощения в ультрафиолетовой области. Примеры: стирол и его производные, метилметакрилат.
При фотоинициированной полимеризации стирола (ртутно-кварцевая лампа, 300нм) первичные радикалы образуются в результате переноса атома водорода от возбужденной молекулы мономера к молекуле в основном состоянии:

Возможен также распад молекулы мономера на следующие радикалы:

Эффективность фотоинициирования зависит от длины волны УФ-излучения, строения мономера, наличия растворителей и т.д.
Реакции фотоинициирования характеризуются очень низкими энергиями активации, поэтому скорость фотоинициирования практически не зависит от температуры. В то же время с повышением температуры значительно ускоряются реакции роста цепи, поэтому при фотоинициированной полимеризации с повышением температуры процесса возрастает молекулярная масса получаемого полимера. Этим фотополимеризация резко отличается от всех других реакций радикальной полимеризации.
Скорость фотополимеризации пропорциональна корню квадратному из интенсивности облучения.
Фотоинициированная полимеризация продолжается некоторое время и после удаления источника света (так называемый темновой период, или пост-эффект). Это объясняется малой подвижностью макрорадикалов в вязкой среде (раствор ПМ в мономере), приводящей к уменьшению скорости реакции обрыва и увеличению продолжительности существования радикалов.
Радиационное инициирование – процесс образования свободных радикалов под действием ионизирующего излучения, которое характеризуется более высокими энергиями, чем УФ.
При действии электромагнитного излучения (-кванты, Х-лучи) или потока частиц (электроны или -частицы, нейтроны, -частицы) происходит возбуждение молекулы мономера с последующей ионизацией, сопровождающейся выбросом электрона:
![]()
При дальнейшей диссоциации катиона может образоваться радикал
![]()
Выброшенный электрон может присоединяться к катиону с образованием другого радикала:
![]()
или к мономеру с образованием аниона и радикала
![]()
![]()
При радиационном инициировании наличие трех типов активных центров (радикал, катион и анион) предопределяет возможность трех типов полимеризации (радикальной, катионной и анионной).
Достоинства радиационного инициирования – высокая чистота образующихся полимеров; возможность проведения реакции при обычных и низких температурах; возможно для любых мономеров, способных к полимеризации.
Чаще всего применяются установки с источником -излучения Со60.
Химическое инициирование – процесс образования свободных радикалов путем термического или фотохимического распада различных соединений, содержащих лабильные связи, или при окислительно-восстановительных реакциях.
Инициаторы – вещества, легко образующие свободные радикалы в результате гомолитического разрыва лабильных связей.
Наиболее распространенные группы инициаторов - пероксиды. Они характеризуются наличием лабильной связи –О-О-, энергия диссоциации которой для большинства перекисей составляет 125-170 кДж/моль. В общем случае гомолитический распад пероксидов протекает по схеме
![]()
Рассмотрим несколько групп химических инициаторов.
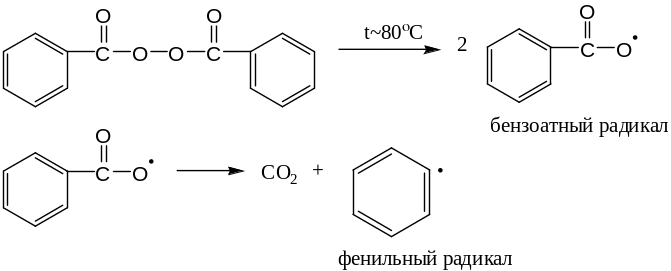
Диацильные пероксиды. Распадаются при t=50100С. Их эффективность определяется строением и возрастает с увеличением длины углеводородных радикалов. Среди соединений этого типа наиболее распространенными являются пероксид бензоила и пероксид ацетила. Распад пероксида бензоила протекает по схеме
Диалкильные пероксиды разлагаются с образованием алкоксидных радикалов, которые при более высокой температуре способны отщеплять алкильный радикал. Трет-бутилпероксид разлагается по схеме

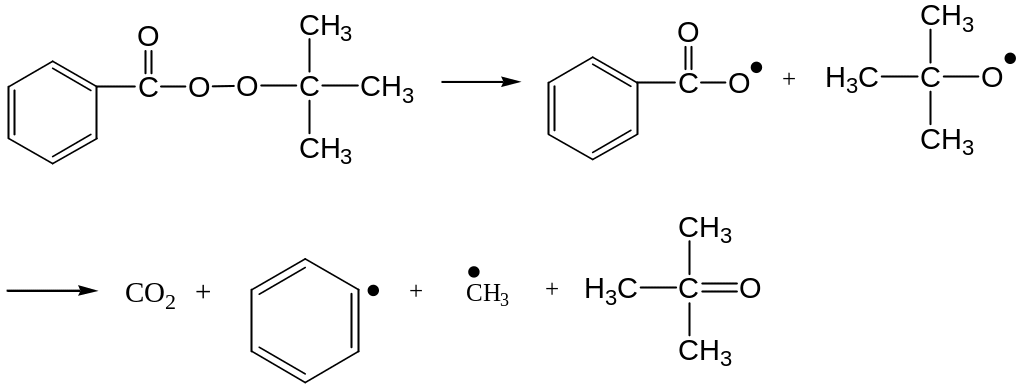
Инициатор при разложении может образовывать радикалы нескольких типов, например, трет-бутилпербензоат разлагается по схеме
Гидропероксиды разлагаются с образованием алкоксидных и гидроксидных радикалов. Гидропероксид изопропилбензола (кумола) разлагается по схеме

Неорганические пероксиды используются обычно для инициирования полимеризации в водных средах. Пероксид водорода образует при разложении гидроксидные радикалы
Н2О2![]() 2НО
2НО
Персульфаты калия, натрия, аммония также способны вызывать образование гидроксидных радикалов в водной среде по схеме

Пероксидные и гидропероксидные соединения могут являться компонентами окислительно-восстановительных инициирующих систем (Red-Ox систем). При этом существенно снижается температура свободнорадикального разложения, повышается скорость реакции, становится возможным осуществление процесса при комнатной температуре. Введение небольшого количества восстановителя (промотора) значительно повышает скорость распада инициатора.
По количеству свободных радикалов, образующихся в результате окислительно-восстановительного процесса, Red-Ox системы делят на три типа: I – один радикал; II – два радикала; III – свободные радикалы не образуются.
В окислительно-восстановительных системах в качестве окислителей используются пероксиды, гидропероксиды, хлораты, хроматы и др.; в качестве восстановителей – соли металлов переменной валентности в низшей степени окисления. Оптимальным является эквимольное соотношение компонентов.
Пример. Система «пероксид водорода – соль железа (II)» (реактив Фентона). Инициирует полимеризацию по схеме
Fe2+ + H2O2 Fe3+ + HO + HO
Реактив Фентона инициирует полимеризацию виниловых мономеров в водных растворах и эмульсиях при 20С.
Аналогично протекает распад гидропероксидов общей формулы ROOH под влиянием солей Fe(II):
ROOH + Fe2+ RO + HO + Fe3+
Рассмотрим механизм инициирования на примере системы «пероксид – стирол»:

