
- •Тверской государственный технический университет
- •Е.А. Панкратов, н.Ю. Старовойтова
- •Химия и физика полимеров
- •Часть 1
- •Химия и физика полимеров
- •Часть I
- •Учебное пособие
- •170026, Г. Тверь, наб. А. Никитина, 22
- •Список условных сокращений
- •Введение в специальность
- •Основные понятия и определения
- •1.2. Молекулярная масса и молекулярно-массовое распределение
- •1.3. Важнейшие свойства полимерных веществ
- •1.4. Классификация полимеров
- •1.5. Номенклатура полимеров
- •Основные принципы номенклатуры регулярных линейных однотяжных органических полимеров
- •Основные принципы номенклатуры сополимеров
- •2. Синтез полимеров: поликонденсация
- •Основы теории поликонденсации
- •Характеристика процесса
- •Функциональность мономера
- •Классификация поликонденсационных процессов
- •Гомо- и гетерополиконденсация
- •Типы химических реакций, используемых при поликонденсации
- •И типы полимеров, образующихся при поликонденсации
- •Возможность образования низкомолекулярных гетероциклических соединений при поликонденсации
- •Равновесная поликонденсация
- •Особенности равновесной поликонденсации
- •Начало роста цепи
- •Процесс роста цепи
- •Остановка роста цепи
- •1. Наличие в системе выделяющегося низкомолекулярного продукта реакции и установление равновесия между прямой и обратной реакциями.
- •Механизмы реакций равновесной поликонденсации
- •Кинетика равновесной поликонденсации
- •Неравновесная поликонденсация
- •Особенности неравновесной поликонденсации
- •Кинетика неравновесной поликонденсации
- •Способы проведения поликонденсации
- •Поликонденсация в твердой фазе, расплаве, растворе
- •Поликонденсация в эмульсии
- •Межфазная поликонденсация
- •Трехмерная поликонденсация
- •Совместная поликонденсация
- •3. Синтез полимеров: полимеризация
- •3.1. Основы теории полимеризации
- •Характеристика процесса
- •Цепные и ступенчатые реакции полимеризации
- •Термодинамика полимеризации
- •Миграционная полимеризация
- •3.3. Радикальная полимеризация
- •3.3.1. Характеристика радикальных процессов
- •Мономеры
- •Инициирование
- •Рост цепи
- •Обрыв цепи
- •Кинетический анализ радикальной полимеризации Вывод общего кинетического уравнения радикальной полимеризации
- •Типичная кинетическая кривая радикальной полимеризации
- •Ингибиторы и замедлители радикальной полимеризации
- •Влияние различных факторов на скорость полимеризации и молекулярную массу полимера
- •Методы проведения полимеризации
- •Полимеризация в массе мономера
- •Полимеризация в растворителе
- •Полимеризация в суспензии
- •Эмульсионная полимеризация
- •Радикальная сополимеризация
- •Характеристика процесса
- •Уравнение состава сополимера
- •Константы сополимеризации, их физический смысл
- •Ионная полимеризация
- •Характеристика ионных процессов
- •Активные центры ионной полимеризации
- •Катионная полимеризация
- •Инициаторы катионной полимеризации
- •Реакционная способность мономеров
- •Механизм катионной полимеризации
- •Анионная полимеризация
- •Механизм действия анионных инициаторов. В зависимости от типа взаимодействий можно выделить 2 механизма инициирования анионной поликонденсации.
- •Ионно-координационная полимеризация
- •Алфиновые катализаторы
- •Катализаторы Циглера-Натта
- •Оксидные катализаторы
- •Ионная сополимеризация
- •4. Химические превращения
- •Особенности химических реакций полимеров
- •Полимераналогичные превращения
- •Реакции, приводящие к увеличению молекулярной массы
- •Реакции, приводящие к уменьшению молекулярной массы
- •Старение полимеров
- •Библиографический список
Механизмы реакций равновесной поликонденсации
Приведем два примера реакций равновесной поликонденсации с рассмотрением механизмов реакций.
Полиэтерификация протекает по ионному механизму, катализируется протонами. Источники протонов – специально добавленная кислота (катализатор) или мономер (дикарбоновая кислота).
Реакция идет по стадиям:
1) протонирование карбоновой кислоты:
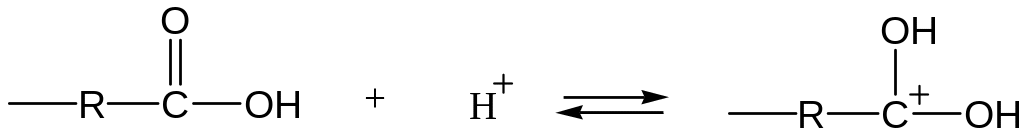
2) взаимодействие протонированной формы (иона карбония) со спиртом:

3) образование сложного эфира и регенерация протона:

Все стадии этой реакции являются обратимыми, равновесными. Обратные реакции также катализируются протонами.
Разложение образовавшегося сложного эфира может происходить по механизму гидролиза, ацидолиза, алкоголиза. Он катализируется протонами и протекает по стадиям:
1) протонирование сложного эфира:

2) взаимодействие протонированной формы с водой:

3) образование спирта, кислоты и регенерация протона:

Наличие или отсутствие катализатора не влияет на скорость процесса, т.е. на скорость достижения состояния равновесия.
Полиамидирование носит ионный характер и катализируется протонами, протекает по тем же стадиям, что и полиэтерификация. Различие в том, что процесс полиамидирования начинается с протонирования аминогруппы исходного мономера и взаимодействия образовавшегося аммонийного катиона с карбоксильной группой. Рассмотрим стадии процесса:
1) образование иона карбония:
![]()

2) взаимодействие иона карбония с амином:

3) образование амидной группы с выделением воды и протона:

Образовавшиеся полиамиды могут подвергаться гидролизу под действием воды, водных растворов кислот и щелочей. Скорость обратной реакции значительно увеличивается при повышении температуры. Механизм обратных реакций аналогичен представленному для полиэфиров.
Кинетика равновесной поликонденсации
Опишем кинетику равновесной поликонденсации на примере бимолекулярной реакции дикарбоновых кислот и диолов с учетом независимости скорости процесса от длины цепи макромолекулы.
В отсутствие добавок катализаторов (сильных кислот) равновесная ПК может считаться самокатализируемой реакцией (роль катализатора выполняет исходная карбоновая кислота). В этом случае скорость реакции определяется по скорости исчезновения карбоксильных групп и описывается простым кинетическим уравнением:
![]() ,
(18)
,
(18)
где
[COOH],
[OH]
– концентрации карбоксильных и
гидроксильных групп соответственно;
![]() – константа скорости реакции ПК.
– константа скорости реакции ПК.
Концентрация карбоксильных групп входит в уравнение дважды, поскольку эти группы являются одновременно и реагирующими группами, и источниками протонов.
При эквимолярном соотношении исходных веществ [COOH]=[OH]=С. Тогда после подстановки в (18) имеем
![]() (19)
(19)
или, разделяя переменные,
![]() .
(20)
.
(20)
Пусть С0 – начальная концентрация функциональных групп (гидроксильных или карбоксильных), а С – концентрация функциональных групп в данный момент времени, тогда, проинтегрировав выражение (20) в пределах от С0 до С и от 0 до , получим
![]() .
(21)
.
(21)
В уравнение (21)
введем параметр p
(степень завершенности реакции) (формула
(6)). Допустим, что ко времени
степень завершенности реакции равна
р,
т.е. прореагировала определенная доля
функциональных групп, тогда концентрация
функциональных групп С
в данный момент времени
равна
![]() .
Тогда после подстановки в уравнение
(21) имеем
.
Тогда после подстановки в уравнение
(21) имеем
![]() .
(22)
.
(22)
Следовательно, степень завершенности реакции поликонденсации (и степень полимеризации) пропорциональна продолжительности реакции и начальной концентрации функциональных групп.
Из уравнения (22)
видно, что отношение
![]() является линейной функцией времени.
Исходя из уравнения Карозерса (8), можно
записать, что
является линейной функцией времени.
Исходя из уравнения Карозерса (8), можно
записать, что
![]() .
На рис. 4 показана зависимость
.
На рис. 4 показана зависимость![]() от времени для различных температур.
Здесь Т1>T2>T3>T4.
от времени для различных температур.
Здесь Т1>T2>T3>T4.
Если реакция проводится в присутствии катализатора (сильной кислоты), то уравнение скорости ПК (18) принимает вид
![]() ,
(23)
,
(23)
где [Kt] – концентрация катализатора. Преобразуя уравнение (23), имеем:
![]() .
(24)
.
(24)
Поскольку концентрация катализатора [Kt] = const, то после интегрирования (24) и подстановки С=С0(1-р) имеем
![]() .
(25)
.
(25)
О чевидно,
что при применении катализаторов (25),
так же, как и в отсутствие их (22), степень
завершенности реакции пропорциональна
продолжительности процесса и начальной
концентрации функциональных групп.
чевидно,
что при применении катализаторов (25),
так же, как и в отсутствие их (22), степень
завершенности реакции пропорциональна
продолжительности процесса и начальной
концентрации функциональных групп.
