
- •Тверской государственный технический университет
- •Е.А. Панкратов, н.Ю. Старовойтова
- •Химия и физика полимеров
- •Часть 1
- •Химия и физика полимеров
- •Часть I
- •Учебное пособие
- •170026, Г. Тверь, наб. А. Никитина, 22
- •Список условных сокращений
- •Введение в специальность
- •Основные понятия и определения
- •1.2. Молекулярная масса и молекулярно-массовое распределение
- •1.3. Важнейшие свойства полимерных веществ
- •1.4. Классификация полимеров
- •1.5. Номенклатура полимеров
- •Основные принципы номенклатуры регулярных линейных однотяжных органических полимеров
- •Основные принципы номенклатуры сополимеров
- •2. Синтез полимеров: поликонденсация
- •Основы теории поликонденсации
- •Характеристика процесса
- •Функциональность мономера
- •Классификация поликонденсационных процессов
- •Гомо- и гетерополиконденсация
- •Типы химических реакций, используемых при поликонденсации
- •И типы полимеров, образующихся при поликонденсации
- •Возможность образования низкомолекулярных гетероциклических соединений при поликонденсации
- •Равновесная поликонденсация
- •Особенности равновесной поликонденсации
- •Начало роста цепи
- •Процесс роста цепи
- •Остановка роста цепи
- •1. Наличие в системе выделяющегося низкомолекулярного продукта реакции и установление равновесия между прямой и обратной реакциями.
- •Механизмы реакций равновесной поликонденсации
- •Кинетика равновесной поликонденсации
- •Неравновесная поликонденсация
- •Особенности неравновесной поликонденсации
- •Кинетика неравновесной поликонденсации
- •Способы проведения поликонденсации
- •Поликонденсация в твердой фазе, расплаве, растворе
- •Поликонденсация в эмульсии
- •Межфазная поликонденсация
- •Трехмерная поликонденсация
- •Совместная поликонденсация
- •3. Синтез полимеров: полимеризация
- •3.1. Основы теории полимеризации
- •Характеристика процесса
- •Цепные и ступенчатые реакции полимеризации
- •Термодинамика полимеризации
- •Миграционная полимеризация
- •3.3. Радикальная полимеризация
- •3.3.1. Характеристика радикальных процессов
- •Мономеры
- •Инициирование
- •Рост цепи
- •Обрыв цепи
- •Кинетический анализ радикальной полимеризации Вывод общего кинетического уравнения радикальной полимеризации
- •Типичная кинетическая кривая радикальной полимеризации
- •Ингибиторы и замедлители радикальной полимеризации
- •Влияние различных факторов на скорость полимеризации и молекулярную массу полимера
- •Методы проведения полимеризации
- •Полимеризация в массе мономера
- •Полимеризация в растворителе
- •Полимеризация в суспензии
- •Эмульсионная полимеризация
- •Радикальная сополимеризация
- •Характеристика процесса
- •Уравнение состава сополимера
- •Константы сополимеризации, их физический смысл
- •Ионная полимеризация
- •Характеристика ионных процессов
- •Активные центры ионной полимеризации
- •Катионная полимеризация
- •Инициаторы катионной полимеризации
- •Реакционная способность мономеров
- •Механизм катионной полимеризации
- •Анионная полимеризация
- •Механизм действия анионных инициаторов. В зависимости от типа взаимодействий можно выделить 2 механизма инициирования анионной поликонденсации.
- •Ионно-координационная полимеризация
- •Алфиновые катализаторы
- •Катализаторы Циглера-Натта
- •Оксидные катализаторы
- •Ионная сополимеризация
- •4. Химические превращения
- •Особенности химических реакций полимеров
- •Полимераналогичные превращения
- •Реакции, приводящие к увеличению молекулярной массы
- •Реакции, приводящие к уменьшению молекулярной массы
- •Старение полимеров
- •Библиографический список
Остановка роста цепи
Может быть обусловлена различными причинами как условно физического, так и химического характера.
Физические причины: увеличение вязкости среды (следовательно, уменьшается скорость взаимодиффузии макромолекул); понижение концентрации реагирующих групп; высокая температура плавления образующихся полимеров; снижение температуры реакции.
Химические причины: наличие в системе выделяющегося низкомолекулярного продукта реакции и установление равновесия между прямой и обратной реакциями; нарушение структуры функциональных групп; неэквимолярное соотношение мономеров; влияние монофункциональных соединений.
Рассмотрим более подробно химические причины остановки роста цепи.
1. Наличие в системе выделяющегося низкомолекулярного продукта реакции и установление равновесия между прямой и обратной реакциями.
Вывод уравнения поликонденсационного равновесия
Равновесная
поликонденсация характеризуется
константой равновесия
![]() ,
равной отношению концентраций продуктов
реакции и исходных веществ (или их
функциональных групп).
,
равной отношению концентраций продуктов
реакции и исходных веществ (или их
функциональных групп).
Например, для полиэтерификации:
 ,
(11)
,
(11)
где
![]() ,
,
![]() ,
,
![]() ,
,
![]() – равновесные концентрации (молярные
доли) полимера, воды, кислоты и спирта
соответственно.
– равновесные концентрации (молярные
доли) полимера, воды, кислоты и спирта
соответственно.
Так как в равновесном
состоянии общее число реагирующих
групп в процессе реакции остается
постоянным, то их концентрации можно
заменить на число молей. Пусть
![]() – общее число молей функциональных
групп в исходном состоянии; N
– общее
число молей функциональных групп в
равновесном состоянии;
– общее число молей функциональных
групп в исходном состоянии; N
– общее
число молей функциональных групп в
равновесном состоянии;
![]() – число молей низкомолекулярного
вещества в равновесном состоянии. Тогда
перепишем уравнение (11) в виде
– число молей низкомолекулярного
вещества в равновесном состоянии. Тогда
перепишем уравнение (11) в виде
![]() .
(12)
.
(12)
Разделим в уравнении
(12) числитель и знаменатель на
![]() :
:
 .
(13)
.
(13)
Введем следующие
обозначения:
![]() – мольная доля связей, приходящихся
на одно мономерное звено в полимере;
– мольная доля связей, приходящихся
на одно мономерное звено в полимере;
![]() – мольная доля низкомолекулярного
продукта;
– мольная доля низкомолекулярного
продукта;
![]() – средняя степень полимеризации при
поликонденсации.
– средняя степень полимеризации при
поликонденсации.
После подстановки этих величин в уравнение (13) получим
 .
(14)
.
(14)
После преобразования уравнения (14) с целью определения средней степени полимеризации имеем
![]() .
(15)
.
(15)
С ростом молекулярной
массы полимера значение
![]() уменьшается и стремится к 1.
уменьшается и стремится к 1.
Действительно,
![]() ,
,
т.к.
отношение
![]() становится мало. В таких условиях членом
становится мало. В таких условиях членом
![]() в
уравнении (15) можно пренебречь, и
оно преобразуется
в уравнение
зависимости средней степени полимеризации
от константы равновесия Kp
и мольной доли низкомолекулярного
продукта na:
в
уравнении (15) можно пренебречь, и
оно преобразуется
в уравнение
зависимости средней степени полимеризации
от константы равновесия Kp
и мольной доли низкомолекулярного
продукта na:
![]() .
(16)
.
(16)
Вывод. Согласно уравнению (16), получить высокомолекулярные продукты без вывода из сферы реакции низкомолекулярных веществ невозможно. Накопление в реакционной смеси низкомолекулярного продукта реакции приводит к ускорению обратной реакции. Цепь макромолекул растет, пока удовлетворяется неравенство
![]() ,
(17)
,
(17)
где
![]() - доля низкомолекулярного продукта,
образовавшегося за время
- доля низкомолекулярного продукта,
образовавшегося за время
![]() ;
;
![]() - доля реакционных центров исходного
мономера, вступивших в реакцию
поликонденсации к моменту времени
.
- доля реакционных центров исходного
мономера, вступивших в реакцию
поликонденсации к моменту времени
.
Следовательно, при небольших значениях константы равновесия для получения ВМС необходимо тщательное удаление низкомолекулярных веществ из сферы реакции.
2. Нарушение структуры функциональных групп. Химическое изменение функциональных групп делает их неспособными участвовать в процессе роста цепи макромолекул. Из побочных реакций наиболее часто встречаются дегидратация, декарбоксилирование, дезаминирование и циклизация.
Дегидратация наблюдается у гликолей, β-оксикислот, глицерина:
2НО-(СН2)2-ОН → Н2О + НО-(СН2)2-О-(СН2)2-ОН (диэтиленгликоль)
НО-(СН2)2-СООН → Н2О + СН2=СН-СООН (акриловая кислота)
НО-СН2-СНОН-СН2ОН → 2Н2О + СН2=СН-СОН (акролеин)
Декарбоксилирование характерно для мономеров (полимеров), имеющих карбоксильные группы:
НООС-(СН2)4-СООН → СО2 + СН3(СН2)3-СООН
Декарбоксилирование дикарбоновых кислот может происходить одновременно с дегидратацией:

Дезаминирование диаминов приводит к аминам циклического строения либо с открытой цепью:
2 H2N-(СН2)n-NH2 → H2N-(СН2)n-NH-(СН2)n-NH2 + NH3

Циклизации подвержены мономеры, способные образовывать устойчивые пяти-семичленные циклы. Возникновение циклов возможно и на конце макромолекулы. Например, при синтезе полиамидов (циклоимидный эффект):
 сукцинимидная
группировка
сукцинимидная
группировка
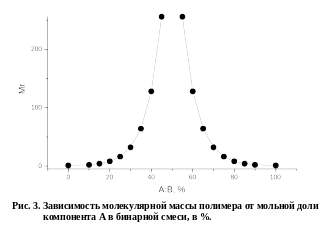
3. Неэквимолярное соотношение функциональных групп. Для достижения высокой молекулярной массы необходимо эквивалентное соотношение функциональных групп разных типов, содержащихся в реакционной смеси. Действительно, при избытке одного из исходных веществ процесс поликонденсации протекает до тех пор, пока не будет израсходован мономер, присутствующий в меньшем количестве. В этот момент все макромолекулы будут содержать на обоих концах одинаковые функциональные группы, такие как у избыточного компонента, что приведет к остановке роста процесса поликонденсации.
 Эквивалентность
может нарушаться, если исходные вещества
обладают различной летучестью, а также
вследствие химического изменения
функциональных групп в процессе реакции.
Эквивалентность
может нарушаться, если исходные вещества
обладают различной летучестью, а также
вследствие химического изменения
функциональных групп в процессе реакции.
Таким образом, при поликонденсации избыток одного из компонентов, если он не удаляется в процессе реакции, приводит к понижению молекулярной массы образующегося полимера в степени, пропорциональной величине этого избытка (рис. 3).
4. Влияние монофункциональных соединений. Понижение молекулярной массы образующегося полимера также происходит, если в эквимольную смесь двух бифункциональных мономеров добавить монофункциональное соединение: оно блокирует функциональные группы противоположного типа, и процесс поликонденсации прекращается.
В некоторых случаях монофункциональные соединения используют для регулирования молекулярной массы полимера. В этом случае их называют стабилизаторами (регуляторами) молекулярной массы.
