
- •Глава 1. Основы теплообмена
- •1.1. Радиационное охлаждение
- •1.3. Перенос тепла в теплозащитном покрытии (тзп)
- •1.3.1. Пористое охлаждение
- •1.4. Физико-химические основы разрушения теплозащитных материалов
- •1.5. Немного о графите
- •1.6. Радиационный теплообмен
- •Глава 2. Особенности работы рдтт
- •Глава 3. Композиционные материалы
- •3.1 Межфазное взаимодействие
- •3.1.1 Армирующие волокна
- •3.1.2. Матричные материалы
- •3.2. Полимерные матрицы
- •3.3 Адгезия в твердых полимерах
- •3.4 Межфазовые взаимодействия в км
- •3.1 Смачивание
- •10. Схема смачивания:
- •Глава 4. Полимерные пластики
- •4.1. Стеклопластики
- •4.1.1 Методы изготовления стеклопластиковых изделий
- •4.1.2 Связующие
- •4.1.3. Стекловолокнистые
- •4.1.4. Свойства стеклопластиков
- •4.2. Органопластики
- •4.2.1. Синтетические волокна
- •4.2.2. Другие искусственные волокна
- •4.2.3. Высокопрочные органические волокна
- •4.3.1. Порядок изготовления корпуса
- •Глава 5
- •5.1. Армирующие волокна
- •Температурная зависимость модуля упругости и прочности волокон
- •Сравнительные характеристики волокон
- •Свойства борных волокон, произведенных в разных станах
- •5.2. Металлические матрицы
- •5.2.1. Матрицы на основе алюминия
- •5.2.2. Системы al—в и алюминий – борсик
- •Глава 6
- •6.1. Физические свойства
- •6.2. Изменение свойств
- •Основные свойства и реакции графита
- •6.4. Получение
- •Важнейшие исходные материалы:
- •6.4.1. Характеристика исходных материалов и
- •6.5. Углеродные волокна
- •6.5.1. Некоторые свойства углеродных волокон
- •Механические свойства некоторых углеродных волокон
- •Физические свойства углеродных волокон
- •Свойства некоторых пкм с волокнистыми наполнителями
- •6.6. Углепластики
- •6.6.1. Технология изготовления углепластиков
- •6.6.1.1. Метод прямого прессования
- •6.6.1.2. Метод намотки
- •Механические свойства вольфрамовой проволоки
- •Характеристики умп
- •6.7.1. Технология изготовления углеметаллопластиков
- •Режимы резания
- •Теплофзические свойства углеметалопластиков
- •Режимы резания
- •Теплофзические свойства углеметалопластиков
- •6.8. Углерод-углеродные композиционные материалы
- •6.8.1. Краткое описание технологии получения раструба из уукм
- •6.8.2. Пластинчатый пирографит
- •Глава 7: получение изделий методами порошковой металлургии
- •7.1.Методы получения и свойства металлических порошков
- •7.1.1. Свойства металлических порошков
- •7.1.1.1. Физические свойства
- •7.1.1.2. Методы исследования гранулометрического состава порошков.
- •7.1.1.3. Форма частиц
- •7.1.1.4. Микротвердость
- •7.1.1.5. Удельная поверхность
- •7.1.1.6. Состояние кристаллической структуры металлических порошков
- •7.2. Технологические свойства порошков
- •7.2.1. Насыпной вес
- •7.2.2. Текучесть порошков
- •7.2.3. Прессуемость
- •7.3. Производство порошков
- •7.3.1. Метод восстановления
- •7.3.1.1. Физико–химические
- •7.3.1.2. Восстановление газами и углеродом
- •7.3.2. Получение порошков электролизом
- •7.3.3. Методы механического дробления
- •7.3.4. Распыление расплавов металлов и сплавов
- •7.4. Прессование порошков
- •7.5. Спекание порошков.
- •7.6. Вольфрам
- •7.6.1. Химические свойства вольфрама
- •7.6.2. Разрушение вольфрама под действием
- •7.6.3. Действие горячих газов на вольфрам
- •7.7. Псевдосплавы на основе
- •7.7.1. Технология изготовления облицовки из псевдосплава авмг
- •7.7.1.1. Недостатки технологии
- •7.7.2. Псевдосплав вндс-1
- •7.7.2.1. Технология получения вндс
- •1. Как и в случае с авмг, производятся такой же химический и другие анализы порошков.
- •7.7.2.2. Пропитка пористой
- •Глава 8
- •8.1. Карбиды
- •8.1.1. Карбид кремния
- •8.1.2. Силицированныи графит
- •8.1.3. Карбид титана
- •8.1.4. Карбид бора
- •8.2. Нитриды
- •8.2.1. Получение нитридов
- •8.2.2. Нитриды бора и кремния
- •8.2.3. Нитриды бериллия и алюминия
- •8.2.4. Нитриды скандия, иттрия,лантана и редкоземельных элементов
- •8.2.5. Нитриды титана,циркония и гафния
- •8.2.6. Физико-механическиеи химические свойства нитридов
- •8.2.7. Области применениябескислородной керамики
- •Глава 9
- •9.1. Сплавы на основе алюминия
- •9.1.1 Деформируемые алюминиевые сплавы
- •9.1.1.2. Конструкционные свариваемые сплавы
- •9.1.1.3. Сплавы, упрочняемыетермической обработкой
- •9.1.1.4. Высокопрочные сплавы
- •9.1.1.5. Жаропрочные сплавы
- •9.1.1.6. Ковочные сплавы
- •9.1.1.7. Литейные сплавы
- •9.1.2. Композиционные сплавы
- •9.2. Бериллии и его сплавы
- •9.2.1. Минералы бериллия
- •9.2.2. Свойства бериллия
- •9.2.3. Сплавы бериллия
- •9.3.1. Краткие исторические сведения
- •9.3.2. Получение титана. Его свойства
- •9.3.3. Промышленные титановые сплавы
- •9.3.3.1. Деформируемые сплавы
- •Свойства жаропрочных сплавов
- •9.3.3.2. Литейные сплавы
- •9.4. Ниобии и его сплавы
- •9.4.1. Краткие исторические сведения
- •9.4.2. Сырьевые источники
- •9. 4. 3. Физические свойства ниобия
- •9.4.4. Химические свойства ниобия
- •9.4.5 Коррозионные свойства
- •9.4.6 Сплавы ниобия и их свойства
- •9.4.7 Конструкционные сплавы
- •9.4.7.1. Сплавы низкой прочности
- •9.4.7.2. Сплавы средней прочности
- •9.4.7.3. Сплавы высокой прочности
- •9.4 7.4. Прецизионные сплавы
- •9.4.8. Применение ниобия и его сплавов
- •9.5. Молибден
- •9.5.1. Краткие исторические сведения
- •9.5.2. Свойства молибдена
- •Физико-механические свойства молибдена
- •9.5.3. Минералы, руды и рудные концентраты
- •9.5.4. Способы переработки
- •9.6 Тантал и его сплавы
- •9.6.1 Краткие исторические сведения
- •9.6.2 Физико-механические свойства
- •9.6.3 Минералы, руды и рудные концентраты
- •9.6.4 Получение тантала
- •9.6.5 Сплавы тантала
- •Химический состав и механические свойства жаропрочных танталовых сплавов
- •9.6.6. Области применения
- •9.7. Ванадий и его сплавы
- •9.7.1. История открытия ванадия
- •9.7.2. Определение ванадия
- •9.7.3. Свойства ванадия
- •Химический состав металлического ванадия
- •Механические свойства ванадия
- •9.7.4. Сплавы ванадия
- •9.7.5. Применение ванадия и его сплавов
- •9.8. Цирконий
- •9.8.1. Свойства циркония
- •Физические свойства циркония
- •9.8.2. Области применения циркония
- •9.8.2.1. Атомная энергетика
- •9.8.2.2. Пиротехника и производство боеприпасов
- •9.8.2.3. Машиностроение
- •9.8.3. Производство сталей и сплавов
- •9.8.4. Производство огнеупоров, фарфора,
- •9.8.5. Прочие области применения
- •9.8.6. Минералы, руды и рудные концентраты
- •9.8.7. Способы получения циркония
- •Глава 1. Основы теплообмена
7.6.1. Химические свойства вольфрама
При комнатной температуре вольфрам стоек к атмосферной коррозии, но при нагреве уже до 750 К окисляется до WO3, реагирует с галогенами: с фтором – при комнатной температуре, а йодом при температуре около 900 К.
При нагреве высоких температур он реагирует с углеродом, кремнием и бором, образуя соответственно карбиды,силициды,бориды. Сера и фосфор в обычных условий на вольфрам не действуют. На воздухе растворяется в горячих водных растворах щелочей, но слабо поддается действию кислот, кроме плавиковой и азотной при нагреве.
Водород и азот не дают химических соединений с вольфрамом,в плоть до
30000 С, хотя в некоторых источниках имеются указания на возможность образования гидрида WH2.
Cкислородом вольфрам образует три устойчивых оксида:
-WO2 – бурового цвета;
- WO3 – желтого цвета;
- W2O5 – синеватого цвета.
Все эти оксиды образуются при температуре около 800 К на воздухе или в кислороде, причем все они очень летучи, имеют невысокую температуру плавления. Например, WO3 плавится при температуре 1645 К.
На практике, чтобы отличить вольфрамовую проволоку, от молибденовой пользуются простым приемом: кончик проволоки поджигают спичкой. Если при этом наблюдается желтый или бурый дымок, значит, это проволока вольфрамовая, если белый – молибденовая.
Углерод восстанавливает оксиды W:
![]() при
температуре 825 К;
при
температуре 825 К;
![]() при
температуре 1325 К;
при
температуре 1325 К;
![]() при
температуре 1425 К.
при
температуре 1425 К.
С азотом вольфрам образует нитриды при температурах более 1600 К, но выше отметки 2275 К они разлагаются.
При взаимодействии с углеродом и температурах выше 1800 К вольфрам образует карбиды W2CиWC. ПлотностьW2C – 16000 кг/м3, WC– 9000 кг/м3, твердость около 9 единиц по Мосу. При температуре 2875 К кабрид WC разлагается по реакции
![]()
На рис.73 приведена диаграмма состояния W–C.
Как видно из диаграммы, карбиды вольфрама имеют температуру плавления значительно ниже таковой для самого металла. Так, WC плавится при температуре около 2875 К, W2C – 3065 К. Кроме того, карбиды могут образовывать с вольфрамом эвтектические сплавы с температурой плавления значительно низшей чем у металла, который плавится при 3683 К. Поэтому нужно обратить внимание ракетчиков на опасность реакции образования карбидов на границе графит – вольфрам, которая имеет место при нагреве выше 2675 К. Предупреждение связано с тем, что в конструкции вкладыша критического сечения сопла твердотопливного двигателя сочетаются вольфрамовая внутренняя облицовка с графитовой обоймой.
Во избежание приведенной реакции между вольфрамовой облицовкой и графитом обоймы наносится так называемый «барьерный» слой из карбида тантала или титана (ТаС, TiC).
В связи с высокой плотностью вольфрама и его дефицитностью конструкторы и технологи стремятся заменить его на более легкие и менее дефицитные материалы, о чем будет сказано далее.
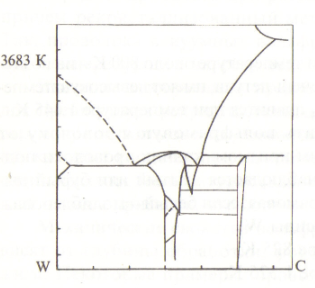

Рис. 73. Диаграмма состояния W-C
Рис. 74. Схема массопереноса в лампе
накаливания:1 –стенка колбы, где образуется WJ2; 2 –спираль, где WJ2 разлагается на W и J
Хотя реакция вольфрама с йодом не имеет отношения к ракетной технике, все же на ней хотелось бы коротко остановиться.
При температуре выше 850 К вольфрам с парами йода образует иодид, который представляет собой легко сублимирующую соль йодидной кислоты:
![]()
При температуре2475 К йодид разлагается:
![]()
Эти две реакции используются для переноса вольфрама, например, в лампах накаливания: несмотря на низкую упругость паров в них вольфрам все же испаряется в вакууме. Пары его садятся на стенки стеклянной колбы лампы и прозрачность ее уменьшается. Если колбу заполнить парами йода, то последний станет реагировать с вольфрамом на горячей стенке лампы и образует WJ2, который за счет диффузии попадает на нагретую вольфрамовую спираль и разложится. Свободный йод снова переместиться к стенке, а вольфрамостанется на спирали, и так без конца. В конечном результате повышается светимость и долговечность йодозаполненных ламп.
Эта же реакция используется в технике для получения чистых тугоплавких металлов: вольфрама, тантала, молибдена, гафния и др.
Эту реакцию можно использовать и для получения тонких оболочек из вольфрама. Кроме йодидного метода для этой цели можно использовать карбонильный, т.е. разложение WCO2. В реактивных топливныхдвигателях вольфрам в чистом виде, как правило, не применяется ввиду низкой термической стойкости, а применяется в виде так называемых псевдосплавов с медью. Об этом будет сказано ниже.
В ядерной технике вольфрам может применяться в качестве плакирующего слоя ТВЭЛов на основе UC–ZrC повышения их прочности, уменьшения испарения и распухания. Он может входить в состав металлокерамических элементов типа
W - UC или W – UO2 и т.п. Такие ТВЭлы могут работать при температуре до 2000 К, так как вольфрам, несмотря на многие недостатки, является жаропрочным металлом, медленно испаряется и защищает от осколков деления и излучений. В разделе «Углеродные материалы» вольфрам рассматривается, как армирующий материал в углеметаллопластиках, которые применяются для изготовления узлов и деталей РДТТ, работающих в жестких условиях высоких температур и высокоскоростных газовых потоков.
