
- •Глава 1. Основы теплообмена
- •1.1. Радиационное охлаждение
- •1.3. Перенос тепла в теплозащитном покрытии (тзп)
- •1.3.1. Пористое охлаждение
- •1.4. Физико-химические основы разрушения теплозащитных материалов
- •1.5. Немного о графите
- •1.6. Радиационный теплообмен
- •Глава 2. Особенности работы рдтт
- •Глава 3. Композиционные материалы
- •3.1 Межфазное взаимодействие
- •3.1.1 Армирующие волокна
- •3.1.2. Матричные материалы
- •3.2. Полимерные матрицы
- •3.3 Адгезия в твердых полимерах
- •3.4 Межфазовые взаимодействия в км
- •3.1 Смачивание
- •10. Схема смачивания:
- •Глава 4. Полимерные пластики
- •4.1. Стеклопластики
- •4.1.1 Методы изготовления стеклопластиковых изделий
- •4.1.2 Связующие
- •4.1.3. Стекловолокнистые
- •4.1.4. Свойства стеклопластиков
- •4.2. Органопластики
- •4.2.1. Синтетические волокна
- •4.2.2. Другие искусственные волокна
- •4.2.3. Высокопрочные органические волокна
- •4.3.1. Порядок изготовления корпуса
- •Глава 5
- •5.1. Армирующие волокна
- •Температурная зависимость модуля упругости и прочности волокон
- •Сравнительные характеристики волокон
- •Свойства борных волокон, произведенных в разных станах
- •5.2. Металлические матрицы
- •5.2.1. Матрицы на основе алюминия
- •5.2.2. Системы al—в и алюминий – борсик
- •Глава 6
- •6.1. Физические свойства
- •6.2. Изменение свойств
- •Основные свойства и реакции графита
- •6.4. Получение
- •Важнейшие исходные материалы:
- •6.4.1. Характеристика исходных материалов и
- •6.5. Углеродные волокна
- •6.5.1. Некоторые свойства углеродных волокон
- •Механические свойства некоторых углеродных волокон
- •Физические свойства углеродных волокон
- •Свойства некоторых пкм с волокнистыми наполнителями
- •6.6. Углепластики
- •6.6.1. Технология изготовления углепластиков
- •6.6.1.1. Метод прямого прессования
- •6.6.1.2. Метод намотки
- •Механические свойства вольфрамовой проволоки
- •Характеристики умп
- •6.7.1. Технология изготовления углеметаллопластиков
- •Режимы резания
- •Теплофзические свойства углеметалопластиков
- •Режимы резания
- •Теплофзические свойства углеметалопластиков
- •6.8. Углерод-углеродные композиционные материалы
- •6.8.1. Краткое описание технологии получения раструба из уукм
- •6.8.2. Пластинчатый пирографит
- •Глава 7: получение изделий методами порошковой металлургии
- •7.1.Методы получения и свойства металлических порошков
- •7.1.1. Свойства металлических порошков
- •7.1.1.1. Физические свойства
- •7.1.1.2. Методы исследования гранулометрического состава порошков.
- •7.1.1.3. Форма частиц
- •7.1.1.4. Микротвердость
- •7.1.1.5. Удельная поверхность
- •7.1.1.6. Состояние кристаллической структуры металлических порошков
- •7.2. Технологические свойства порошков
- •7.2.1. Насыпной вес
- •7.2.2. Текучесть порошков
- •7.2.3. Прессуемость
- •7.3. Производство порошков
- •7.3.1. Метод восстановления
- •7.3.1.1. Физико–химические
- •7.3.1.2. Восстановление газами и углеродом
- •7.3.2. Получение порошков электролизом
- •7.3.3. Методы механического дробления
- •7.3.4. Распыление расплавов металлов и сплавов
- •7.4. Прессование порошков
- •7.5. Спекание порошков.
- •7.6. Вольфрам
- •7.6.1. Химические свойства вольфрама
- •7.6.2. Разрушение вольфрама под действием
- •7.6.3. Действие горячих газов на вольфрам
- •7.7. Псевдосплавы на основе
- •7.7.1. Технология изготовления облицовки из псевдосплава авмг
- •7.7.1.1. Недостатки технологии
- •7.7.2. Псевдосплав вндс-1
- •7.7.2.1. Технология получения вндс
- •1. Как и в случае с авмг, производятся такой же химический и другие анализы порошков.
- •7.7.2.2. Пропитка пористой
- •Глава 8
- •8.1. Карбиды
- •8.1.1. Карбид кремния
- •8.1.2. Силицированныи графит
- •8.1.3. Карбид титана
- •8.1.4. Карбид бора
- •8.2. Нитриды
- •8.2.1. Получение нитридов
- •8.2.2. Нитриды бора и кремния
- •8.2.3. Нитриды бериллия и алюминия
- •8.2.4. Нитриды скандия, иттрия,лантана и редкоземельных элементов
- •8.2.5. Нитриды титана,циркония и гафния
- •8.2.6. Физико-механическиеи химические свойства нитридов
- •8.2.7. Области применениябескислородной керамики
- •Глава 9
- •9.1. Сплавы на основе алюминия
- •9.1.1 Деформируемые алюминиевые сплавы
- •9.1.1.2. Конструкционные свариваемые сплавы
- •9.1.1.3. Сплавы, упрочняемыетермической обработкой
- •9.1.1.4. Высокопрочные сплавы
- •9.1.1.5. Жаропрочные сплавы
- •9.1.1.6. Ковочные сплавы
- •9.1.1.7. Литейные сплавы
- •9.1.2. Композиционные сплавы
- •9.2. Бериллии и его сплавы
- •9.2.1. Минералы бериллия
- •9.2.2. Свойства бериллия
- •9.2.3. Сплавы бериллия
- •9.3.1. Краткие исторические сведения
- •9.3.2. Получение титана. Его свойства
- •9.3.3. Промышленные титановые сплавы
- •9.3.3.1. Деформируемые сплавы
- •Свойства жаропрочных сплавов
- •9.3.3.2. Литейные сплавы
- •9.4. Ниобии и его сплавы
- •9.4.1. Краткие исторические сведения
- •9.4.2. Сырьевые источники
- •9. 4. 3. Физические свойства ниобия
- •9.4.4. Химические свойства ниобия
- •9.4.5 Коррозионные свойства
- •9.4.6 Сплавы ниобия и их свойства
- •9.4.7 Конструкционные сплавы
- •9.4.7.1. Сплавы низкой прочности
- •9.4.7.2. Сплавы средней прочности
- •9.4.7.3. Сплавы высокой прочности
- •9.4 7.4. Прецизионные сплавы
- •9.4.8. Применение ниобия и его сплавов
- •9.5. Молибден
- •9.5.1. Краткие исторические сведения
- •9.5.2. Свойства молибдена
- •Физико-механические свойства молибдена
- •9.5.3. Минералы, руды и рудные концентраты
- •9.5.4. Способы переработки
- •9.6 Тантал и его сплавы
- •9.6.1 Краткие исторические сведения
- •9.6.2 Физико-механические свойства
- •9.6.3 Минералы, руды и рудные концентраты
- •9.6.4 Получение тантала
- •9.6.5 Сплавы тантала
- •Химический состав и механические свойства жаропрочных танталовых сплавов
- •9.6.6. Области применения
- •9.7. Ванадий и его сплавы
- •9.7.1. История открытия ванадия
- •9.7.2. Определение ванадия
- •9.7.3. Свойства ванадия
- •Химический состав металлического ванадия
- •Механические свойства ванадия
- •9.7.4. Сплавы ванадия
- •9.7.5. Применение ванадия и его сплавов
- •9.8. Цирконий
- •9.8.1. Свойства циркония
- •Физические свойства циркония
- •9.8.2. Области применения циркония
- •9.8.2.1. Атомная энергетика
- •9.8.2.2. Пиротехника и производство боеприпасов
- •9.8.2.3. Машиностроение
- •9.8.3. Производство сталей и сплавов
- •9.8.4. Производство огнеупоров, фарфора,
- •9.8.5. Прочие области применения
- •9.8.6. Минералы, руды и рудные концентраты
- •9.8.7. Способы получения циркония
- •Глава 1. Основы теплообмена
7.3.1.2. Восстановление газами и углеродом
Активными газами-восстановителями являются СО и Н2 и различные газы их содержащие.
Восстановление происходит по следующим реакциям:
МеО + Н2 →Ме + Н2О,
МеО + СО →Me + СО2.
По термодинамическим соображениям СО более активен до 800 °С, а Н2 - при более высокой температуре.
Водород используется для восстановления оксидов таких металлов, как Fe, Ni, Сu, Со, W, Мо; окись углерода - для Fe, Сu, Ni.
При восстановлении оксидов в качестве восстановителя часто используется углерод. В противоположность металлам для углерода aGуменьшается с ростом температуры. При высоких температурах углерод применяется для восстановления Fe, Mo, Cr, Nb и др. В реакциях углерода с оксидами почти всегда присутствует и СО, участвующий в восстановлении.
Недостатком восстановления углеродом является возможность науглероживания конечного продукта.
Восстановление оксидов твердым углеродом происходит при температурах выше 900... 1000 °С, так как образования СO2 в этом случае не происходит, т. е. реакция 2СО СO2 + С смещена влево.
Для получения тонких порошков следует применять тонкодисперсные оксиды и низкие температуры восстановления. Использование высоких температур нежелательно еще и тем, что в приповерхностном слое восстанавливаемого порошка образуется плотная корка, затрудняющая диффузию газов. Конечно, понятие низкой температуры здесь относительно, т. е. она должна быть такой, чтобы шла реакция восстановления.
Восстановление обычно проводится в проходных муфельных печах с внешним обогревом муфеля и циркуляцией восстановительной атмосферы в муфелях, в которых помещена шихта.
В последнее время для восстановления вместо водорода применяют конвертированный природный газ, который получается по реакции
СН4 + H2O(пары) → СО + 3Н2.
Конверсия осуществляется при температуре 1 100 °С, а в присутствии специальных катализаторов- при более низкой.
7.3.2. Получение порошков электролизом
Получение порошков электролизом среди физико-химических методов является одним из наиболее распространенных. Электролитическим осаждением можно получать порошки всех металлов. Важным преимуществом этого метода является высокая чистота продукта за счет очистки от примесей во время электролиза, хотя и следует отметить высокую стоимость порошков из-за низкой производительности и большого расхода электроэнергии. В основе метода лежит разложение водных растворов металлических соединений и расплавленных солей при протекании постоянного тока. Сущность осаждения металлов состоит в разряде металлических ионов на катоде (Mene+ пе). Схематически процесс показан на рис. 66.
И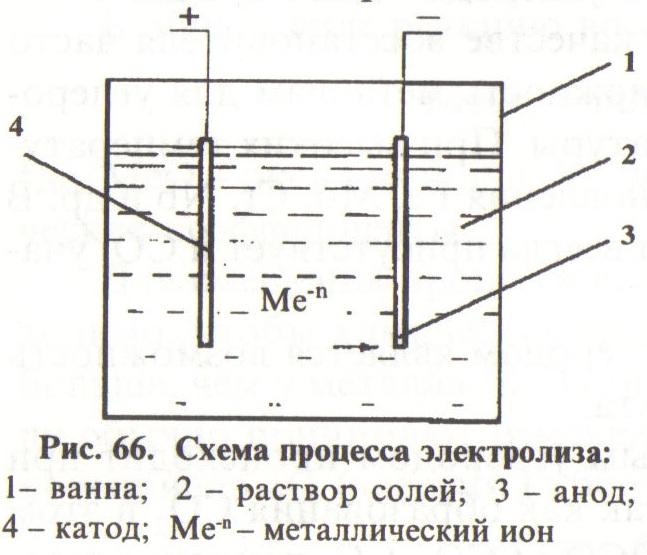 сточником
металлических ионов в общем случае
является анод, состоящий из металла,
подверженного электролизу, и
электролит, содержащий соль этого
металла. В некоторых случаях анод
может быть нерастворимым.
сточником
металлических ионов в общем случае
является анод, состоящий из металла,
подверженного электролизу, и
электролит, содержащий соль этого
металла. В некоторых случаях анод
может быть нерастворимым.
Протекание процесса зависит от подвижности ионов, которая обусловлена температурой электролита, вязкостью раствора, размером ионов, скоростью перемешивания. А в общем все характеризуется скоростью диффузии.
В зависимости от условий протекания процесса получают порошки трех видов:
- твердые хрупкие осадки в виде плотных слоев, чешуек или кристаллов;
- губчатые мягкие осадки - мелкие кристаллы, легко поддающиеся растиранию;
- рыхлые (черные) осадки, представляющие собой мелкодисперсные порошки.
Первые два из этих осадков дополнительно подвергаются механическому размолу, рыхлые же в измельчении не нуждаются. Вид осадка в основном зависит от плотности тока:
і = 0,2 К С,
где і - плотность тока, А/см2; С - концентрация электролита, моль/л; К - константа, зависящая от вида солей и находящаяся в пределах 0,5...0,9.
Метод электролиза широко используется для получения легированных порошков путем совместного осаждения компонентов сплава из растворов солей. Этим методом можно получать субмикроскопические порошки с размером зерна 0,01...0,1 мкм, которые применяются для изготовления магнитных и других материалов.
