- •C.М. Дрюцкая
- •Введение
- •Тема 1. Введение. Классы и номенклатура неорганических соединений. Основные законы и понятия химии. Закон эквивалентов.
- •1.1. Теоретические сведения
- •Химические свойства оксидов
- •Получение кислот
- •Химические свойства кислот
- •Получение оснований
- •Химические свойства оснований
- •Получение солей
- •Химические свойства средних солей
- •Числовые приставки
- •Систематические и тривиальные названия некоторых веществ
- •Систематические и международные названия некоторых сложных веществ
- •Названия наиболее распространенных кислот и их анионов
- •1.2. Контрольные вопросы и задания
- •1.3. Примеры решения задач
- •1.4. Индивидуальные задания
- •Варианты контрольного задания
- •Варианты контрольного задания
- •1.5. Тестовые задания
- •Тема 2. Способы выражения концентрации (состава) раствора.
- •2.1. Теоретические сведения
- •2.2. Контрольные вопросы и задания
- •2.3. Примеры решения задач
- •2.4. Индивидуальные задания
- •Варианты контрольного задания
- •2.5. Тестовые задания
- •Тема 3. Химическая термодинамика.
- •3.1. Теоретические сведения
- •3.2. Контрольные вопросы и задания
- •3.3. Примеры решения задач
- •Стандартные термодинамические функции
- •3.4. Индивидуальные задания
- •Варианты контрольного задания
- •Варианты контрольного задания
- •3.5. Тестовые задания
- •Тема 4. Химическая кинетика. Термодинамика химического равновесия
- •4.1.Теоретические сведения
- •4.2. Контрольные вопросы и задания
- •4.3. Примеры решения задач
- •4.4. Индивидуальные задания
- •Варианты контрольного задания
- •4.5. Тестовые задания
- •Тема 5. Строение атома. Периодический закон и периодическая система элементов д.И. Менделеева. Химическая связь и строение соединений. Межмолекулярные взаимодействия.
- •5.1. Теоретические сведения
- •Основные характеристики протона, нейтрона и электрона
- •Корпускулярно-волновые свойства частиц
- •Число подуровней на энергетических уровнях
- •Число орбиталей на энергетических подуровнях
- •Последовательность заполнение атомных орбиталей
- •Электронные формулы элементов
- •Потенциалы (энергии) ионизации i1, эВ
- •Потенциалы (энергии) ионизации i1, эВ элементов V группы
- •Значение энергии (Eср) сродства к электрону для некоторых атомов.
- •Относительная электроотрицательность элементов
- •Свойства веществ в разных агрегатных состояниях
- •Сравнительная характеристика аморфных и кристаллических веществ
- •Свойства кристаллических решеток
- •5.2. Контрольные вопросы и задания
- •5.3. Примеры решения задач
- •План характеристики элемента по положению в Периодической системе д.И. Менделеева
- •5.4. Индивидуальные задания
- •Варианты контрольного задания
- •Исходные данные
- •5.5. Тестовые задания
- •Тема 6. Реакции с переносом электронов. Окислительно-восстановительные равновесия и процессы
- •6.1. Теоретические сведения
- •Характеристика элементов и их соединений в овр
- •Типы овр
- •Составление уравнений окислительно-восстановительных реакций
- •Участие ионов в различных средах
- •Стандартные электродные потенциалы металлов
- •6.2. Контрольные вопросы и задания
- •6.3. Примеры решения задач
- •6.4. Индивидуальные задания
- •Варианты контрольного задания
- •Исходные данные
- •6.5. Тестовые задания
- •Тема 7. Лигандообменные равновесия и процессы. Комплексные соединения
- •Координационные числа ионов - комплексообразователей
- •Основные комплексообразователи в кс
- •Среднее поле
- •Слабое поле
- •Геометрическая структура кс и тип гибридизации
- •Видимый спектр длин волн (нм) и окраска кс при их поглощении
- •Варианты контрольного задания
- •Тема 8. Осмотические свойства растворов. Протолитические равновесия и процессы. Электролитическая ионизация. Степень и константа ионизации
- •Теория электролитической ионизации (диссоциации).
- •Варианты контрольного задания
- •Тема 9. Гетерогенные равновесия и процессы. Произведение растворимости, условия образования и растворения осадков
- •Условия смещения гетерогенного равновесия:
- •Варианты контрольного задания
- •Тема 10. Ионное произведение воды. РН. Гидролиз солей
- •Изменение окраски некоторых индикаторов
- •Примеры буферных растворов.
- •Уравнения Гендерсона – Гассельбаха
- •Варианты контрольного задания
- •Объем учебной дисциплины «Общая и неорганическая химия» и виды учебной работы для студентов очного отделения фармацевтического факультета
- •Календарный план лабораторных занятий по общей и неорганической химии для студентов дневного отделения фармацевтического факультета
- •I семестр (продолжительность - 5 часов)
- •Календарный план лекций по общей и неорганической химии для студентов дневного отделения фармацевтического факультета
- •I семестр (продолжительность - 2 часа)
- •Название важнейших кислот и солей.
- •Значения некоторых фундаментальных физческих постоянных
- •Термодинамические свойства веществ.
- •Стандартные электродные потенциалы (е0) некоторых систем
- •Константы устойчивости комплексных ионов
- •Константы нестойкости некоторых комплексных ионов
- •Константы ионизации кислот и оснований (Ки)
- •Коэффициенты активности (f) ионов при ионных силах раствора
- •Растворимость кислот, оснований и солей в воде
- •Константы растворимости
- •Ответы тестовых заданий
- •Оглавление
1.5. Тестовые задания
Амфотерными свойствами обладают оба оксида:
а
 в
в
б  г
г
2. Кислотными свойствами обладают оба оксида:
а
 в
в 
б  г
г
3. Кислой солью является вещество:
а
 в
в
б 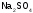 г
г

4. Основанием является вещество:
а
 в
в
б  г
г
5.
В схеме превращений
 ,
реагенты А и В соответственно ‑ это
,
реагенты А и В соответственно ‑ это
а
 в
в Cl2,
Cl2,
б  г
г
6.
Краткое ионное уравнение
 ,
отвечает взаимодействию реагентов
,
отвечает взаимодействию реагентов
а
 в
в
б  г
г
7.
В реакции, выраженной кратким ионным
уравнением
 ,
ион среды (гидроксид ОН-)
может отвечать реагенту
,
ион среды (гидроксид ОН-)
может отвечать реагенту
а
 в
в
б  г.
г.
8. Установите соответствие между названием оксида и группой, к которой он принадлежит.
|
Название |
Вещество |
|
А) оксид хлора (I) |
1) несолеобразующие |
|
Б) оксид хрома (III) |
2) амфотерные |
|
В) оксид иода (V) |
3) двойные |
|
Г) оксид азота (II) |
4) кислотные |
|
|
5) основные |
9. Установите соответствие между формулой вещества и классом (или группой), к которому(ой) оно принадлежит.
|
Формула |
Класс (группа) |
|
А)
|
1) кислотный оксид |
|
Б)
|
2) средняя соль |
|
В)
|
3) основной оксид |
|
Г)
|
4) амфотерный оксид |
|
|
5) кислая соль |
|
|
6) двойная соль |
10. Установите соответствие между исходными веществами и продуктами реакций.
|
Исходные вещества |
Продукты реакций |
|
А)
|
1)
|
|
Б)
|
2)
|
|
В)
|
3)
|
|
Г)
|
4)
|
|
|
5)
|
11. Для расчета фактора эквивалентности вещества Н2СО3 используют число:
а) замещаемых ионов водорода;
б) отдаваемых электронов;
в) принимаемых электронов;
г) равное валентности углерода.
12. При нормальных условиях масса водорода, занимающего объем 44,8 дм3 равна (в г):
а) 1 б) 2 в) 4 г) 8
13. Количество молекул, содержащихся в 10 моль углекислого газа, составляет:
а) 1,204 · 1023 в) 12,04 · 1024
б) 6,023 · 1023 г) 6,023 · 1024
14. Молярная масса эквивалентов азотной кислоты равна величине (г/моль):
а) 63 б) 31,5 в) 126 г) 189
15. Молярная масса эквивалентов гидроксида кальция равна величине (г/моль):
а) 74 б) 37 в) 111 г) 18,5
16. Молярная масса эквивалентов карбоната кальция равна величине (г/моль):
а) 50 б) 100 в) 25 г) 200
17. Единица измерения молярной массы эквивалента:
а) г/моль в )безмерная величина
б) моль/г г) г/дм3
18.
При расчете М(1/zСu(OH)2)
величина z в реакции
 равна:
равна:
а) 1 б )2 в )3 г) 4
19.
При расчете М(1/z Н3РО4)
величина z в реакции
 равна:
равна:
а) 1 б) 2 в) 3 г) 4
20. Название наименьшей частицы химического элемента, сохраняющей все его химические свойства:
а) протон в) электрон
б) атом г) ион
Тема 2. Способы выражения концентрации (состава) раствора.
2.1. Теоретические сведения
Раствор – гомогенная термодинамически устойчивая система, состоящая из растворенного вещества, растворителя и продуктов их взаимодествия. Компонент, агрегатное состояние которого не изменяется при образовании раствора, называется растворителем, а другой компонент – растворенным веществом. При одинаковом агрегатном состоянии компонентов растворителем считают то вещество, которое преобладает.
Основной характеристикой раствора является его состав, который выражается концентрацией.
Концентрация раствора – содержание растворенного вещества в определенной массе или известном объеме раствора или растворителя.
Концентрацию выражают через безмерные величины – доли и через размерные величины – молярные массы.
Массовая доля вещества (ɷ) – это отношение массы вещества к общей массе раствора. Она выражается в %, показывает, сколько граммов данного компонента содержится в 100 г раствора.
 (13)
(13)
Часто приходится проводить расчеты, связанные с разбавлением растворов смешиванием. Если при смешивании нескольких растворов одного и того же вещества с различной процентной концентрацией (А%, В%) учитывались их массовые числа (а, б), то для определении концентрации вещества (С %) в смеси расчет проводят по формуле:
аА+вВ = (а+в)Х, (14)
где а и в – массы растворов, А, В, Х – концентрации растворов , %.
На практике при вычислении массовых отношений между смешиваемыми растворами пользуются приемом («правило крета»):
|
ɷ1 |
|
ɷХ - ɷ2 – m раствора с массовой долей ɷ1 |
|
|
ɷХ |
|
|
ɷ2 |
|
ɷ1 - ɷХ - m раствора с массовой долей ɷ2
|
ɷ1 и ɷ2 - концентрации исходных веществ, ɷХ – концентрация полученного раствора.
Тем же методом можно пользоваться и при разбавлении растворов водой. Соответствующая воде массовая доля принимается равной нулю.
Молярная доля растворенного вещества (N(A)) – это отношение числа моль растворенного вещества к сумме моль растворенного вещества и растворителя. Если в системе содержится несколько веществ, то это отношение числа моль искомого вещества к общему числу моль всех содержащихся в системе веществ:
 (15)
(15)
Молярная доля растворителя (N(В)) – это отношение числа моль растворителя к сумме моль растворенного вещества и растворителя:
 (16)
(16)
Молярная концентрация (СМ) - это отношение количества растворенного вещества к объему его раствора. Показывает сколько моль вещества содержится в 1 дм3 (л) раствора:
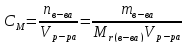 ;
[моль/дм3] (17)
;
[моль/дм3] (17)
Растворы с молярной концентрацией атомов, молекул, ионов называются молярными. При этом пользуются следующей формой записи, где «М» обозначается молярность:
СМ(НСl) = 1 моль/дм3 – молярный раствор, 1М раствор НСl;
СМ(НСl) = 0,1 моль/дм3 – децимолярный раствор, 0,1М раствор НСl;
СМ(НСl) = 0,01 моль/дм3 –сантимолярный раствор, 0,01М раствор НСl;
СМ(НСl) = 0,001 моль/дм3 – миллимолярный раствор, 0,001М раствор НСl и т.д.
Нормальная (эквивалентная) или молярная концентрация эквивалента (Сн) – это число моль эквивалента вещества в 1 дм3 раствора. Условно применяется следующее обозначение Сн (НСl) = 1 моль/дм3 или 1н раствор НСl.
 ;
[моль/дм3]
(18)
;
[моль/дм3]
(18)
Если численные значения молярной и нормальной концентрации совпадают (э = 1), то употребляют слово «молярная». Например, для 2М раствора КОН не нужно применять выражение 2н раствор КОН.
Моляльная концентрация (Сm) – это число моль вещества, растворенного в 1 кг растворителя:
 ;
[моль/кг] (19)
;
[моль/кг] (19)
Концентрация – титр (Т) – отношение массы растворенного вещества к объему его раствора:
 ;
[г/см3]
или [г/мл] (20)
;
[г/см3]
или [г/мл] (20)
СМ, Сн, Т зависят от температуры, так как при нагревании объем раствора увеличивается.
Практически используется еще одной массовой величиной – плотностью раствора (ρ) – отношение массы раствора к его объему:
 ;
[г/см3]
или [г/мл] (21)
;
[г/см3]
или [г/мл] (21)
В практике приготовления растворов пользуются формулами пересчета одной концентрации в другую:
 (22)
(22)
 (23)
(23)
 (24)
(24)
 г/см3
(25)
г/см3
(25)
 г/см3
(26)
г/см3
(26)