
- •C.М. Дрюцкая
- •Введение
- •Тема 1. Введение. Классы и номенклатура неорганических соединений. Основные законы и понятия химии. Закон эквивалентов.
- •1.1. Теоретические сведения
- •Химические свойства оксидов
- •Получение кислот
- •Химические свойства кислот
- •Получение оснований
- •Химические свойства оснований
- •Получение солей
- •Химические свойства средних солей
- •Числовые приставки
- •Систематические и тривиальные названия некоторых веществ
- •Систематические и международные названия некоторых сложных веществ
- •Названия наиболее распространенных кислот и их анионов
- •1.2. Контрольные вопросы и задания
- •1.3. Примеры решения задач
- •1.4. Индивидуальные задания
- •Варианты контрольного задания
- •Варианты контрольного задания
- •1.5. Тестовые задания
- •Тема 2. Способы выражения концентрации (состава) раствора.
- •2.1. Теоретические сведения
- •2.2. Контрольные вопросы и задания
- •2.3. Примеры решения задач
- •2.4. Индивидуальные задания
- •Варианты контрольного задания
- •2.5. Тестовые задания
- •Тема 3. Химическая термодинамика.
- •3.1. Теоретические сведения
- •3.2. Контрольные вопросы и задания
- •3.3. Примеры решения задач
- •Стандартные термодинамические функции
- •3.4. Индивидуальные задания
- •Варианты контрольного задания
- •Варианты контрольного задания
- •3.5. Тестовые задания
- •Тема 4. Химическая кинетика. Термодинамика химического равновесия
- •4.1.Теоретические сведения
- •4.2. Контрольные вопросы и задания
- •4.3. Примеры решения задач
- •4.4. Индивидуальные задания
- •Варианты контрольного задания
- •4.5. Тестовые задания
- •Тема 5. Строение атома. Периодический закон и периодическая система элементов д.И. Менделеева. Химическая связь и строение соединений. Межмолекулярные взаимодействия.
- •5.1. Теоретические сведения
- •Основные характеристики протона, нейтрона и электрона
- •Корпускулярно-волновые свойства частиц
- •Число подуровней на энергетических уровнях
- •Число орбиталей на энергетических подуровнях
- •Последовательность заполнение атомных орбиталей
- •Электронные формулы элементов
- •Потенциалы (энергии) ионизации i1, эВ
- •Потенциалы (энергии) ионизации i1, эВ элементов V группы
- •Значение энергии (Eср) сродства к электрону для некоторых атомов.
- •Относительная электроотрицательность элементов
- •Свойства веществ в разных агрегатных состояниях
- •Сравнительная характеристика аморфных и кристаллических веществ
- •Свойства кристаллических решеток
- •5.2. Контрольные вопросы и задания
- •5.3. Примеры решения задач
- •План характеристики элемента по положению в Периодической системе д.И. Менделеева
- •5.4. Индивидуальные задания
- •Варианты контрольного задания
- •Исходные данные
- •5.5. Тестовые задания
- •Тема 6. Реакции с переносом электронов. Окислительно-восстановительные равновесия и процессы
- •6.1. Теоретические сведения
- •Характеристика элементов и их соединений в овр
- •Типы овр
- •Составление уравнений окислительно-восстановительных реакций
- •Участие ионов в различных средах
- •Стандартные электродные потенциалы металлов
- •6.2. Контрольные вопросы и задания
- •6.3. Примеры решения задач
- •6.4. Индивидуальные задания
- •Варианты контрольного задания
- •Исходные данные
- •6.5. Тестовые задания
- •Тема 7. Лигандообменные равновесия и процессы. Комплексные соединения
- •Координационные числа ионов - комплексообразователей
- •Основные комплексообразователи в кс
- •Среднее поле
- •Слабое поле
- •Геометрическая структура кс и тип гибридизации
- •Видимый спектр длин волн (нм) и окраска кс при их поглощении
- •Варианты контрольного задания
- •Тема 8. Осмотические свойства растворов. Протолитические равновесия и процессы. Электролитическая ионизация. Степень и константа ионизации
- •Теория электролитической ионизации (диссоциации).
- •Варианты контрольного задания
- •Тема 9. Гетерогенные равновесия и процессы. Произведение растворимости, условия образования и растворения осадков
- •Условия смещения гетерогенного равновесия:
- •Варианты контрольного задания
- •Тема 10. Ионное произведение воды. РН. Гидролиз солей
- •Изменение окраски некоторых индикаторов
- •Примеры буферных растворов.
- •Уравнения Гендерсона – Гассельбаха
- •Варианты контрольного задания
- •Объем учебной дисциплины «Общая и неорганическая химия» и виды учебной работы для студентов очного отделения фармацевтического факультета
- •Календарный план лабораторных занятий по общей и неорганической химии для студентов дневного отделения фармацевтического факультета
- •I семестр (продолжительность - 5 часов)
- •Календарный план лекций по общей и неорганической химии для студентов дневного отделения фармацевтического факультета
- •I семестр (продолжительность - 2 часа)
- •Название важнейших кислот и солей.
- •Значения некоторых фундаментальных физческих постоянных
- •Термодинамические свойства веществ.
- •Стандартные электродные потенциалы (е0) некоторых систем
- •Константы устойчивости комплексных ионов
- •Константы нестойкости некоторых комплексных ионов
- •Константы ионизации кислот и оснований (Ки)
- •Коэффициенты активности (f) ионов при ионных силах раствора
- •Растворимость кислот, оснований и солей в воде
- •Константы растворимости
- •Ответы тестовых заданий
- •Оглавление
Тема 7. Лигандообменные равновесия и процессы. Комплексные соединения
Теоретические сведения
Многие ионы способны присоединять к себе молекулы или противоположные ионы и превращаться в более сложные ионы, называемые комплексными.
Комплексные соединения (КС) – это соединения в узлах кристаллов которых находятся комплексные ионы, способные к самостоятельному существованию в растворе. В формулах КС комплексные ионы заключают в квадратные скобки.
CoCl3 + 6NH3 = [Co(NH3)6]Cl3 Со3+ + 6NH3 = [Co(NH3)6]3+
CuSO4 +4NH3 = [Cu(NH3)4] SO4 Cu2+ + 4NH3 = [Cu(NH3)4]2+
3KCN + Fe(CN)3 = K3[Fe(CN)6] 3CN- + Fe(CN)3 = [Fe(CN)6]3-
Причиной комплексообразования является электростатическое и донорно-акцепторное взаимодействие между ионами, между ионами и молекулами, между молекулами.
Строение комплексных соединений
В 1893 г. А.Вернер сформулировал положения, заложившие основу координационной теории.
Принцип координации: координирующий атом или ион (Меn+) окружён противоположно заряженными ионами или нейтральными молекулами, образующими геометрически правильную структуру (рис. 27).

Рис. 27 Строение комплексного соединения K3[CoF6] – гексафторокобальтата (III) калия
Координирующий атом или ион является центральным в этой структуре и называется комплексообразователем, а окружающие его частицы (ионы, молекулы) называются лигандами или аддендами, которые и образуют симметричную фигуру.
В качестве лигандов выступают обычно анионы (Cl-, NO2-, I-, Br-, S2O32-, CO32-, C2O42-, CN-, S2-, SCN-, OH-, F-, Cl-), нейтральные молекулы (неорганические и органические): H2O, NH3, CO, N2, (C2H5)3N, (C6H5)3P и, очень редко, - катионы (например, NO+).
Лиганды могут занимать одно, два, три, и более мест вокруг центрального атома. Число мест (связей), занимаемых одним лигандом с центральным атомом, называется дентатностью лиганда. Встречаются моно-, би-, полидентатные лиганды. К бидентантным лигандам относятся многие органические молекулы:
этилендиамин диметилглиоксим дианион щавелевой кислоты
Н2N-CH2-CH2-NH2 Н3С-С-С-СН3
-ООС-СОО-
HON NOH
Лиганды, содержащие более одного донорного атома называются полидентантными или хелатирующими (от греческого слова chelate – клешня), а комплексы с такими лигандами - хелатными. Хелатные комплексы более устойчивы.
Известны лиганды с координационным числом, равным тем, четырем и более, наиболее часто встречаются с четырьмя и шести. Ниже приведены комплексы меди (II) с монодентантным лигандом аммиаком (а) и бидентантным – этилендиамином (б):

Кислородосодержащие анионы (СО32-, SO22-) могут быть как монодентантными, так и бидентантными лигандами, Например,

Полидентантные лиганды часто образуют с центральным атомом разные связи: донорно-акцепторные и ковалентные. Это характерно для аминокислот и других органических соединений, содержащих одновременно амино- и гидроксигруппы. Например, при растворении осадка Cu(OH)2 в аминоуксусной кислоте (глицин) с образованием хелатного комплекса глицината меди.
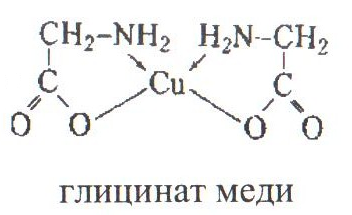
Подобные КС называются внутрикомплексными. Такие соединения обладают гидролитической устойчивостью, низкой растворимостью в воде и высокой в органических растворителях, часто специфической яркой окраской. На этом основано их использование в аналитической химии (диметилглиоксим – реактив для обнаружения Ni2+).
Наряду с моноядерными комплексами, содержащими один нейтральный атом, существуют полиядерные, имеющие в своем составе два или несколько центральных атомов – комплексообразователей. Среди них различают:
а) многоядерные комплексы с мостиковыми связями, в которых каждые два центральных атома могут быть соединены с одним, двумя или тремя мостиковыми лигандами одновременно:

б) кластерные комплексы с прочными (одинарными или кратными) связями между центральными атомами (связь металл-металл). В них центральные атомы помимо прямых связей могут соединяться друг с другом еще и мостиковыми лигандами:
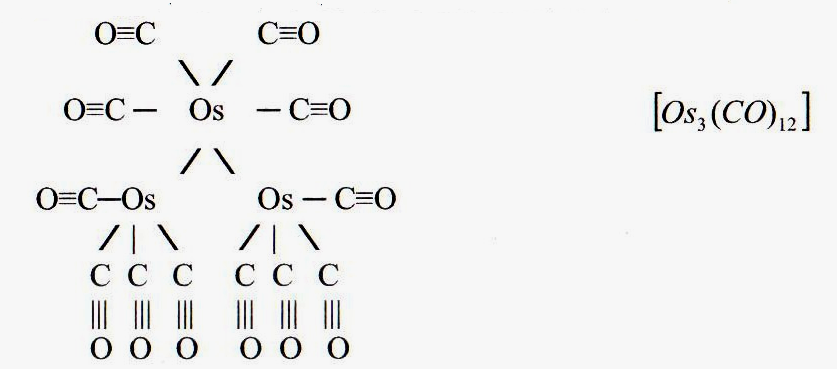
В кристалле CsReCl4 образующийся комплексный анион [Re3Cl12]3-, характеризуется наличием равностороннего треугольника из атомов рения:
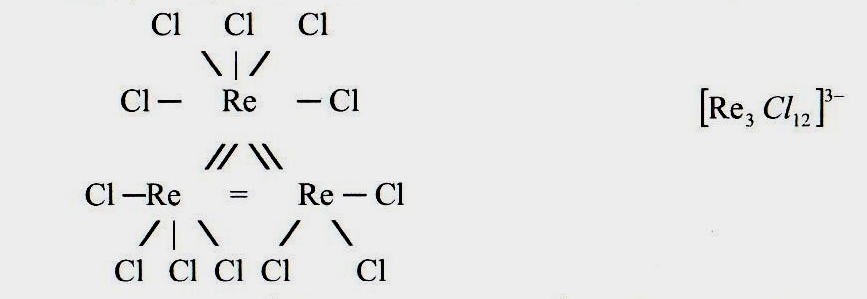
в) изополисоединения (изополикислоты) – многоядерные соединения с комплексными анионами, в которых комплексообразователями являются атомы одного и того же элемента, а в качестве лигандов, в том числе и мостиковых, выступают оксид ионы О2-, например, изополикислоты H2Cr2O7, H2Cr3O10, Н2В4О7, Н2Р2О7, Н4Р2О7, и их соли.
г) гетерополисоединений (гетерополикислоты) – многоядерные соединения, в комплексных анионах которых содержатся центральные атомы разных элементов, а в качестве лигандов (в том числе мостиковых) выступают оксид ионы О2-, например, гетерополикислоты с общей формулой Н8-n[MnM12VIO40], где Mn – BIII, SiIV, GeIV, TiIV, PV; MVI – Mo или W, а также их соли, полученные замещением водорода на эквивалентное число катионов Li+, Na+, K+, Rb+, Cs+, Mg2+, Ba2+, Ag+, NH4+. Например, H4SiO4×12WO3×nH2O – кремнефольфрамовая кислота, которой соответствует соль K8[Si(W2O7)6].
д) в последние годы в практику аналитической химии вошли разнолигандные (MRjRi) и разнометалльные комплексы (MRMI), в том числе с мостиковыми полифункциональными лигандами.
е) естественные и синтетические макроциклы – полидентантные лиганды (валиномицин, 18-краун-6, сферанды), а также макрополициклические криптанды и криптосфиранды:

Краун-эфиры, криптанды, сферанды содержат или сфероидальные плоскости, отвечающие размеру катиона (щелочного, щелочноземельного, редкоземельного элемента) или аниона (F-, Cl-, O2-) способны прочно связывать их в комплексы. Эти соединения, кроме того, способны растворяться как в полярных (вода), так и в неполярных растворителях, так как содержат гидрофильную внутреннюю и гидрофобную внешнюю наружную части. Слово «краун» образовано от слова «корона»; «криптат» обозначает комплекс, в котором катион скрыт внутри молекулярной полости лиганды, получивший название «криптанд».Эти соединения могут использоваться для распознания сферических субстратов (катионов щелочных, щелочноземельных, редкоземельных металлов, ионов аммония, анионов галогенов), а также в органической химии, биологии и фармации при изучении механизма переноса ионов через клеточные мембраны. Криптанды-макробициклические лиганды связывают катионы еще более специфичнее, чем краут-эфиры. Валаномицин (макроциклический антибиотик-полипептид) обладает свойствами ионофора, т.е. спосоен переносить катион калия через мембрану.
Число координационных мест (лигандов) вокруг центрального атома называется его координационным числом (К.ч.), которое зависит от природы комплексообразователя и лиганд. Координационное число имеет значение от 2 до 12 (табл. 43).
В качестве центрального атома в комплексах обычно выступают катионы, иногда - атомы и редко - отрицательные ионы (табл. 44).
Комплексообразователь и лиганды образуют внутреннюю координационную сферу, её ограничивают квадратными скобками:[Fe(CN)6]3- или [ ]
Ионы, нейтрализующие заряд комплексного иона, образуют внешнюю координационную сферу комплексного соединения: K+ (рис. 28).
Заряд в комплексных ионах равен алгебраической сумме зарядов комплексообразователя и лигандов.
Таблица 43
