
- •C.М. Дрюцкая
- •Введение
- •Тема 1. Введение. Классы и номенклатура неорганических соединений. Основные законы и понятия химии. Закон эквивалентов.
- •1.1. Теоретические сведения
- •Химические свойства оксидов
- •Получение кислот
- •Химические свойства кислот
- •Получение оснований
- •Химические свойства оснований
- •Получение солей
- •Химические свойства средних солей
- •Числовые приставки
- •Систематические и тривиальные названия некоторых веществ
- •Систематические и международные названия некоторых сложных веществ
- •Названия наиболее распространенных кислот и их анионов
- •1.2. Контрольные вопросы и задания
- •1.3. Примеры решения задач
- •1.4. Индивидуальные задания
- •Варианты контрольного задания
- •Варианты контрольного задания
- •1.5. Тестовые задания
- •Тема 2. Способы выражения концентрации (состава) раствора.
- •2.1. Теоретические сведения
- •2.2. Контрольные вопросы и задания
- •2.3. Примеры решения задач
- •2.4. Индивидуальные задания
- •Варианты контрольного задания
- •2.5. Тестовые задания
- •Тема 3. Химическая термодинамика.
- •3.1. Теоретические сведения
- •3.2. Контрольные вопросы и задания
- •3.3. Примеры решения задач
- •Стандартные термодинамические функции
- •3.4. Индивидуальные задания
- •Варианты контрольного задания
- •Варианты контрольного задания
- •3.5. Тестовые задания
- •Тема 4. Химическая кинетика. Термодинамика химического равновесия
- •4.1.Теоретические сведения
- •4.2. Контрольные вопросы и задания
- •4.3. Примеры решения задач
- •4.4. Индивидуальные задания
- •Варианты контрольного задания
- •4.5. Тестовые задания
- •Тема 5. Строение атома. Периодический закон и периодическая система элементов д.И. Менделеева. Химическая связь и строение соединений. Межмолекулярные взаимодействия.
- •5.1. Теоретические сведения
- •Основные характеристики протона, нейтрона и электрона
- •Корпускулярно-волновые свойства частиц
- •Число подуровней на энергетических уровнях
- •Число орбиталей на энергетических подуровнях
- •Последовательность заполнение атомных орбиталей
- •Электронные формулы элементов
- •Потенциалы (энергии) ионизации i1, эВ
- •Потенциалы (энергии) ионизации i1, эВ элементов V группы
- •Значение энергии (Eср) сродства к электрону для некоторых атомов.
- •Относительная электроотрицательность элементов
- •Свойства веществ в разных агрегатных состояниях
- •Сравнительная характеристика аморфных и кристаллических веществ
- •Свойства кристаллических решеток
- •5.2. Контрольные вопросы и задания
- •5.3. Примеры решения задач
- •План характеристики элемента по положению в Периодической системе д.И. Менделеева
- •5.4. Индивидуальные задания
- •Варианты контрольного задания
- •Исходные данные
- •5.5. Тестовые задания
- •Тема 6. Реакции с переносом электронов. Окислительно-восстановительные равновесия и процессы
- •6.1. Теоретические сведения
- •Характеристика элементов и их соединений в овр
- •Типы овр
- •Составление уравнений окислительно-восстановительных реакций
- •Участие ионов в различных средах
- •Стандартные электродные потенциалы металлов
- •6.2. Контрольные вопросы и задания
- •6.3. Примеры решения задач
- •6.4. Индивидуальные задания
- •Варианты контрольного задания
- •Исходные данные
- •6.5. Тестовые задания
- •Тема 7. Лигандообменные равновесия и процессы. Комплексные соединения
- •Координационные числа ионов - комплексообразователей
- •Основные комплексообразователи в кс
- •Среднее поле
- •Слабое поле
- •Геометрическая структура кс и тип гибридизации
- •Видимый спектр длин волн (нм) и окраска кс при их поглощении
- •Варианты контрольного задания
- •Тема 8. Осмотические свойства растворов. Протолитические равновесия и процессы. Электролитическая ионизация. Степень и константа ионизации
- •Теория электролитической ионизации (диссоциации).
- •Варианты контрольного задания
- •Тема 9. Гетерогенные равновесия и процессы. Произведение растворимости, условия образования и растворения осадков
- •Условия смещения гетерогенного равновесия:
- •Варианты контрольного задания
- •Тема 10. Ионное произведение воды. РН. Гидролиз солей
- •Изменение окраски некоторых индикаторов
- •Примеры буферных растворов.
- •Уравнения Гендерсона – Гассельбаха
- •Варианты контрольного задания
- •Объем учебной дисциплины «Общая и неорганическая химия» и виды учебной работы для студентов очного отделения фармацевтического факультета
- •Календарный план лабораторных занятий по общей и неорганической химии для студентов дневного отделения фармацевтического факультета
- •I семестр (продолжительность - 5 часов)
- •Календарный план лекций по общей и неорганической химии для студентов дневного отделения фармацевтического факультета
- •I семестр (продолжительность - 2 часа)
- •Название важнейших кислот и солей.
- •Значения некоторых фундаментальных физческих постоянных
- •Термодинамические свойства веществ.
- •Стандартные электродные потенциалы (е0) некоторых систем
- •Константы устойчивости комплексных ионов
- •Константы нестойкости некоторых комплексных ионов
- •Константы ионизации кислот и оснований (Ки)
- •Коэффициенты активности (f) ионов при ионных силах раствора
- •Растворимость кислот, оснований и солей в воде
- •Константы растворимости
- •Ответы тестовых заданий
- •Оглавление
3.5. Тестовые задания
Формулировкой I закона термодинамики является:
а) В реакциях, протекающих при постоянном давлении, изменение энтальпии равно изобарному тепловому эффекту реакции, взятому с противоположным знаком.
б) Тепловой эффект реакции зависит от химической природы и агрегатного состояния исходных веществ и продуктов, но не зависит от пути ее протекания.
в) В изолированной системе самопроизвольно протекают процессы в направлении большего беспорядка или наиболее вероятного существования системы.
г) Энергия не может ни появляться, ни исчезать, она может только переходить из одного состояния в другое.
2. Реакция невозможна при любых температурах в случае:
а) ΔH > 0, ΔS > 0 в) ΔH < 0, ΔS < 0
б) ΔH > 0, ΔS < 0 г) ΔH < 0, ΔS = 0
3. Указать знак ΔG процесса таяния льда при 273 К:
а) ΔG > 0 б) ΔG = 0 в) ΔG < 0 г) ΔG =
4. Реакция возможна при любых температурах в случае:
а) ΔH > 0, ΔS > 0 в) ΔH < 0, ΔS < 0
б) ΔH < 0, ΔS > 0 г) ΔH = 0, ΔS < 0
5. Укажите, для какого процесса энтропия увеличивается
а)
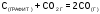 в)
в)
б)
 г)
г)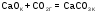
6. Укажите термохимическое уравнение реакции, выражающее эндотермический процесс:
а)

б)

в)

г)

7. С увеличением энтропии протекают процессы
а) нагревание б) испарение в) кристаллизация г) конденсация
8.
В результате реакции, термохимическое
уравнение которой
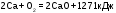 ,
выделилось 1906,5 кДж, масса кальция
вступившего в реакцию составила______г
,
выделилось 1906,5 кДж, масса кальция
вступившего в реакцию составила______г
а) 40 б) 80 в) 120 г) 135
9. Максимальное значение энтропии имеет
а) С (алмаз) б) С (графит) в) СО2 (Г) г) СО(Г)
10. Тепловой эффект реакции зависит от начального и конечного состояния системы и не зависит от ее промежуточных состояний, закон _________ .
Тема 4. Химическая кинетика. Термодинамика химического равновесия
4.1.Теоретические сведения
Кинетика химических реакций - учение о химических процессах, о законах их протекания во времени, скоростях и механизмах.
С исследованиями кинетики химических реакций связаны важнейшие направления современной химии и химической промышленности: разработка рациональных принципов управления химическими процессами; стимулирование полезных и торможение и подавление нежелательных химических реакций; создание новых и усовершенствование существующих процессов и аппаратов в химической технологии; изучение поведения химических продуктов, материалов и изделий из них в различных условиях применения и эксплуатации.
Скоростью
химической реакции
называют изменение количества вещества
в единицу времени в единице реакционного
пространства. Различают гомогенные и
гетерогенные реакции. Если вещества
находятся в одной фазе, то такая реакция
– гомогенная,
если в разных фазах – гетерогенная.
Скорость гомогенной реакции
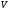 определяется изменением концентрации
одного из реагирующих веществ в единицу
времени:
определяется изменением концентрации
одного из реагирующих веществ в единицу
времени:
,
 (40)
(40)
где
 ,
изменение концентрации вещества, знак
(+), если скорость определяется по
изменению концентрации продуктов
реакции, знак (-), если скорость оценивается
по убыли концентрации одного из исходных
веществ.
,
изменение концентрации вещества, знак
(+), если скорость определяется по
изменению концентрации продуктов
реакции, знак (-), если скорость оценивается
по убыли концентрации одного из исходных
веществ.
Скорость реакции в СИ имеет единицу измерения [моль/м3с], однако также используются и другие единицы измерения [моль/лс], [моль/см3с], [моль/см3мин].
Скорость реакции зависит от многих факторов. На нее влияют природа и концентрация реагентов, давление (для реакций с участием газов), температура, катализатор, примеси и их концентрации, степень измельчения (в реакциях с участием твердых веществ), среда (для реакций в растворах), форма сосуда (для цепных реакций), интенсивность света (для фотохимических реакций), потенциал электродов (для электрохимических реакции), мощность дозы излучения (для радиационно-химических процессов). Основными параметрами, которые приходится учитывать при изучении кинетики процессов, являются природа реагирующих веществ, концентрации (давления) реагентов, температура и действие катализатора.
Природа реагирующих веществ определяется типом химических связей и строением молекул. Реакция протекает в направление разрушения менее прочных связей и образования вещества с более прочными связями.
Влияние концентрации на скорость реакций. Чтобы осуществлялось химическое взаимодействие веществ А и В, их молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает реакция. Число же столкновений тем больше, чем выше концентрация реагирующих веществ. Отсюда на основе обширного экспериментального материала сформулирован основной закон химической кинетики открытый в 1864-1867 гг. Гульдбергом и Вааге (Норвегия) (закон действующих масс), устанавливающий зависимость скорости реакции от концентрации реагирующих веществ.
Закон действующих масс (ЗДМ): скорость элементарной реакции пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам.
Для реакции аА + вВ = сС + dD этот закон выразится уравнением:
 ,
(41)
,
(41)
где
 и
и - концентрации веществ А и В, моль/дм3;
- концентрации веществ А и В, моль/дм3;
 -
коэффициентпропорциональности,
называемый константой скорости реакции.
-
коэффициентпропорциональности,
называемый константой скорости реакции.
Из
уравнения нетрудно установить физический
смысл
константы скорости
 :
она численно равна скорости реакции,
когда концентрации каждого из реагирующих
веществ составляют 1 моль/дм3
или когда их произведение равно единице.
Константа скорости реакции зависит от
природы реагирующих веществ и от
температуры, но не зависит от их
концентраций.
:
она численно равна скорости реакции,
когда концентрации каждого из реагирующих
веществ составляют 1 моль/дм3
или когда их произведение равно единице.
Константа скорости реакции зависит от
природы реагирующих веществ и от
температуры, но не зависит от их
концентраций.
Уравнение, связывающее скорость реакции с концентрацией реагирующих веществ, называется кинетическим уравнением реакции. Если опытным путем определено кинетическое уравнение реакции, то с его помощью можно вычислять скорости при других концентрациях тех же реагирующих веществ.
Молекулярность и порядок реакций. В химической кинетике реакции классифицируются по двум параметрам: по молекулярности и по порядку реакции. Число молекул, участвующих в элементарном акте химического взаимодействия, называется молекулярностью (М) реакции. По этому параметру различают реакции мономолекулярные, бимолекулярные и т. д. Вероятность одновременного соударения многих частиц очень мала, поэтому тримолекулярные реакции редки, а четырехмолекулярные вообще неизвестны. Для тримолекулярных элементарных реакций, когда реагируют одна молекула А и две молекулы В, уравнение закона действия масс имеет вид:
 (42)
(42)
Сумма показателей степеней в кинетических уравнениях называется общим (суммарным) порядком реакции (n).
Таким образом, порядок реакции определяет характер зависимости скорости от концентрации реагентов. Для элементарных реакций молекулярность и порядок реакции совпадают.
Если процесс многостадиен, запись уравнения реакции лишь фиксирует исходное и конечное состояние системы, не раскрывая механизма процесса, порядки реакции по реагентам, как правило, не совпадают со стехиометрическими коэффициентами, а общий порядок реакции не равен сумме стехиометрических коэффициентов, то в этом случае для расчета скорости используют основное кинетическое уравнение:
 ,
(43)
,
(43)
где
 и
и ‑ коэффициенты, называемые порядками
реакции по веществамA
и В.
‑ коэффициенты, называемые порядками
реакции по веществамA
и В.
В случае гетерогенной реакции реакционным пространством можно считать поверхность раздела фаз, и скорость реакции первого порядка описывается уравнением:
 (44)
(44)
где
 - концентрация реагента (газообразного
или жидкого),
- концентрация реагента (газообразного
или жидкого),
 -
площадь поверхности (м2).
-
площадь поверхности (м2).
Так же для гетерогенных реакций скорость зависит от скорости подвода реагента и от скорости удаления продуктов реакции из реакционного пространства.
Влияние температуры на скорость реакции.
При повышении температуры на каждые 10 0скорость большинства химических реакций увеличивается в 2-4 раза, и, наоборот, при понижении температуры – понижается соответственно во столько же раз.
Зависимость скорости реакции от температуры приближенно выражается уравнением Вант-Гоффа:
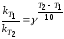 (45)
(45)
где
 и
и —
константы скорости при температурахТ1
и
Т2;
—
константы скорости при температурахТ1
и
Т2;
 —
температурный
коэффициент скорости реакции (коэффициент
Вант-Гоффа),
для
многих реакций у лежит в пределах 2-4.
—
температурный
коэффициент скорости реакции (коэффициент
Вант-Гоффа),
для
многих реакций у лежит в пределах 2-4.
Аналогично для скорости реакции справедливо выражение:
 (46)
(46)
где
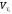 и
и ,
— скорости реакции при температурахТ1
и
Т2
соответственно.
,
— скорости реакции при температурахТ1
и
Т2
соответственно.
Шведский
ученый С. Аррениус на основании
экспериментальных данных
показал, что число активных частиц, а,
следовательно, скорость
и константа скорости возрастает с
температурой по экспоненциальному
закону. Выведенная им зависимость
константы скорости
 от
температуры
Т называется
уравнением
Аррениуса:
от
температуры
Т называется
уравнением
Аррениуса:
 (47)
(47)
где
k0
-
предэкспоненциальный множитель; R
-
универсальная газовая постоянная
(8,31 Дж/(моль К); Т-
абсолютная температура;
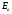 -
энергия активации, т.е. минимальная
энергия, которой должны обладать
сталкивающие молекулы, чтобы преодолеть
потенциальный барьер, разделяющий
исходное и конечное состояние системы.
Понятие «энергия активации» позволяет
свести все многообразие молекул различных
веществ к обобщенной энергетической
характеристике. Она зависит от природы
реагирующих веществ и определяет
механизм протекания реакции. Энергию
активации определяют опытным путем и
выражают в кДж/моль. Если энергия
активации меньше 40 кДж/моль, то такая
реакция протекает практически мгновенно.
Реакции с
-
энергия активации, т.е. минимальная
энергия, которой должны обладать
сталкивающие молекулы, чтобы преодолеть
потенциальный барьер, разделяющий
исходное и конечное состояние системы.
Понятие «энергия активации» позволяет
свести все многообразие молекул различных
веществ к обобщенной энергетической
характеристике. Она зависит от природы
реагирующих веществ и определяет
механизм протекания реакции. Энергию
активации определяют опытным путем и
выражают в кДж/моль. Если энергия
активации меньше 40 кДж/моль, то такая
реакция протекает практически мгновенно.
Реакции с >
150 кДж/моль при комнатной температуре
не протекают.Энергия
активации — важнейшее понятие химической
кинетики
;
ее значения включают в специальные
справочники и используют в химической
технологии для расчета скоростей реакций
в различных условиях.
>
150 кДж/моль при комнатной температуре
не протекают.Энергия
активации — важнейшее понятие химической
кинетики
;
ее значения включают в специальные
справочники и используют в химической
технологии для расчета скоростей реакций
в различных условиях.
Уравнение Аррениуса позволяет проводить более точные расчеты изменения скорости реакции с увеличением температуры, чем уравнение (5). Уравнение Аррениуса позволяет рассчитать
- константы скорости реакций для различных температур:
 (48)
(48)
- энергию активации:
 (49)
(49)
- предэкспоненциальный множитель:
 (50)
(50)
Предэкспоненциальный множитель отражает частоту столкновения и ориентацию реагирующих частиц.
Влияние катализатора на скорость реакции.
Одним
из способов увеличения скорости реакции
является снижение энергетического
барьера, то есть уменьшение
 .
Это достигается введением катализаторов.Катализатор
– вещество, влияющее на скорость реакции,
но к концу реакции остаются химически
неизменными. Вещества, ускоряющие
химический процесс, называются
положительными катализаторами,
замедляющие – отрицательными
(ингибиторами). На применении катализаторов
основано получение большинства продуктов
химического производства. Каталитическое
действие является основой жизнедеятельности
и в природе. Все химические превращения
в организмах инициируются особыми
катализаторами – ферментами.
.
Это достигается введением катализаторов.Катализатор
– вещество, влияющее на скорость реакции,
но к концу реакции остаются химически
неизменными. Вещества, ускоряющие
химический процесс, называются
положительными катализаторами,
замедляющие – отрицательными
(ингибиторами). На применении катализаторов
основано получение большинства продуктов
химического производства. Каталитическое
действие является основой жизнедеятельности
и в природе. Все химические превращения
в организмах инициируются особыми
катализаторами – ферментами.
Действие катализатора специфично и обусловлено природой катализатора, его физическими свойствами и способом предварительной обработки.
Катализ – изменение скорости химической реакции веществами (катализаторами), которые участвуют в промежуточных стадиях реакции, но не входят в состав конечных продуктов.
В зависимости от того, находится ли катализатор в той же фазе, что и реагирующие вещества, или образует самостоятельную фазу, говорят о гомогенном или гетерогенном катализе. Механизм каталитического действия для них не одинаков, однако и в том и в другом случае происходит ускорение реакции за счет снижения Ea (рис. 6). Каталитическое действие также зависит от концентрации введенного катализатора.
Активность катализатора в гетерогенном катализе зависит не только от его природы, но и от величины поверхности. В связи с этим катализатор должен обладать либо пористой структурой, либо находиться в высокодисперсном состоянии. Активность катализатора в данном случае обусловлена избыточной поверхностной энергией за счет дефектов кристаллической решетки.

Е,
кДж
Еа

150
100
Е/а

50
А+Б
С+Д
Координата реакции
Рис. 6. Влияние катализатора на энергию активации реакции:
1
– без катализатора ( =
157 кДж/моль); 2 – с катализатором (
=
157 кДж/моль); 2 – с катализатором (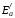 =
62 кДж/моль)
=
62 кДж/моль)
Общие закономерности каталитических реакций:
- катализатор обладает специфичным, избирательным действием
- катализирует только энергетически возможные реакции (ΔG 0)
- ускоряет как прямую, так и обратную реакцию в одинаковое число раз
- не расходуется в реакции, изменяет число и характер элементарных стадий.
Особенности ферментативных реакций:
- особо высокая специфичность действия (только на один изомер, на определенные химические связи), которые зависят от структуры субстрата
- каталитическая активность намного превосходит активность неорганических катализаторов (1 моль неорганического катализатора – Fe2+ за 1 сек при температуре 0 0С разлагает 10-5 моль Н2О2, а такое же количество фермента – каталазы при той же температуре за то же время разлагает 105 моль Н2О2)
- скорость ферментативного катализа намного выше неорганического
- ферменты катализируют реакции в «мягких» условиях (рН≈7, t=37 0С, р=101,3 кПа)
- уникальное свойство ферментов – регулируемая активность, позволяющая изменять скорость превращений в организме в зависимости от условий
- скорость ферментативной реакции прямо пропорциональна количеству фермента
- действие ферментов зависит от присутствия специфических активаторов и ингибиторов
- локализация ферментов в определенных субклеточных структурах.
Поэтому в биотехнологии практикуется иммобилизация – закрепление фермента на носителях (целлюлоза и ее производные, гель полиакриламида, сефадексы, нейлон, крахмал, коллодий, алюмосиликаты, оксиды металлов и др.)
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Различают обратимые и необратимые реакции. Необратимыми реакциями называются такие, после протекания которых, систему и внешнюю среду одновременно нельзя вернуть в прежнее состояние. Они идут в одном направлении до полного расходования одного из реагирующих веществ.
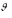 прямой
р-ии >>
прямой
р-ии >>
 обратной
р-ии
обратной
р-ии
Многие химические реакции являются обратимыми, т.е. одновременно протекают в двух противоположных направлениях и не доходят до конца. Особенность обратимых реакций состоит в том, что по мере накопления продуктов реакции возрастает скорость обратной реакции. Если они сравняются, то наступает равновесное состояние.
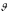 прямой
р-ии =
прямой
р-ии =
 обратной
р-ии
обратной
р-ии
Химическое
равновесие характеризуется константой
химического равновесия
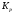 .
.
Для реакции аА + вВ сС + dD, из ЗДМ следует:
 (51)
(51)
где
 и
и -
константы скоростей прямой и обратной
реакций,
-
константы скоростей прямой и обратной
реакций, - равновесные концентрации веществ
соответственно. В условиях равновесия
концентрации всех реагентов связаны
друг с другом, и изменение одной из них
вызовет изменение других, только
соотношение равновесных концентраций
останется постоянным при данной
температуре.
- равновесные концентрации веществ
соответственно. В условиях равновесия
концентрации всех реагентов связаны
друг с другом, и изменение одной из них
вызовет изменение других, только
соотношение равновесных концентраций
останется постоянным при данной
температуре.
 -
константа
равновесия
– определяется отношением произведений
равновесных концентраций продуктов
реакции на произведение равновесных
концентраций исходных веществ, взятых
в степенях их стехиометрических
коэффициентов.
В выражение константы равновесия входят
только концентрации газообразных и
растворенных веществ.
-
константа
равновесия
– определяется отношением произведений
равновесных концентраций продуктов
реакции на произведение равновесных
концентраций исходных веществ, взятых
в степенях их стехиометрических
коэффициентов.
В выражение константы равновесия входят
только концентрации газообразных и
растворенных веществ.
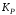 для данной реакции при данной температуре
величина постоянная.
для данной реакции при данной температуре
величина постоянная. -
зависит от температуры, природы
реагирующих веществ и не зависит от
концентрации и присутствия катализатора.
Катализатор, ускоряя и прямую, и обратную
реакцию, способствует скорейшему
установлению равновесия, но не оказывает
влияния на состояние равновесия.
-
зависит от температуры, природы
реагирующих веществ и не зависит от
концентрации и присутствия катализатора.
Катализатор, ускоряя и прямую, и обратную
реакцию, способствует скорейшему
установлению равновесия, но не оказывает
влияния на состояние равновесия.
Константа
химического равновесия может быть
рассчитана из изотермы Вант-Гоффа при
 =0,
являющейся термодинамическим условием
химического равновесия:
=0,
являющейся термодинамическим условием
химического равновесия:
 (52)
(52)
следовательно

Константа
равновесия имеет большое теоретическое
значение и практическое значение. По
ее величине можно судить о полноте
протекания реакции. Если
 >
1, то равновесие смещается в сторону
прямой реакции, если
>
1, то равновесие смещается в сторону
прямой реакции, если
 <
1 – в сторону обратной. При
<
1 – в сторону обратной. При =1
реакция находится в химическом равновесии.
Тем не менее, состояние равновесия
процесс динамический, поэтому значения
константы равновесия позволяют судить
о его сдвиге в ту или иную сторону.
=1
реакция находится в химическом равновесии.
Тем не менее, состояние равновесия
процесс динамический, поэтому значения
константы равновесия позволяют судить
о его сдвиге в ту или иную сторону.
СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ (Принцип Ле Шателье)
Равновесие можно сместить внешним воздействием, руководствуясь принципом Ле Шателье: если на равновесную систему оказывать внешнее воздействие, то равновесие смещается в сторону той реакции, которая способствует ослаблению этого воздействия.
Влияние температуры. Для реакций, идущих с уменьшением энтальпии (экзотермических), повышение температуры будет препятствовать протеканию прямого процесса, то есть смещать реакцию в сторону исходных веществ. Эндотермические реакции при этом будут смещаться в сторону конечных продуктов.
Например, при обычных условиях реакция N2 + O2 не идет (ΔH>0), но повышение температуры может сделать эти реакцию осуществимой. Реакция CO+1/2O2=CO2, ΔH<0 с повышением температуры будут смещаться в сторону исходных веществ.
Влияние давления. Если реагируют газообразные вещества, то при неизменном числе молей начальных и конечных реагентов повышение общего давления не приведет к смещению равновесия. Если число молей при реакции меняется, то изменение общего давления приведет к смещению равновесия. В частности, реакция 2CO+O2=2CO2, протекающая с уменьшением количества вещества, при повышении общего давления сместится в сторону образования СO2.
Влияние концентраций. В тех реакциях, в которых лучше оперировать концентрациями (реакции в растворах), увеличение концентраций исходных веществ приводит к смещению равновесия в сторону конечных продуктов и наоборот.
Так, в реакции этерификации (образование сложного эфира) увеличение концентрации уксусной кислоты или этанола увеличивает выход этилацетата, а добавление в систему воды приводит к омылению, т. е. образованию исходных продуктов реакции.

