
- •C.М. Дрюцкая
- •Введение
- •Тема 1. Введение. Классы и номенклатура неорганических соединений. Основные законы и понятия химии. Закон эквивалентов.
- •1.1. Теоретические сведения
- •Химические свойства оксидов
- •Получение кислот
- •Химические свойства кислот
- •Получение оснований
- •Химические свойства оснований
- •Получение солей
- •Химические свойства средних солей
- •Числовые приставки
- •Систематические и тривиальные названия некоторых веществ
- •Систематические и международные названия некоторых сложных веществ
- •Названия наиболее распространенных кислот и их анионов
- •1.2. Контрольные вопросы и задания
- •1.3. Примеры решения задач
- •1.4. Индивидуальные задания
- •Варианты контрольного задания
- •Варианты контрольного задания
- •1.5. Тестовые задания
- •Тема 2. Способы выражения концентрации (состава) раствора.
- •2.1. Теоретические сведения
- •2.2. Контрольные вопросы и задания
- •2.3. Примеры решения задач
- •2.4. Индивидуальные задания
- •Варианты контрольного задания
- •2.5. Тестовые задания
- •Тема 3. Химическая термодинамика.
- •3.1. Теоретические сведения
- •3.2. Контрольные вопросы и задания
- •3.3. Примеры решения задач
- •Стандартные термодинамические функции
- •3.4. Индивидуальные задания
- •Варианты контрольного задания
- •Варианты контрольного задания
- •3.5. Тестовые задания
- •Тема 4. Химическая кинетика. Термодинамика химического равновесия
- •4.1.Теоретические сведения
- •4.2. Контрольные вопросы и задания
- •4.3. Примеры решения задач
- •4.4. Индивидуальные задания
- •Варианты контрольного задания
- •4.5. Тестовые задания
- •Тема 5. Строение атома. Периодический закон и периодическая система элементов д.И. Менделеева. Химическая связь и строение соединений. Межмолекулярные взаимодействия.
- •5.1. Теоретические сведения
- •Основные характеристики протона, нейтрона и электрона
- •Корпускулярно-волновые свойства частиц
- •Число подуровней на энергетических уровнях
- •Число орбиталей на энергетических подуровнях
- •Последовательность заполнение атомных орбиталей
- •Электронные формулы элементов
- •Потенциалы (энергии) ионизации i1, эВ
- •Потенциалы (энергии) ионизации i1, эВ элементов V группы
- •Значение энергии (Eср) сродства к электрону для некоторых атомов.
- •Относительная электроотрицательность элементов
- •Свойства веществ в разных агрегатных состояниях
- •Сравнительная характеристика аморфных и кристаллических веществ
- •Свойства кристаллических решеток
- •5.2. Контрольные вопросы и задания
- •5.3. Примеры решения задач
- •План характеристики элемента по положению в Периодической системе д.И. Менделеева
- •5.4. Индивидуальные задания
- •Варианты контрольного задания
- •Исходные данные
- •5.5. Тестовые задания
- •Тема 6. Реакции с переносом электронов. Окислительно-восстановительные равновесия и процессы
- •6.1. Теоретические сведения
- •Характеристика элементов и их соединений в овр
- •Типы овр
- •Составление уравнений окислительно-восстановительных реакций
- •Участие ионов в различных средах
- •Стандартные электродные потенциалы металлов
- •6.2. Контрольные вопросы и задания
- •6.3. Примеры решения задач
- •6.4. Индивидуальные задания
- •Варианты контрольного задания
- •Исходные данные
- •6.5. Тестовые задания
- •Тема 7. Лигандообменные равновесия и процессы. Комплексные соединения
- •Координационные числа ионов - комплексообразователей
- •Основные комплексообразователи в кс
- •Среднее поле
- •Слабое поле
- •Геометрическая структура кс и тип гибридизации
- •Видимый спектр длин волн (нм) и окраска кс при их поглощении
- •Варианты контрольного задания
- •Тема 8. Осмотические свойства растворов. Протолитические равновесия и процессы. Электролитическая ионизация. Степень и константа ионизации
- •Теория электролитической ионизации (диссоциации).
- •Варианты контрольного задания
- •Тема 9. Гетерогенные равновесия и процессы. Произведение растворимости, условия образования и растворения осадков
- •Условия смещения гетерогенного равновесия:
- •Варианты контрольного задания
- •Тема 10. Ионное произведение воды. РН. Гидролиз солей
- •Изменение окраски некоторых индикаторов
- •Примеры буферных растворов.
- •Уравнения Гендерсона – Гассельбаха
- •Варианты контрольного задания
- •Объем учебной дисциплины «Общая и неорганическая химия» и виды учебной работы для студентов очного отделения фармацевтического факультета
- •Календарный план лабораторных занятий по общей и неорганической химии для студентов дневного отделения фармацевтического факультета
- •I семестр (продолжительность - 5 часов)
- •Календарный план лекций по общей и неорганической химии для студентов дневного отделения фармацевтического факультета
- •I семестр (продолжительность - 2 часа)
- •Название важнейших кислот и солей.
- •Значения некоторых фундаментальных физческих постоянных
- •Термодинамические свойства веществ.
- •Стандартные электродные потенциалы (е0) некоторых систем
- •Константы устойчивости комплексных ионов
- •Константы нестойкости некоторых комплексных ионов
- •Константы ионизации кислот и оснований (Ки)
- •Коэффициенты активности (f) ионов при ионных силах раствора
- •Растворимость кислот, оснований и солей в воде
- •Константы растворимости
- •Ответы тестовых заданий
- •Оглавление
Число подуровней на энергетических уровнях
|
Главное квантовое число n |
Орбитальное число l |
Число подуровней |
Обозначение подуровня |
|
1 |
0 |
1 |
1s |
|
2 |
0, 1 |
2 |
2s2p |
|
3 |
0, 1, 2 |
3 |
3s3p3d |
|
4 |
0, 1, 2, 3 |
4 |
4s4p4d4f |
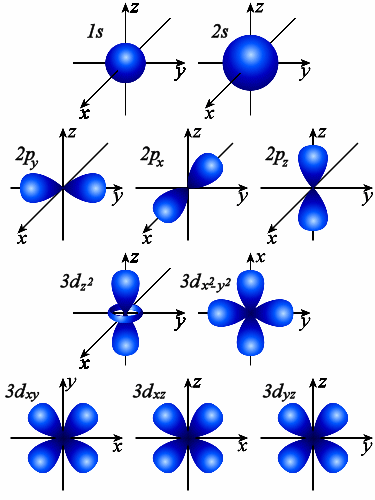
Рис. 7. Изображение форм и ориентаций
s-,p-,d-, орбиталей с помощью граничных поверхностей.
Квантовое число ml называют магнитным. Оно определяет пространственное расположение атомной орбитали и принимает целые значения от –l до +l через нуль, то есть 2l + 1 значений (табл. 27).
Орбитали одного подуровня (l = const) имеют одинаковую энергию. Такое состояние называют вырожденным по энергии. Так p-орбиталь – трехкратно, d – пятикратно, а f – семикратно вырождены. Граничные поверхности s-,p-,d-, орбиталей показаны на рис. 7.
s-орбитали сферически симметричны для любого n и отличаются друг от друга только размером сферы. Их максимально симметричная форма обусловлена тем, что при l = 0 и μl = 0.
Таблица 27
Число орбиталей на энергетических подуровнях
|
Орбитальное квантовое число |
Магнитное квантовое число |
Число орбиталей с данным значением l |
|
l |
ml |
2l + 1 |
|
0 (s) |
0 |
1 |
|
1 (p) |
–1, 0, +1 |
3 |
|
2 (d) |
–2, –1, 0, +1, +2 |
5 |
|
3 (f) |
–3, –2, –1, 0, +1, +2, +3 |
7 |
p-орбитали существуют при n ≥ 2 и l = 1, поэтому возможны три варианта ориентации в пространстве: ml = –1, 0, +1. Все p-орбитали обладают узловой плоскостью, делящей орбиталь на две области, поэтому граничные поверхности имеют форму гантелей, ориентированных в пространстве под углом 90° друг относительно друга. Осями симметрии для них являются координатные оси, которые обозначаются px, py, pz.
d-орбитали определяются квантовым числом l = 2 (n ≥ 3), при котором ml = –2, –1, 0, +1, +2, то есть характеризуются пятью вариантами ориентации в пространстве. d-орбитали, ориентированные лопастями по осям координат, обозначаются dz² и dx²–y², а ориентированные лопастями по биссектрисам координатных углов – dxy, dyz, dxz.
Семь f-орбиталей, соответствующих l = 3 (n ≥ 4), изображаются в виде граничных поверхностей.
Квантовые
числа n,
l
и m
не полностью характеризуют состояние
электрона в атоме. Экспериментально
установлено, что электрон имеет еще
одно свойство – спин. Упрощенно спин
можно представить как вращение электрона
вокруг собственной оси. Спиновое
квантовое число ms
имеет только два значения ms
= ±1/2, представляющие собой две проекции
углового момента электрона на выделенную
ось. Электроны с разными ms
обозначаются стрелками, направленными
вверх
![]() и
вниз
и
вниз![]() .
.
Последовательность заполнение атомных орбиталей
Заселение электронами атомных орбиталей (АО) осуществляется согласно принципу наименьшей энергии, принципу Паулии правилу Гунда, а для многоэлектронных атомов – правилу Клечковского.
Принцип наименьшей энергии требует, чтобы электроны заселяли АО в порядке увеличения энергии электронов на этих орбиталях. Это отражает общее правило – максимуму устойчивости системы соответствует минимум ее энергии.
Принцип
Паули
(1925 г) запрещает
в многоэлектронном атоме находиться
электронам с одинаковым набором квантовых
чисел. Это означает, что два любых
электрона в атоме (или молекуле, или
ионе) должны отличаться друг от друга
значением хотя бы одного квантового
числа, то есть на одной орбитали может
быть не более двух электронов с различными
спинами (спаренных электронов). Каждый
подуровень содержит 2l
+ 1 орбитали, на которых размещаются не
более 2(2l
+ 1) электронов. Отсюда следует, что
емкость s-орбиталей
– 2, p-орбиталей
– 6, d-орбиталей
– 10 и f-орбиталей
– 14 электронов. Если число электронов
при заданном l
просуммировать от 0 до n
– 1, то получим формулу Бора–Бьюри,
определяющую общее число электронов
на уровне с заданным n:

Эта формула не учитывает межэлектронное взаимодействие и перестает выполняться при n ≥ 3.
Орбитали
с одинаковыми энергиями (вырожденные)
заполняются в соответствии с правилом
Гунда:
наименьшей энергией обладает электронная
конфигурация с максимальным спином.
Это означает, что если на p-орбитали три
электрона, то они располагаются так:
![]()
![]()
![]() ,
и суммарный спинS=3/2,
а не так:
,
и суммарный спинS=3/2,
а не так:
![]()
![]()
![]() ,S=1/2.
,S=1/2.
Правило Клечковского (принцип наименьшей энергии). В многоэлектронных атомах, как и в атоме водорода, состояние электрона определяется значениями тех же четырех квантовых чисел, однако в этом случае электрон находится не только в поле ядра, но и в поле других электронов. Поэтому энергия в многоэлектронных атомах определяется не только главным, но и орбитальным квантовым числом, а вернее их суммой: энергия атомных орбиталей возрастает по мере увеличения суммы n + l; при одинаковой сумме сначала заполняется уровень с меньшим n и большим l. Энергия атомных орбиталей возрастает согласно ряду:
|
|
1s<2s<2p<3s<3p<4s≈3d<4p<5s≈4d<5p<6s≈4f≈5d<6p<7s≈5f≈6d<7p. |
|
Итак, четыре квантовых числа описывают состояние электрона в атоме и характеризуют энергию электрона, его спин, форму электронного облака и его ориентацию в пространстве. При переходе атома из одного состояния в другое происходит перестройка электронного облака, то есть изменяются значения квантовых чисел, что сопровождается поглощением или испусканием атомом квантов энергии.
