
- •C.М. Дрюцкая
- •Введение
- •Тема 1. Введение. Классы и номенклатура неорганических соединений. Основные законы и понятия химии. Закон эквивалентов.
- •1.1. Теоретические сведения
- •Химические свойства оксидов
- •Получение кислот
- •Химические свойства кислот
- •Получение оснований
- •Химические свойства оснований
- •Получение солей
- •Химические свойства средних солей
- •Числовые приставки
- •Систематические и тривиальные названия некоторых веществ
- •Систематические и международные названия некоторых сложных веществ
- •Названия наиболее распространенных кислот и их анионов
- •1.2. Контрольные вопросы и задания
- •1.3. Примеры решения задач
- •1.4. Индивидуальные задания
- •Варианты контрольного задания
- •Варианты контрольного задания
- •1.5. Тестовые задания
- •Тема 2. Способы выражения концентрации (состава) раствора.
- •2.1. Теоретические сведения
- •2.2. Контрольные вопросы и задания
- •2.3. Примеры решения задач
- •2.4. Индивидуальные задания
- •Варианты контрольного задания
- •2.5. Тестовые задания
- •Тема 3. Химическая термодинамика.
- •3.1. Теоретические сведения
- •3.2. Контрольные вопросы и задания
- •3.3. Примеры решения задач
- •Стандартные термодинамические функции
- •3.4. Индивидуальные задания
- •Варианты контрольного задания
- •Варианты контрольного задания
- •3.5. Тестовые задания
- •Тема 4. Химическая кинетика. Термодинамика химического равновесия
- •4.1.Теоретические сведения
- •4.2. Контрольные вопросы и задания
- •4.3. Примеры решения задач
- •4.4. Индивидуальные задания
- •Варианты контрольного задания
- •4.5. Тестовые задания
- •Тема 5. Строение атома. Периодический закон и периодическая система элементов д.И. Менделеева. Химическая связь и строение соединений. Межмолекулярные взаимодействия.
- •5.1. Теоретические сведения
- •Основные характеристики протона, нейтрона и электрона
- •Корпускулярно-волновые свойства частиц
- •Число подуровней на энергетических уровнях
- •Число орбиталей на энергетических подуровнях
- •Последовательность заполнение атомных орбиталей
- •Электронные формулы элементов
- •Потенциалы (энергии) ионизации i1, эВ
- •Потенциалы (энергии) ионизации i1, эВ элементов V группы
- •Значение энергии (Eср) сродства к электрону для некоторых атомов.
- •Относительная электроотрицательность элементов
- •Свойства веществ в разных агрегатных состояниях
- •Сравнительная характеристика аморфных и кристаллических веществ
- •Свойства кристаллических решеток
- •5.2. Контрольные вопросы и задания
- •5.3. Примеры решения задач
- •План характеристики элемента по положению в Периодической системе д.И. Менделеева
- •5.4. Индивидуальные задания
- •Варианты контрольного задания
- •Исходные данные
- •5.5. Тестовые задания
- •Тема 6. Реакции с переносом электронов. Окислительно-восстановительные равновесия и процессы
- •6.1. Теоретические сведения
- •Характеристика элементов и их соединений в овр
- •Типы овр
- •Составление уравнений окислительно-восстановительных реакций
- •Участие ионов в различных средах
- •Стандартные электродные потенциалы металлов
- •6.2. Контрольные вопросы и задания
- •6.3. Примеры решения задач
- •6.4. Индивидуальные задания
- •Варианты контрольного задания
- •Исходные данные
- •6.5. Тестовые задания
- •Тема 7. Лигандообменные равновесия и процессы. Комплексные соединения
- •Координационные числа ионов - комплексообразователей
- •Основные комплексообразователи в кс
- •Среднее поле
- •Слабое поле
- •Геометрическая структура кс и тип гибридизации
- •Видимый спектр длин волн (нм) и окраска кс при их поглощении
- •Варианты контрольного задания
- •Тема 8. Осмотические свойства растворов. Протолитические равновесия и процессы. Электролитическая ионизация. Степень и константа ионизации
- •Теория электролитической ионизации (диссоциации).
- •Варианты контрольного задания
- •Тема 9. Гетерогенные равновесия и процессы. Произведение растворимости, условия образования и растворения осадков
- •Условия смещения гетерогенного равновесия:
- •Варианты контрольного задания
- •Тема 10. Ионное произведение воды. РН. Гидролиз солей
- •Изменение окраски некоторых индикаторов
- •Примеры буферных растворов.
- •Уравнения Гендерсона – Гассельбаха
- •Варианты контрольного задания
- •Объем учебной дисциплины «Общая и неорганическая химия» и виды учебной работы для студентов очного отделения фармацевтического факультета
- •Календарный план лабораторных занятий по общей и неорганической химии для студентов дневного отделения фармацевтического факультета
- •I семестр (продолжительность - 5 часов)
- •Календарный план лекций по общей и неорганической химии для студентов дневного отделения фармацевтического факультета
- •I семестр (продолжительность - 2 часа)
- •Название важнейших кислот и солей.
- •Значения некоторых фундаментальных физческих постоянных
- •Термодинамические свойства веществ.
- •Стандартные электродные потенциалы (е0) некоторых систем
- •Константы устойчивости комплексных ионов
- •Константы нестойкости некоторых комплексных ионов
- •Константы ионизации кислот и оснований (Ки)
- •Коэффициенты активности (f) ионов при ионных силах раствора
- •Растворимость кислот, оснований и солей в воде
- •Константы растворимости
- •Ответы тестовых заданий
- •Оглавление
Условия смещения гетерогенного равновесия:
AgCl↔ Ag+ + Cl-

Чтобы растворить осадок надо один из ионов вывести из раствора или один из ионов связываем с образованием:
малодиссоциирующего вещества
комплекснгого соединения
менее растворимого соединения
AgCl↔
Ag+
+ Cl-
Чтобы осадок выпадал полнее (уменьшить растворимость) надо ввести одноименные ионы. Осаждение труднорастворимого электролита производится в избытке осадителя.
Таким образом, в присутствии избытка одноименных ионов растворимость малорастворимого вещества понижается, и осаждение будет более полным.
Малорастворимое вещество выпадает в осадок, если произведение реальных концентраций ионов в растворе больше величины произведения растворимости при данной температуре.
Контрольные вопросы и задания
Какие электролиты называются сильными и какие слабыми?
Какая пеличина характеризует процесс ионизации труднорастворимых электролитов?
Докажите, исходя из закона действующих масс, что ПР – величина постоянная.
Рассчитайте растворимость для веществ с молекулами типа: АВ, А2В, АВ3, А2В3, АВ2.
Как превратить концентрацию моль/дм3 в г/дм3 и наоборот?
Условия образования и растворения осадков.
Примеры решения задач
Пример 1. Вычислите растворимость соли PbI2, если ПР = 8 · 10-9.
Решение. Растворимость (S) – способность вещества растворяться. Поэтому растворимость определяется концентрацией вещества в растворе:
PbI2 ↔ Pb2+ + 2I-; ПР = [Pb2+]·[I-]2. Тогда ПР = S·(2S)2 = 4S3
S S 2S
 моль/дм3.
моль/дм3.
Пример 2. Вычислите ПР AgCl, если его растворимость в воде при 25 0С составляет 0,0018 г/л.
Решение.
ПР – это произведение концентраций
ионов, а концентрация измеряется в
моль/л, то переводим растворимость в
моль/л: S
=
 =
1,25 · 10-5
моль/л.
=
1,25 · 10-5
моль/л.
AgCl ↔ Ag+ + Cl- ПР = [Ag+]·[Cl-] = S2 = (1,25 ·10-5)2 = 1,56 · 10-10.
Пример 3. Выпадет ли осадок, если слить равные объемы 0,02 М растворов AgNO3 и KI?
Решение. AgNO3 + KI → AgI (↓) + KNO3; ПР(AgI) = 8,5 · 10-17 (табл. величина). Осадок выпадает когда [Ag+]·[I-] > ПР.
Так как слили равные объемы растворов, то концентрации каждого раствора в полученном растворе уменьшились в 2 раза: [Ag+] =[I-] = 0,01 моль/л. [Ag+]·[I-] = (0,01)2 = 10-4
Тогда 1 · 10-4 > 8,5 · 10-17. Следовательно, осадок выпадает.
Пример 4. Выпадет ли осадок, если слить 0,6 дм3 0,01 М раствора MgSO4 и 0,4 дм3 0,002 М раствора Na2CO3? ПР(MgCO3) = 1 · 10-5.
Решение. MgSO4 + Na2CO3 → MgCO3(↓) + Na2SO4
Условие выпадения осадка: [Mg2+]·[CO32-] > ПР(MgCO3)
Объем полученного раствора – 1 дм3
Объем MgSO4 увеличился в 1/0,6 = 1,6 раза, следовательно, [Mg2+] в столько же раз уменьшилось: [Mg2+] = 0,01/1,6 = 6·10-3 моль/дм3.
Объем Na2CO3 увеличился в 1/0,4 = 2,5 раза, следовательно, [CO32-] в столько же раз уменьшилось: [CO32-] = 0,002/2,5 = 8·10-4 моль/дм3.
[Mg2+]·[CO32-] = 6·10-3 · 8·10-4 = 4,8 · 10-6
Тогда 4,8 · 10-6 < 1 · 10-5. Следовательно, осадок не выпадает.
Пример 5. Во сколько раз уменьшится растворимость AgI в 0,001 М KI по сравнению с его растворимостью в воде? ПР(AgI) = 8,5 · 10-17.
Решение. Находим растворимость AgI в воде: AgI ↔ Ag+ + I-; ПР = S2
S
=
 моль/л.
моль/л.
Находим растворимость AgI в 0,001 М КI: ПР = [Ag+]·[I-] = Х· 0,001;
Х = 8,5 · 10-17 / 0,001 = 8,5 · 10-14 моль/л.
Находим
во сколько раз уменьшилась растворимость
в растворе с одноименными ионами по
отношению к воде:
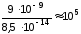 раз.
раз.
Индивидуальные задания
Задание. Решите задачи своего варианта (табл. 49).
Таблица 49
