
- •C.М. Дрюцкая
- •Введение
- •Тема 1. Введение. Классы и номенклатура неорганических соединений. Основные законы и понятия химии. Закон эквивалентов.
- •1.1. Теоретические сведения
- •Химические свойства оксидов
- •Получение кислот
- •Химические свойства кислот
- •Получение оснований
- •Химические свойства оснований
- •Получение солей
- •Химические свойства средних солей
- •Числовые приставки
- •Систематические и тривиальные названия некоторых веществ
- •Систематические и международные названия некоторых сложных веществ
- •Названия наиболее распространенных кислот и их анионов
- •1.2. Контрольные вопросы и задания
- •1.3. Примеры решения задач
- •1.4. Индивидуальные задания
- •Варианты контрольного задания
- •Варианты контрольного задания
- •1.5. Тестовые задания
- •Тема 2. Способы выражения концентрации (состава) раствора.
- •2.1. Теоретические сведения
- •2.2. Контрольные вопросы и задания
- •2.3. Примеры решения задач
- •2.4. Индивидуальные задания
- •Варианты контрольного задания
- •2.5. Тестовые задания
- •Тема 3. Химическая термодинамика.
- •3.1. Теоретические сведения
- •3.2. Контрольные вопросы и задания
- •3.3. Примеры решения задач
- •Стандартные термодинамические функции
- •3.4. Индивидуальные задания
- •Варианты контрольного задания
- •Варианты контрольного задания
- •3.5. Тестовые задания
- •Тема 4. Химическая кинетика. Термодинамика химического равновесия
- •4.1.Теоретические сведения
- •4.2. Контрольные вопросы и задания
- •4.3. Примеры решения задач
- •4.4. Индивидуальные задания
- •Варианты контрольного задания
- •4.5. Тестовые задания
- •Тема 5. Строение атома. Периодический закон и периодическая система элементов д.И. Менделеева. Химическая связь и строение соединений. Межмолекулярные взаимодействия.
- •5.1. Теоретические сведения
- •Основные характеристики протона, нейтрона и электрона
- •Корпускулярно-волновые свойства частиц
- •Число подуровней на энергетических уровнях
- •Число орбиталей на энергетических подуровнях
- •Последовательность заполнение атомных орбиталей
- •Электронные формулы элементов
- •Потенциалы (энергии) ионизации i1, эВ
- •Потенциалы (энергии) ионизации i1, эВ элементов V группы
- •Значение энергии (Eср) сродства к электрону для некоторых атомов.
- •Относительная электроотрицательность элементов
- •Свойства веществ в разных агрегатных состояниях
- •Сравнительная характеристика аморфных и кристаллических веществ
- •Свойства кристаллических решеток
- •5.2. Контрольные вопросы и задания
- •5.3. Примеры решения задач
- •План характеристики элемента по положению в Периодической системе д.И. Менделеева
- •5.4. Индивидуальные задания
- •Варианты контрольного задания
- •Исходные данные
- •5.5. Тестовые задания
- •Тема 6. Реакции с переносом электронов. Окислительно-восстановительные равновесия и процессы
- •6.1. Теоретические сведения
- •Характеристика элементов и их соединений в овр
- •Типы овр
- •Составление уравнений окислительно-восстановительных реакций
- •Участие ионов в различных средах
- •Стандартные электродные потенциалы металлов
- •6.2. Контрольные вопросы и задания
- •6.3. Примеры решения задач
- •6.4. Индивидуальные задания
- •Варианты контрольного задания
- •Исходные данные
- •6.5. Тестовые задания
- •Тема 7. Лигандообменные равновесия и процессы. Комплексные соединения
- •Координационные числа ионов - комплексообразователей
- •Основные комплексообразователи в кс
- •Среднее поле
- •Слабое поле
- •Геометрическая структура кс и тип гибридизации
- •Видимый спектр длин волн (нм) и окраска кс при их поглощении
- •Варианты контрольного задания
- •Тема 8. Осмотические свойства растворов. Протолитические равновесия и процессы. Электролитическая ионизация. Степень и константа ионизации
- •Теория электролитической ионизации (диссоциации).
- •Варианты контрольного задания
- •Тема 9. Гетерогенные равновесия и процессы. Произведение растворимости, условия образования и растворения осадков
- •Условия смещения гетерогенного равновесия:
- •Варианты контрольного задания
- •Тема 10. Ионное произведение воды. РН. Гидролиз солей
- •Изменение окраски некоторых индикаторов
- •Примеры буферных растворов.
- •Уравнения Гендерсона – Гассельбаха
- •Варианты контрольного задания
- •Объем учебной дисциплины «Общая и неорганическая химия» и виды учебной работы для студентов очного отделения фармацевтического факультета
- •Календарный план лабораторных занятий по общей и неорганической химии для студентов дневного отделения фармацевтического факультета
- •I семестр (продолжительность - 5 часов)
- •Календарный план лекций по общей и неорганической химии для студентов дневного отделения фармацевтического факультета
- •I семестр (продолжительность - 2 часа)
- •Название важнейших кислот и солей.
- •Значения некоторых фундаментальных физческих постоянных
- •Термодинамические свойства веществ.
- •Стандартные электродные потенциалы (е0) некоторых систем
- •Константы устойчивости комплексных ионов
- •Константы нестойкости некоторых комплексных ионов
- •Константы ионизации кислот и оснований (Ки)
- •Коэффициенты активности (f) ионов при ионных силах раствора
- •Растворимость кислот, оснований и солей в воде
- •Константы растворимости
- •Ответы тестовых заданий
- •Оглавление
Стандартные электродные потенциалы металлов
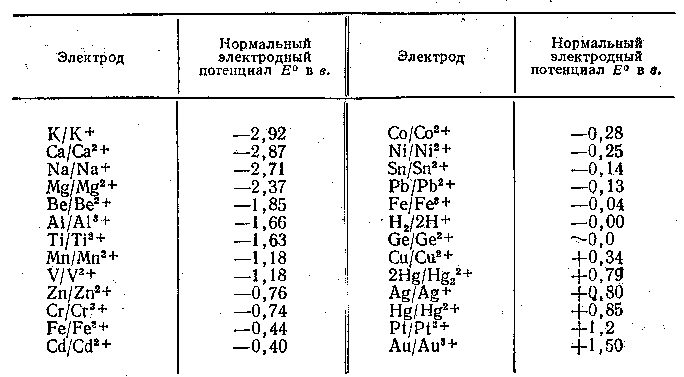
Он позволяет сделать ряд выводов относительно химических свойств элементов:
каждый элемент способен восстанавливать из растворов солей все ионы, имеющие большее значение стандартных электродных потенциалов.
величина стандартного электродного потенциала характеризует одновременно восстановительную способность атома и окислительную способность его ионов
Чем меньше величина стандартного электродного потенциала тем больше восстановительная способность атома и наоборот, тем меньше окислительная способность его иона
водород из разбавленных кислот может быть вытеснен только атомами, стандартные электродные потенциалы которых имеют знак минус.
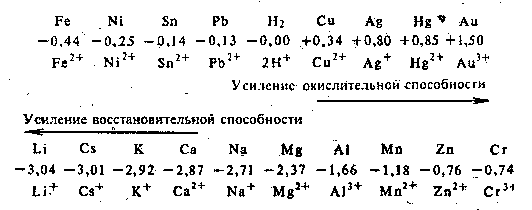
Рис. 26. Ряд стандартных электродных потенциалов
Самостоятельно протекают ОВР, в которых восстановитель имеет более отрицательный электродный потенциал, чем окислитель.
Знак и величина потенциала зависят от положения равновесия между металлом и раствором, природы металла, концентрации его ионов в растворе и температуры.
Чем большей химической активностью обладает вещество, тем легче оно растворяется, тем в большей степени равновесие смещено вправо – тем отрицательнее потенциал.
Переход ионов вещества в раствор происходит тем интенсивнее, чем меньше концентрация катионов в растворе. Наоборот, с увеличением концентрации раствора равновесие смещается влево, и потенциал становится более положительным.
С повышением температуры потенциал становится более положительным, равновесие смещается влево. Ионы переходят в раствор – гидратация, а она процесс экзотермический (принцип Ле Шателье).
Зависимость электродного потенциала от концентрации веществ, участвующих в ОВР, и от температуры выражается уравнением Нернста:
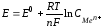 →
→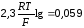
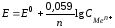 (60)
(60)
Окислителем всегда является полуэлемент с более высоким значением электродного потенциала, чем больше электродный потенциал, тем более сильным окислителем является окисленная форма, чем меньше электродный потенциал в данной системе, тем более сильным восстановителем является восстановленная форма.
ОВР самопроизвольно протекает в сторону окислителя с меньшим значением стандартного электродного потенциала. Стандартный электродный потенциал является мерой окислительно-восстановительной способности в реакциях только в водных растворах.
3. ЭДС ОВР.
Электродвижущая сила – разность электродных потенциалов окислителя и восстановителя. Это максимально возможная для данной системы разность потенциалов. Чем больше величина ЭДС, тем интенсивнее протекает ОВР.
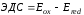
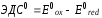 (61)
(61)
ОВР протекает тогда, когда ЭДС>0. Направленность ОВ процесса определяется знаком ЭДС. Отрицательное значение ЭДС свидетельствует о том, что процесс слева направо протекать не может, реакция возможна только в обратном направлении.
Стандартная
ЭДС ОВР связана со стандартной энергией
Гиббса, соотношением:  ,
(62)
,
(62)
где z – число электронов, принимающих участие в реакции, F – постоянная Фарадея.
Стандартная
энергия Гиббса связана с константой
равновесия уравнением:
 =
-
=
-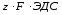
Из этого соотношения по экспериментально определенному значению стандартной ЭДС можно вычислить константу равновесия соответствующей окислительно-восстановительной реакции:
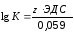 (63)
(63)
где Т=298 К, R=8,31 Дж/моль·К, F=96500 Кл/моль.
ОВР широко применяются в промышленности при производстве серной и азотной кислот, получении сажи, восстановлении металлов из руд, сжигании топлива. Коррозия металлов тоже ОВР, причиняющая огромные убытки. ОВР играют большую роль в биохимических процессах: дыхании, обмене веществ, нервной деятельности человека и животных.
