
- •C.М. Дрюцкая
- •Введение
- •Тема 1. Введение. Классы и номенклатура неорганических соединений. Основные законы и понятия химии. Закон эквивалентов.
- •1.1. Теоретические сведения
- •Химические свойства оксидов
- •Получение кислот
- •Химические свойства кислот
- •Получение оснований
- •Химические свойства оснований
- •Получение солей
- •Химические свойства средних солей
- •Числовые приставки
- •Систематические и тривиальные названия некоторых веществ
- •Систематические и международные названия некоторых сложных веществ
- •Названия наиболее распространенных кислот и их анионов
- •1.2. Контрольные вопросы и задания
- •1.3. Примеры решения задач
- •1.4. Индивидуальные задания
- •Варианты контрольного задания
- •Варианты контрольного задания
- •1.5. Тестовые задания
- •Тема 2. Способы выражения концентрации (состава) раствора.
- •2.1. Теоретические сведения
- •2.2. Контрольные вопросы и задания
- •2.3. Примеры решения задач
- •2.4. Индивидуальные задания
- •Варианты контрольного задания
- •2.5. Тестовые задания
- •Тема 3. Химическая термодинамика.
- •3.1. Теоретические сведения
- •3.2. Контрольные вопросы и задания
- •3.3. Примеры решения задач
- •Стандартные термодинамические функции
- •3.4. Индивидуальные задания
- •Варианты контрольного задания
- •Варианты контрольного задания
- •3.5. Тестовые задания
- •Тема 4. Химическая кинетика. Термодинамика химического равновесия
- •4.1.Теоретические сведения
- •4.2. Контрольные вопросы и задания
- •4.3. Примеры решения задач
- •4.4. Индивидуальные задания
- •Варианты контрольного задания
- •4.5. Тестовые задания
- •Тема 5. Строение атома. Периодический закон и периодическая система элементов д.И. Менделеева. Химическая связь и строение соединений. Межмолекулярные взаимодействия.
- •5.1. Теоретические сведения
- •Основные характеристики протона, нейтрона и электрона
- •Корпускулярно-волновые свойства частиц
- •Число подуровней на энергетических уровнях
- •Число орбиталей на энергетических подуровнях
- •Последовательность заполнение атомных орбиталей
- •Электронные формулы элементов
- •Потенциалы (энергии) ионизации i1, эВ
- •Потенциалы (энергии) ионизации i1, эВ элементов V группы
- •Значение энергии (Eср) сродства к электрону для некоторых атомов.
- •Относительная электроотрицательность элементов
- •Свойства веществ в разных агрегатных состояниях
- •Сравнительная характеристика аморфных и кристаллических веществ
- •Свойства кристаллических решеток
- •5.2. Контрольные вопросы и задания
- •5.3. Примеры решения задач
- •План характеристики элемента по положению в Периодической системе д.И. Менделеева
- •5.4. Индивидуальные задания
- •Варианты контрольного задания
- •Исходные данные
- •5.5. Тестовые задания
- •Тема 6. Реакции с переносом электронов. Окислительно-восстановительные равновесия и процессы
- •6.1. Теоретические сведения
- •Характеристика элементов и их соединений в овр
- •Типы овр
- •Составление уравнений окислительно-восстановительных реакций
- •Участие ионов в различных средах
- •Стандартные электродные потенциалы металлов
- •6.2. Контрольные вопросы и задания
- •6.3. Примеры решения задач
- •6.4. Индивидуальные задания
- •Варианты контрольного задания
- •Исходные данные
- •6.5. Тестовые задания
- •Тема 7. Лигандообменные равновесия и процессы. Комплексные соединения
- •Координационные числа ионов - комплексообразователей
- •Основные комплексообразователи в кс
- •Среднее поле
- •Слабое поле
- •Геометрическая структура кс и тип гибридизации
- •Видимый спектр длин волн (нм) и окраска кс при их поглощении
- •Варианты контрольного задания
- •Тема 8. Осмотические свойства растворов. Протолитические равновесия и процессы. Электролитическая ионизация. Степень и константа ионизации
- •Теория электролитической ионизации (диссоциации).
- •Варианты контрольного задания
- •Тема 9. Гетерогенные равновесия и процессы. Произведение растворимости, условия образования и растворения осадков
- •Условия смещения гетерогенного равновесия:
- •Варианты контрольного задания
- •Тема 10. Ионное произведение воды. РН. Гидролиз солей
- •Изменение окраски некоторых индикаторов
- •Примеры буферных растворов.
- •Уравнения Гендерсона – Гассельбаха
- •Варианты контрольного задания
- •Объем учебной дисциплины «Общая и неорганическая химия» и виды учебной работы для студентов очного отделения фармацевтического факультета
- •Календарный план лабораторных занятий по общей и неорганической химии для студентов дневного отделения фармацевтического факультета
- •I семестр (продолжительность - 5 часов)
- •Календарный план лекций по общей и неорганической химии для студентов дневного отделения фармацевтического факультета
- •I семестр (продолжительность - 2 часа)
- •Название важнейших кислот и солей.
- •Значения некоторых фундаментальных физческих постоянных
- •Термодинамические свойства веществ.
- •Стандартные электродные потенциалы (е0) некоторых систем
- •Константы устойчивости комплексных ионов
- •Константы нестойкости некоторых комплексных ионов
- •Константы ионизации кислот и оснований (Ки)
- •Коэффициенты активности (f) ионов при ионных силах раствора
- •Растворимость кислот, оснований и солей в воде
- •Константы растворимости
- •Ответы тестовых заданий
- •Оглавление
5.2. Контрольные вопросы и задания
Охарактеризуйте двойственную природу электрона, уравнение де Бройля, принцип неопределенности Гейзенберга, волновое уравнение Шредингера.
Спектры атомов, как источник информации об их строении. Квантовые числа.
Основные принципы заполнения электронами орбиталей (принцип Паули, принцип наименьшей энергии, правило Гунда).
Электронные формулы и электронно-структурные схемы атомов.
Определение валентных возможностей элемента, исходя из строения электронных оболочек атома.
Охарактеризовать свойства элемента по его положению в ПСЭ.
Физическая сущность химической связи. Типы химической связи, ее характеристика: энергия, длина направленность.
Основные положения МВС и ММО. Связывающие и разрыхляющие МО. Кратность связи в ММО.
Типы ковалентной связи. Свойства ковалентной связи: насыщаемость, полярность, поляризуемость, направленность, гибридизация. Пространственное расположение атомов в молекуле. Кратность и делокализация связи.
Ионная связь, ее характеристики. Общая характеристика металлической связи, водородной связи, межмолекулярных взаимодействий.
Характеристика агрегатного состояния веществ.
5.3. Примеры решения задач
Пример 1. Запишите полный набор квантовых чисел для электрона, который находится последним в орбитальной диаграмме атома азота.
Решение. Этот электрон характеризуется набором квантовых чисел: n = 2 (находится на 2-м уровне), l = 1(находится на p-подуровне), m = +1 (находится на последней из трех одинаковых p-орбиталей, s = +1/2 (этот электрон заселился первым на данную p-орбиталь).
Пример 2. Последним электронную оболочку некоего элемента заселяет электрон с набором квантовых чисел: n = 3, l = 2, m = -2, s = +1/2. Какой это элемент? Какова его полная электронная формула?
Решение. Данный электрон находится на 3-м уровне (n = 3), причем на d-подуровне (l = 2). На рис. 20 изображены все пять d-орбиталей и расположены над ними значения магнитного квантового числа m от -2 до +2, нужная орбиталь (m = -2).
Расположив на ней единственный электрон (стрелка вверх, т.к. s = +1/2) и зная, что он последний, мы приходим к выводу, что остальные d-орбитали пусты. Теперь мы уже можем записать сокращенную электронную формулу элемента: …3d1. Этот элемент легко найти в периодической таблице - это скандий 21Sc. Всего на орбитальной диаграмме элемента поместится ровно 21 электрон, следовательно, в его ядре 21 протон и его порядковый номер в таблице Менделеева тоже 21 (Sc). Орбитальная диаграмма помогает записать и полную электронную формулу для скандия: 1s2 2s2 2p6 3s2 3p6 4s2 3d1.
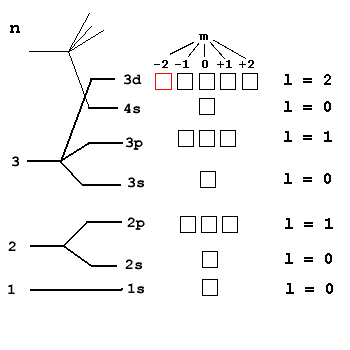
Рис. 20. Графическое изображение орбиталей
Пример 3. Элемент имеет порядковый номер 18. Напишите полную электронную формулу, указав, на каких энергетических уровнях и подуровнях находятся электроны в атомах этого элемента.
Решение. Заполнение электронами энергетических уровней и подуровней происходит в порядке возрастания энергии 1s<2s<2p<3s<3p<4s≈3d<4p<5s≈4d<5p<6s≈4f≈5d<6p<7s≈5f≈6d<7p. Порядковый номер 18, т.е. атом содержит 18 электронов, его электронная формула имеет вид: 1s22s22p63s23p6, это аргон.
Пример 4. Сокращенная электронная формула элемента изображена в виде … 3d34s2. Какой это элемент? Напишите полную электронную формулу.
Решение. Исходя из строения электронной оболочки, элемент находится в 4-м периоде, общее число валентных электронов (3d34s2) – пять, следовательно, в V группе, d-орбиталь незавершенна, это d-элемент V группы побочной подгруппы. Это ванадий 23V. Электронная формула этого элемента: 1s22s22p63s23p64s23d3.
Пример 5. На основании ПСЭ охарактеризуйте химические свойства атома с порядковым номером 21 по плану.
