
- •C.М. Дрюцкая
- •Введение
- •Тема 1. Введение. Классы и номенклатура неорганических соединений. Основные законы и понятия химии. Закон эквивалентов.
- •1.1. Теоретические сведения
- •Химические свойства оксидов
- •Получение кислот
- •Химические свойства кислот
- •Получение оснований
- •Химические свойства оснований
- •Получение солей
- •Химические свойства средних солей
- •Числовые приставки
- •Систематические и тривиальные названия некоторых веществ
- •Систематические и международные названия некоторых сложных веществ
- •Названия наиболее распространенных кислот и их анионов
- •1.2. Контрольные вопросы и задания
- •1.3. Примеры решения задач
- •1.4. Индивидуальные задания
- •Варианты контрольного задания
- •Варианты контрольного задания
- •1.5. Тестовые задания
- •Тема 2. Способы выражения концентрации (состава) раствора.
- •2.1. Теоретические сведения
- •2.2. Контрольные вопросы и задания
- •2.3. Примеры решения задач
- •2.4. Индивидуальные задания
- •Варианты контрольного задания
- •2.5. Тестовые задания
- •Тема 3. Химическая термодинамика.
- •3.1. Теоретические сведения
- •3.2. Контрольные вопросы и задания
- •3.3. Примеры решения задач
- •Стандартные термодинамические функции
- •3.4. Индивидуальные задания
- •Варианты контрольного задания
- •Варианты контрольного задания
- •3.5. Тестовые задания
- •Тема 4. Химическая кинетика. Термодинамика химического равновесия
- •4.1.Теоретические сведения
- •4.2. Контрольные вопросы и задания
- •4.3. Примеры решения задач
- •4.4. Индивидуальные задания
- •Варианты контрольного задания
- •4.5. Тестовые задания
- •Тема 5. Строение атома. Периодический закон и периодическая система элементов д.И. Менделеева. Химическая связь и строение соединений. Межмолекулярные взаимодействия.
- •5.1. Теоретические сведения
- •Основные характеристики протона, нейтрона и электрона
- •Корпускулярно-волновые свойства частиц
- •Число подуровней на энергетических уровнях
- •Число орбиталей на энергетических подуровнях
- •Последовательность заполнение атомных орбиталей
- •Электронные формулы элементов
- •Потенциалы (энергии) ионизации i1, эВ
- •Потенциалы (энергии) ионизации i1, эВ элементов V группы
- •Значение энергии (Eср) сродства к электрону для некоторых атомов.
- •Относительная электроотрицательность элементов
- •Свойства веществ в разных агрегатных состояниях
- •Сравнительная характеристика аморфных и кристаллических веществ
- •Свойства кристаллических решеток
- •5.2. Контрольные вопросы и задания
- •5.3. Примеры решения задач
- •План характеристики элемента по положению в Периодической системе д.И. Менделеева
- •5.4. Индивидуальные задания
- •Варианты контрольного задания
- •Исходные данные
- •5.5. Тестовые задания
- •Тема 6. Реакции с переносом электронов. Окислительно-восстановительные равновесия и процессы
- •6.1. Теоретические сведения
- •Характеристика элементов и их соединений в овр
- •Типы овр
- •Составление уравнений окислительно-восстановительных реакций
- •Участие ионов в различных средах
- •Стандартные электродные потенциалы металлов
- •6.2. Контрольные вопросы и задания
- •6.3. Примеры решения задач
- •6.4. Индивидуальные задания
- •Варианты контрольного задания
- •Исходные данные
- •6.5. Тестовые задания
- •Тема 7. Лигандообменные равновесия и процессы. Комплексные соединения
- •Координационные числа ионов - комплексообразователей
- •Основные комплексообразователи в кс
- •Среднее поле
- •Слабое поле
- •Геометрическая структура кс и тип гибридизации
- •Видимый спектр длин волн (нм) и окраска кс при их поглощении
- •Варианты контрольного задания
- •Тема 8. Осмотические свойства растворов. Протолитические равновесия и процессы. Электролитическая ионизация. Степень и константа ионизации
- •Теория электролитической ионизации (диссоциации).
- •Варианты контрольного задания
- •Тема 9. Гетерогенные равновесия и процессы. Произведение растворимости, условия образования и растворения осадков
- •Условия смещения гетерогенного равновесия:
- •Варианты контрольного задания
- •Тема 10. Ионное произведение воды. РН. Гидролиз солей
- •Изменение окраски некоторых индикаторов
- •Примеры буферных растворов.
- •Уравнения Гендерсона – Гассельбаха
- •Варианты контрольного задания
- •Объем учебной дисциплины «Общая и неорганическая химия» и виды учебной работы для студентов очного отделения фармацевтического факультета
- •Календарный план лабораторных занятий по общей и неорганической химии для студентов дневного отделения фармацевтического факультета
- •I семестр (продолжительность - 5 часов)
- •Календарный план лекций по общей и неорганической химии для студентов дневного отделения фармацевтического факультета
- •I семестр (продолжительность - 2 часа)
- •Название важнейших кислот и солей.
- •Значения некоторых фундаментальных физческих постоянных
- •Термодинамические свойства веществ.
- •Стандартные электродные потенциалы (е0) некоторых систем
- •Константы устойчивости комплексных ионов
- •Константы нестойкости некоторых комплексных ионов
- •Константы ионизации кислот и оснований (Ки)
- •Коэффициенты активности (f) ионов при ионных силах раствора
- •Растворимость кислот, оснований и солей в воде
- •Константы растворимости
- •Ответы тестовых заданий
- •Оглавление
Теория электролитической ионизации (диссоциации).
Электролитическая ионизация в растворе – это распад вещества на сольватиованные (гидратированные) ионы под действием молекул растворителя.
Данная теория была разработана шведским ученым Сванте Аррениусом в 1887 г. Основные ее положения:
Вещества распадаются на положительные и отрицательно заряженные ионы под действием растворителя.
Под дейсвием электрического тока положительно заряженные ионы двигаются к катоду (-) и называются катионами, а отрицательно заряженные двигаются к аноду (+) и называются анионами.
Диссоциация – процесс обратимый, наряду с распадом молекул протекает процесс соединения ионов в молекулу (молязация).

В своих работах Аррениус доказал, что распад молекул на ионы происходит уже в самом процессе растворения независимо от того, пропускают электрический ток через раствор или нет. Благодаря ионизации увеличивается число частиц в расторе, что ведет к повышению осмотического давления, однако он не учитывал взаимодействие растворенного вещества с растворителем (сольватационные процессы), данный процесс рассматривал как физический.
Основоположником современной теории электролитической ионизации как процесса, вызываемого сольватацией молекул, являются И.А. Каблуков и В.А. Кистяковский. Они расширили теорию Аррениуса с позиции химической теории растворов Д.И. Менделеева.
Основная причина электролитической ионизации – гидратация (сольватация) ионов, затрудняющая обратное соединение ионов (ассоциацию).
Дипольные молекулы воды взаимодействуют с ионами или полярными молекулами в растворе как за счет неподеленных электронных пар атома кислорода, так и за счет образования водородных связей:

Таким образом, катионы связаны с молекулами воды по типу донорно-акцепторного взаимодействия. Доморами являются атомы кислорода молекулы воды, имеющие свободные электронные пары, акцепторами - катионы, имеющие свободные орбитали.
Анионы связаны с водой водородной связью. Число координированных молекул воды называется координационным числом. Оно может бытьравно 4,6 и т.д. В общем виде растворение электролита в воде описывает уравнение:
КА + (x + у) Н2О ↔ [К(Н2О)х]+ + [А(Н2О)у]-
На практике пользуются упрощенным уравнением: КА ↔ К+ + А-
Таков механизм ионизации вещества ионного характера, кристаллическая решетка которых состоит из ионов.
При растворении в воде или других полярных растворителях соединений с ковалентной полярной связью происходит ионизация по типу:

Аналогично идет растворение галогенидов кобальта, алюминия, хрома, марганца,железа, меди и др.: СоCl2 + 6H2O = [Co(H2O)6]2+ + 2Cl-
Элементарных ионов кобальта в растворе нет. Часто аквакомплексы оказываются настолько прочными, что выделяются из растворов в составе кристаллогидратов, например: CuSO4·5H2O, AlCl3·6H2O, BeCl2·4H2O.
Количественной
характеристикой электролитической
ионизации является
 - степень ионизации. Это отношение числа
ионизированных молекул к общему числу:
- степень ионизации. Это отношение числа
ионизированных молекул к общему числу:
 (65)
(65)
По степени ионизации условно электролиты делятся на сильные (α>30%), средние (30% >α > 3%) и слабые (α<3%).
Степень ионизации можно вычислить, если найти опытным путем изотонический коэффициент Вант-Гоффа:
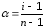 (66)
(66)
n- общее количество ионов на которые распадается электролит
Из сказанного выше следует, что растворы будут изотоничны, если при одинаковой температуре содержат одинаковое число частиц в еденице объема. У растворов с одинаковой молярной концентрацией осмотической давление выше в растворе электролита, с более высоким значением α. У растворов электролитов с одинаковыми СМ и α осмотическое давление выше у раствора электролита, диссоциирующего на болшее число частиц.
Факторы, влияющие на степень ионизации:
Природа растворителя
Природа растворенного вещества
Температура (ионизация – это эндотермический процесс, поэтому с повышением температуры ионизация увеличивается).
Концентрация (с увеличением концентрации уменьшается степень ионизации и наоборот).
Наличие одноименных ионов уменьшает степень ионизации.
К равновесиям в растворе слабого электролита применимы законы химического равновесия:


Киониз. - константа ионизации зависит от природы электролита и растворителя, от температуры и не зависти от концентрации. Это постоянная величина (прилож. 7) характеризует способность электролита распадаться на ионы. Чем больше Киониз., тем лучше вещество распадается на ионы. Для сильных электролитов Киониз >1
рКиониз = -lgКиониз (67)
Взаимосвязь константы ионизации и степенью ионизации выражает закон разбавления Оствальда:
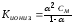 (68)
(68)
Для слабых электролитов, в очень разбавленных растворах:
 (69)
(69)
Степень ионизации слабого электролита возрастает с разведением раствора.
Ионизации подвергаются не только молекулы, но и сложные ионы. При ступенчатой ионизации кислот и оснований каждая ступень характеризуется собственной константой:
Н3РО4
↔Н+
+ Н2РО4-
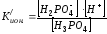
Н2РО4-
↔ Н+
+ НРО42-

НРО42-
↔ Н+
+ РО43-

Общая Киониз = К/ион. · К//ион· К///ион. Поскольку К/ион. > К//ион > К///ион, в наибольшей степени идет ионизация по первой ступени.
Электролиты – вещества, расплавы и растворы которых содержат подвижные ионы и проводят электрический ток. К сильным электролитам, если растворителем является вода относятся: все соли, сильные кислоты (соляная, бромоводородная, йодоводородная, хлорная, серная, азотная), основания (гидроксиды лития, натрия, калия, рубидия, цезия, кальция, бария).
Данные вещества в растворах полностью диссоциируют на ионы. Однако экспериментально было доказано, что не все ионы, образовавшиеся в результате полной диссоциации электролита, являются свободными (электрическая проводимость растворов электролитов, которая связана с движением ионов, в концентрированных растворах оказалась незначительной). Это говорит о том, что в них ионы движутся медленнее, чем в разбавленных. Это обусловлено электростатическим взаимодействием между ионами и зависит от концентрации раствора, природы электролита и среды. Наличие этих сил приводит к тому, что каждый ион окружен «ионной атмосферой», состоящей из ионов с противоположным знаком (сложные агрегаты – ассоциаты). Движение положительных ионов в сторону отрицательного электрода тормозится силами притяжения отрицательно заряженной «ионной атмосферы» к положительному электроду (рис. 30). При разбавлении это взаимодействие ослабевает, подвижность ионов возрастает (максимальна при бесконечном разбавлении раствора).
Активную
(эффективную) концентрацию электролита
(количество свободных ионов) называют
активностью (Льюис, 1901 г).
Активность – это условная концентрация соответственно которой электролит действует в химических реакциях. Активность раствора связана с молярной концентрацией:
Рис. 30. Торможение ионов в электрическом поле.
 (70)
(70)
Для сильно разбавленных растворов она равна концентрации.
F
– коэффициент активности, характеризует
межионные взаимодействия. Чем они
сильнее, тем меньше коэффициент, тем
больше отличаются активность и
концентрация. Это безмерная величина,
характеризует степень отклонения
свойств данного раствора от свойств
идеального (если раствор разбавлять,
то
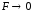 и С=а)
и С=а)
Сила взаимодействия между ионами – F- зависят от: концентрации ионов и заряда.
Эти факторы учитываются величиной – ионной силой раствора (I) – полусумма произведений концентраций всех ионов в растворах на квадрат их заряда:
 (71)
(71)
Для сильно разбавленных растворов коэффициент активности (в приложении 7.) зависит только от ионной силы. Согласно теории сильных электролитов Дебая-Гюккеля (1923 г), коэффициент активности электролита связан с ионной силой раствора следующим соотношением:
 (72)
(72)
А – коэффициент, зависит от заряда иона, диэлектрической проницаемости среды и температуры.
Согласно теории электролитической диссоциации Аррениуса кислота – это соединение, распадающееся в водном растворе с образованием ионов Н+, а основание – вещество, при диссоциации которого образуются ионы ОН-. Эти определения являются весьма упрощенными, поскольку относятся только к водным растворам (кислотно-основные свойства проявляются в разных растворителях и даже при их отсутствии). Многие вещества не содержат в своем составе гидроксильных групп, и тем не менее являются основаниями. В данном процессе диссоциации не учитываются молекулы растворителя.
В развитии представлений о кислотах и основаниях появляется протеолитическая теория Бренстеда –Лоури (1923г). Согласно этой теории кислота – вещество, которое может отщеплять протоны, а основание – вещество, присоединяющее протоны.


ацетет ион – основание хлорид ион – основание, более слабое. Следовательно, хлороводород – сильный электролит.
В каждом примере есть кислота и основание, которые называются сопряженными.
 В
процессе нейтрализации два основания
конкурируют за обладание протонами.
В
процессе нейтрализации два основания
конкурируют за обладание протонами.
Протолитическое, или кислотно-основное, равновесие устанавливается в результате конкуренции за протон между основаниями взаимодействующих сопряженных кислотно-основных пар ( НА, А- и ВН+, В).
Протолитическое равновесие всегда смещается в сторону образования более слабой кислоты:
НА + В ↔ А- + ВН+
pKa( HA) + pKb(А-)= 14
pKa(ВH+) + pKb(B) = 14
Согласно протеолитической теории сила кислот и оснований зависят от природы растворителя. Так, если в качестве растворителя хлороводорода вместо воды взять безводную уксусную кислоту (более слабое основание, чем вода), то равновесие не будет полностью смещено вправо, т.е. хлороводород - слабая кислота.

Наоборот, если уксусную кислоту растворить не в воде, а в жидком аммиаке (более сильное основание чем вода) диссоциация уксусной кислоты существенно увеличится.

Почти
одновременно с протеолитической теорией
Дж. Льюис предложит электронную теорию
кислот и оснований. Согласно этой теории
основания –
соединения, имеющие неподеленные
электронные пары и способные их
обобществлять с другими молекулами или
ионами. Кислоты
– вещества, способные акцептировать
электронные пары. (В теории Бренседа-Лоури
нейтрализация – процесс передачи
протона от кислоты к основанию, то здесь
– происходит перенос электронной пары
– донорно-акцепторное взаимодействие).
По Льюису кислотами являются: Н+, Аl3+, BF3, основаниями – Н2О, NH3, Cl- (рис. 31).
Рис. 31. Кислоты и основания Льюиса.
Контрольные вопросы и задания
Учение о растворах. Раствор, растворитель, растворенное вещество, растворимость.
Гидратная теория растворов Д.И. Менделеева.
Сущность явления осмоса. Осмотическое давление. Закон Вант-Гоффа.
Изо-, гипо-, гипертонические растворы. Плазмолиз, тургор, гемолиз.
Роль осмотического давления в биологических системах.
Основные положения теории электролитической диссоциации С. Аррениуса и ее развитие И.А. Каблуковым.
Состояние ионов в водных растворах. Гидратация ионов, образование аквакатионов, сольватация.
Степень ионизации. Факторы, влияющие на степень ионизации.
Изотонический коэффициент. Константа ионизации.
Взаимосвязь степени и константы ионизации.Закон разбавления Оствальда.
Понятие об активности. Кислоты и основания по Бренстеду-Лоури и Льюису.
Примеры решения задач
Пример 1. Вычислите осмотическое давление раствора, содержащего 16 г сахарозы С12Н22О11 в 350 г воды при 293 К. Плотность раствора считать равной 1.
Решение. Находим массу раствора: 16 + 350 = 366 г Поскольку плотность равна 1 г/см3, то объем раствора равен 366 см3 = 0,366 дм3.
Находимо осмотическое давление раствора:

Пример 2. В 250 см3 раствора содержится 2,3 г растворенного вещества. Осмотическое давление при 27 0С равно 249 кПа. Вычислите молярную массу вещества.
Решение. V = 0,25 дм3; Т = 27+273 = 300 К
 .
Откуда
.
Откуда

Пример 3. При 0 0С осмотическое давление 0,1 н раствора карбоната калия равно 272,6 кПа. Определите кажущуюся степень ионизации соли.
Решение. Находим молярную концентрацию 0,1 н раствора К2СО3 (fЭ = ½): 0,1 · ½ = 0,05 моль/л.
Находим
изотонический коэффициент для раствора
соли (сильный электролит):
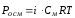 .
Откуда
.
Откуда
 .
.
К2СО3 ↔ 2К+ + СО32-, следовательно n = 3
Кажущуюся
степень ионизации находим из соотношения:

Пример 4. При 20 0С осмотическое давление раствора, в 100 мл которого содержится 6,33 г красящего вещества крови – гематина, равно 243,4 кПа. Определите молекулярную формулу, если известен элементарный состав (в %) гематина: С – 64,6; Н – 5,2; N – 8,8; О – 12,6; Fe – 8,8.
Решение.
Находим молярность раствора:
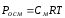 ;
Т = 20 + 273 = 293 К;
;
Т = 20 + 273 = 293 К; .
.
Определяем молекулярную массу гематина: в 1 л раствора содержится 63,3 г гематина, это 0,1 моль. Таким образом, молярная масса гематина равна 63,3/0,1 = 633 г/моль.
Находим
простейшую формулу гематина: С:Н:N:О:Fe
=
 =
34:33:4:5:1.
=
34:33:4:5:1.
Простейшая формула гематина: С34Н33N4O5Fe. Этой формуле соответствует молекулярная масса 633 г/моль, что совпадает с найденным выше значением. Таким образом, искомая молекулярная формула гематина С34Н33N4O5Fe.
Пример 5. Вычислите [H+], [HS-], [S2-] в 0,1 М растворе H2S.
Решение.
Поскольку диссоциация сероводорода
протекает преимущественно по первой
ступени, то концентрацией [H+],
образующихся при диссоциации по второй
ступени, можно пренебречь и считать,
что [H+]
= [HS-]
=
 =
= моль/л
(К1
– константа диссоциации по первой
ступени – табл. величина).
моль/л
(К1
– константа диссоциации по первой
ступени – табл. величина).
К2 – константа диссоциации по второй ступени – табл. величина).
 .
Тогда [S2-]
= 1·10-14
моль/л.
.
Тогда [S2-]
= 1·10-14
моль/л.
Пример 6. Вычислите концентрацию ионов водорода в 0,1 М растворе хлорноватистой кислоты (Ка = 5 · 10-8).
Решение.
Находим степень диссоциации хлорноватистой
кислоты:
 .
Отсюда [Н+]
= α · См
= 7 · 10-4
· 0,1 = 7 · 10-5
моль/л.
.
Отсюда [Н+]
= α · См
= 7 · 10-4
· 0,1 = 7 · 10-5
моль/л.
Пример 7. Степень диссоциации уксусной кислоты в 0,1 М растворе равна 1,32 · 10-2. найдите константу диссоциации кислоты и значение рКа.
Решение.
Подставляем данные задачи в уравнение
закона разбавления Оствальда:
 .
Находим рКа
= -lg
Ka=
- lg(1,77
· 10-5)
= 5 – lg
1,77 = 5 – 0,25 = 4,75.
.
Находим рКа
= -lg
Ka=
- lg(1,77
· 10-5)
= 5 – lg
1,77 = 5 – 0,25 = 4,75.
Пример 8. Вычислите ионную силу и активность ионов в растворе, содержащем 0,01 моль/л MgSO4 и 0,01 моль/л MgCl2.
Решение. Определяем ионную силу раствора:

Находим
коэффициенты активности ионов по
формуле:

 ;
f
= 0.3
;
f
= 0.3
 ;
f
= 0,74.
;
f
= 0,74.
Находим активность каждого иона по формуле, а = f · См:
a(Mg2+) = 0,02 · 0,3 = 0,006 моль/л;
a(SO42-) = 0,01 · 0,3 = 0,003 моль/л;
a(Cl-) = 0,02 · 0,74 = 0,0148 моль/л.
Индивидуальные задания
Задание. Решите задачи своего варианта (табл. 48).
Таблица 48
