
- •C.М. Дрюцкая
- •Введение
- •Тема 1. Введение. Классы и номенклатура неорганических соединений. Основные законы и понятия химии. Закон эквивалентов.
- •1.1. Теоретические сведения
- •Химические свойства оксидов
- •Получение кислот
- •Химические свойства кислот
- •Получение оснований
- •Химические свойства оснований
- •Получение солей
- •Химические свойства средних солей
- •Числовые приставки
- •Систематические и тривиальные названия некоторых веществ
- •Систематические и международные названия некоторых сложных веществ
- •Названия наиболее распространенных кислот и их анионов
- •1.2. Контрольные вопросы и задания
- •1.3. Примеры решения задач
- •1.4. Индивидуальные задания
- •Варианты контрольного задания
- •Варианты контрольного задания
- •1.5. Тестовые задания
- •Тема 2. Способы выражения концентрации (состава) раствора.
- •2.1. Теоретические сведения
- •2.2. Контрольные вопросы и задания
- •2.3. Примеры решения задач
- •2.4. Индивидуальные задания
- •Варианты контрольного задания
- •2.5. Тестовые задания
- •Тема 3. Химическая термодинамика.
- •3.1. Теоретические сведения
- •3.2. Контрольные вопросы и задания
- •3.3. Примеры решения задач
- •Стандартные термодинамические функции
- •3.4. Индивидуальные задания
- •Варианты контрольного задания
- •Варианты контрольного задания
- •3.5. Тестовые задания
- •Тема 4. Химическая кинетика. Термодинамика химического равновесия
- •4.1.Теоретические сведения
- •4.2. Контрольные вопросы и задания
- •4.3. Примеры решения задач
- •4.4. Индивидуальные задания
- •Варианты контрольного задания
- •4.5. Тестовые задания
- •Тема 5. Строение атома. Периодический закон и периодическая система элементов д.И. Менделеева. Химическая связь и строение соединений. Межмолекулярные взаимодействия.
- •5.1. Теоретические сведения
- •Основные характеристики протона, нейтрона и электрона
- •Корпускулярно-волновые свойства частиц
- •Число подуровней на энергетических уровнях
- •Число орбиталей на энергетических подуровнях
- •Последовательность заполнение атомных орбиталей
- •Электронные формулы элементов
- •Потенциалы (энергии) ионизации i1, эВ
- •Потенциалы (энергии) ионизации i1, эВ элементов V группы
- •Значение энергии (Eср) сродства к электрону для некоторых атомов.
- •Относительная электроотрицательность элементов
- •Свойства веществ в разных агрегатных состояниях
- •Сравнительная характеристика аморфных и кристаллических веществ
- •Свойства кристаллических решеток
- •5.2. Контрольные вопросы и задания
- •5.3. Примеры решения задач
- •План характеристики элемента по положению в Периодической системе д.И. Менделеева
- •5.4. Индивидуальные задания
- •Варианты контрольного задания
- •Исходные данные
- •5.5. Тестовые задания
- •Тема 6. Реакции с переносом электронов. Окислительно-восстановительные равновесия и процессы
- •6.1. Теоретические сведения
- •Характеристика элементов и их соединений в овр
- •Типы овр
- •Составление уравнений окислительно-восстановительных реакций
- •Участие ионов в различных средах
- •Стандартные электродные потенциалы металлов
- •6.2. Контрольные вопросы и задания
- •6.3. Примеры решения задач
- •6.4. Индивидуальные задания
- •Варианты контрольного задания
- •Исходные данные
- •6.5. Тестовые задания
- •Тема 7. Лигандообменные равновесия и процессы. Комплексные соединения
- •Координационные числа ионов - комплексообразователей
- •Основные комплексообразователи в кс
- •Среднее поле
- •Слабое поле
- •Геометрическая структура кс и тип гибридизации
- •Видимый спектр длин волн (нм) и окраска кс при их поглощении
- •Варианты контрольного задания
- •Тема 8. Осмотические свойства растворов. Протолитические равновесия и процессы. Электролитическая ионизация. Степень и константа ионизации
- •Теория электролитической ионизации (диссоциации).
- •Варианты контрольного задания
- •Тема 9. Гетерогенные равновесия и процессы. Произведение растворимости, условия образования и растворения осадков
- •Условия смещения гетерогенного равновесия:
- •Варианты контрольного задания
- •Тема 10. Ионное произведение воды. РН. Гидролиз солей
- •Изменение окраски некоторых индикаторов
- •Примеры буферных растворов.
- •Уравнения Гендерсона – Гассельбаха
- •Варианты контрольного задания
- •Объем учебной дисциплины «Общая и неорганическая химия» и виды учебной работы для студентов очного отделения фармацевтического факультета
- •Календарный план лабораторных занятий по общей и неорганической химии для студентов дневного отделения фармацевтического факультета
- •I семестр (продолжительность - 5 часов)
- •Календарный план лекций по общей и неорганической химии для студентов дневного отделения фармацевтического факультета
- •I семестр (продолжительность - 2 часа)
- •Название важнейших кислот и солей.
- •Значения некоторых фундаментальных физческих постоянных
- •Термодинамические свойства веществ.
- •Стандартные электродные потенциалы (е0) некоторых систем
- •Константы устойчивости комплексных ионов
- •Константы нестойкости некоторых комплексных ионов
- •Константы ионизации кислот и оснований (Ки)
- •Коэффициенты активности (f) ионов при ионных силах раствора
- •Растворимость кислот, оснований и солей в воде
- •Константы растворимости
- •Ответы тестовых заданий
- •Оглавление
Тема 1. Введение. Классы и номенклатура неорганических соединений. Основные законы и понятия химии. Закон эквивалентов.
1.1. Теоретические сведения
Химия – это естественная наука о веществах, их строении, свойствах и взаимопревращениях.
Важнейшей задачей химии является получение веществ и материалов с нужными для различных конкретных целей свойствами.
Вещество и поле – две формы существования материи. Вещество – это форма материи, которая обладает собственной массой, т.е. массой покоя. Химия изучает главным образом вещество, организованное в атомы, молекулы, ионы и радикалы. Поле – форма существования материи, которая тесно связана с энергией. Посредством поля осуществляется взаимодействие между частицами вещества. Классификация веществ приведена на рис.1 (в данном курсе рассматриваются разделы неорганической химии, то и внимание уделено неорганическим веществам).
 Рис.
1. Классификация веществ
Рис.
1. Классификация веществ
Оксиды – это бинарные соединения, состоящие из атомов химического элемента и кислорода. Общая формула оксидов: ЭхОY. Получены оксиды всех элементов, кроме Ne, Ar, He.
Выделяют две группы оксидов:
солеобразующие: основные – их образуют атомы металлов I - IIА групп (исключение Ве) и атомы металлов В групп в низших степенях окисления (+1, +2) (Na2O, CaO, MnO);
кислотные – их образуют не металлы, и металлы побочных подгрупп в высших степенях окисления (СО2, Р2О5, Mn2O7) Большинство кислотных оксидов растворимо и взаимодействуют с водой с образованием кислот (приложение 2):
амфотерные – их образуют металлы главных и металлы побочных подгрупп промежуточных в степенях окисления (+ 3, +4, +5) (ВеО, Al2O3, ZnO, MnO2). Практически все амфотерные оксиды нерастворимы и не взаимодействуют с водой.
несолеобразующие: оксиды (СО, N2O, NO, SiO), не образующие гидроксидов ни кислотных, ни основных, и средних солей. Взаимодействуют с металлами с образованием комплексных соединений.
Таблица 1
Химические свойства оксидов
|
Основные |
Амфотерные |
Кислотные |
|
Реагируют с избытком кислоты с образованием соли и воды. Основным оксидам соответствуют основания. 1. Взаимодействие с водой (оксиды щелочных и щелочноземельных металлов)
2. С кислотами
3. С кислотными оксидами
4. С амфотерными оксидами
|
Проявляют свойства основных и кислотных оксидов 1. Взаимодействуют как с кислотами, так и с основаниями
2.
Реагируют с основными и кислотными
оксидами
|
Реагируют с избытком щелочи с образованием соли и воды. Кислотным оксидам часто соответствуют кислоты.
1.
Большинство взаимодействуют с водой
(искл.
2. Со щелочами
4.
С амфотерными оксидами
|
Гидроксиды – продукты прямого или косвенного взаимодействия оксидов с водой. Общая формула гидроксидов: ЭхОY · nH2O. По химическим свойствам различают кислотные (НХЭОу), основные и амфотерные (Ме(ОН)n) гидроксиды, соответствующие кислотным, основным и амфотерным оксидам.
Кислотные гидроксиды (кислоты) - сложные вещества, молекулы которых состоят из атомов водорода и кислотных остатков. Получение и свойства (см. табл. 2,3).
Кислоты классифицируют по нескольким признакам:
1)
по составу
кислотного остатка
– кислородсодержащие ( )
и бескислородные (
)
и бескислородные ( );
);
2)
по основности
(количеству атомов водорода, способных
замещаться атомами металла) – одноосновные
( )
двухосновные (
)
двухосновные ( ),
трехосновные (
),
трехосновные ( ).
).
3)
по силе
электролита
– сильные ( ),
средней силы (
),
средней силы ( ),
слабые (
),
слабые ( ).
).
Таблица 2



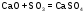





 )
)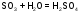
 3.
С основными оксидами
3.
С основными оксидами

