
- •C.М. Дрюцкая
- •Введение
- •Тема 1. Введение. Классы и номенклатура неорганических соединений. Основные законы и понятия химии. Закон эквивалентов.
- •1.1. Теоретические сведения
- •Химические свойства оксидов
- •Получение кислот
- •Химические свойства кислот
- •Получение оснований
- •Химические свойства оснований
- •Получение солей
- •Химические свойства средних солей
- •Числовые приставки
- •Систематические и тривиальные названия некоторых веществ
- •Систематические и международные названия некоторых сложных веществ
- •Названия наиболее распространенных кислот и их анионов
- •1.2. Контрольные вопросы и задания
- •1.3. Примеры решения задач
- •1.4. Индивидуальные задания
- •Варианты контрольного задания
- •Варианты контрольного задания
- •1.5. Тестовые задания
- •Тема 2. Способы выражения концентрации (состава) раствора.
- •2.1. Теоретические сведения
- •2.2. Контрольные вопросы и задания
- •2.3. Примеры решения задач
- •2.4. Индивидуальные задания
- •Варианты контрольного задания
- •2.5. Тестовые задания
- •Тема 3. Химическая термодинамика.
- •3.1. Теоретические сведения
- •3.2. Контрольные вопросы и задания
- •3.3. Примеры решения задач
- •Стандартные термодинамические функции
- •3.4. Индивидуальные задания
- •Варианты контрольного задания
- •Варианты контрольного задания
- •3.5. Тестовые задания
- •Тема 4. Химическая кинетика. Термодинамика химического равновесия
- •4.1.Теоретические сведения
- •4.2. Контрольные вопросы и задания
- •4.3. Примеры решения задач
- •4.4. Индивидуальные задания
- •Варианты контрольного задания
- •4.5. Тестовые задания
- •Тема 5. Строение атома. Периодический закон и периодическая система элементов д.И. Менделеева. Химическая связь и строение соединений. Межмолекулярные взаимодействия.
- •5.1. Теоретические сведения
- •Основные характеристики протона, нейтрона и электрона
- •Корпускулярно-волновые свойства частиц
- •Число подуровней на энергетических уровнях
- •Число орбиталей на энергетических подуровнях
- •Последовательность заполнение атомных орбиталей
- •Электронные формулы элементов
- •Потенциалы (энергии) ионизации i1, эВ
- •Потенциалы (энергии) ионизации i1, эВ элементов V группы
- •Значение энергии (Eср) сродства к электрону для некоторых атомов.
- •Относительная электроотрицательность элементов
- •Свойства веществ в разных агрегатных состояниях
- •Сравнительная характеристика аморфных и кристаллических веществ
- •Свойства кристаллических решеток
- •5.2. Контрольные вопросы и задания
- •5.3. Примеры решения задач
- •План характеристики элемента по положению в Периодической системе д.И. Менделеева
- •5.4. Индивидуальные задания
- •Варианты контрольного задания
- •Исходные данные
- •5.5. Тестовые задания
- •Тема 6. Реакции с переносом электронов. Окислительно-восстановительные равновесия и процессы
- •6.1. Теоретические сведения
- •Характеристика элементов и их соединений в овр
- •Типы овр
- •Составление уравнений окислительно-восстановительных реакций
- •Участие ионов в различных средах
- •Стандартные электродные потенциалы металлов
- •6.2. Контрольные вопросы и задания
- •6.3. Примеры решения задач
- •6.4. Индивидуальные задания
- •Варианты контрольного задания
- •Исходные данные
- •6.5. Тестовые задания
- •Тема 7. Лигандообменные равновесия и процессы. Комплексные соединения
- •Координационные числа ионов - комплексообразователей
- •Основные комплексообразователи в кс
- •Среднее поле
- •Слабое поле
- •Геометрическая структура кс и тип гибридизации
- •Видимый спектр длин волн (нм) и окраска кс при их поглощении
- •Варианты контрольного задания
- •Тема 8. Осмотические свойства растворов. Протолитические равновесия и процессы. Электролитическая ионизация. Степень и константа ионизации
- •Теория электролитической ионизации (диссоциации).
- •Варианты контрольного задания
- •Тема 9. Гетерогенные равновесия и процессы. Произведение растворимости, условия образования и растворения осадков
- •Условия смещения гетерогенного равновесия:
- •Варианты контрольного задания
- •Тема 10. Ионное произведение воды. РН. Гидролиз солей
- •Изменение окраски некоторых индикаторов
- •Примеры буферных растворов.
- •Уравнения Гендерсона – Гассельбаха
- •Варианты контрольного задания
- •Объем учебной дисциплины «Общая и неорганическая химия» и виды учебной работы для студентов очного отделения фармацевтического факультета
- •Календарный план лабораторных занятий по общей и неорганической химии для студентов дневного отделения фармацевтического факультета
- •I семестр (продолжительность - 5 часов)
- •Календарный план лекций по общей и неорганической химии для студентов дневного отделения фармацевтического факультета
- •I семестр (продолжительность - 2 часа)
- •Название важнейших кислот и солей.
- •Значения некоторых фундаментальных физческих постоянных
- •Термодинамические свойства веществ.
- •Стандартные электродные потенциалы (е0) некоторых систем
- •Константы устойчивости комплексных ионов
- •Константы нестойкости некоторых комплексных ионов
- •Константы ионизации кислот и оснований (Ки)
- •Коэффициенты активности (f) ионов при ионных силах раствора
- •Растворимость кислот, оснований и солей в воде
- •Константы растворимости
- •Ответы тестовых заданий
- •Оглавление
4.5. Тестовые задания
Скорость химических процессов при введении в систему катализатора увеличивается за счет:
а) увеличения кинетической энергии молекул
б) возрастания числа столкновений
в) уменьшения числа активных молекул
г) уменьшения энергии активации
Равновесие гетерогенной системы СО2(г) + С(графит) ↔ 2СО(г) смещается в сторону исходных веществ путем:
а) увеличение объема
б) повышения давления
в) повышение концентрации углекислого газа
г) понижение концентрации угарного газа
Закон «действующих масс» (Гульберг, Вааге) устанавливает зависимость скорости реакции от:
а) температуры процесса
б) химической природы реагирующих веществ
в) концентрации реагирующих веществ
г) катализатора
Кинетическим уравнением для гомогенного процесса 2NО(г)+О2(г)=2NО2(г) является:
а)
 в)
в)
б)  г)
г)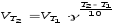
Укажите определение энергии активации химического процесса:
а) общий запас внутренней энергии системы;
б) разница между потенциальной энергией молекул продуктов реакции и исходных веществ
в) внутренняя энергия химической системы, способная совершать механическую работу.
г) избыточная кинетическая энергия молекул, которая позволяет разрушить связи между атомами, что приводит к образованию новых химических связей.
Скорость реакции
 и увеличении количества реагентов в 4
раза возрастет в
и увеличении количества реагентов в 4
раза возрастет в
а) 4 раза б) 8 раз в) 16 раз г) 32 раза
При охлаждении равновесие реакции

а) сместиться влево
б) сместиться в право
в) не сместиться
Для смещения равновесия реакции
 вправо, необходимо:
вправо, необходимо:
а) увеличить концентрацию О2; в) повысить температуру
б) увеличить концентрацию CS2; г) повысить давление
Химическое равновесие смещается за счет:
а) изменения температуры процесса
б) введения катализатора
в) увеличение концентрации реагирующих веществ
г) изменения давления
Изменение концентрации одного из реагирующих веществ в единицу времени в единице реакционного пространства, называется_______ .
Тема 5. Строение атома. Периодический закон и периодическая система элементов д.И. Менделеева. Химическая связь и строение соединений. Межмолекулярные взаимодействия.
5.1. Теоретические сведения
Химические свойства любого элемента определяются строением его атома. С исторической точки зрения, теория строения атома последовательно разрабатывалась: Э. Резерфордом, Н. Бором, Л. де Бройлем, Э. Шредингером и т.д.
Атом представляет собой сложную электронейтральную микросистему находящихся в движении элементарных частиц. Он состоит из положительно заряженного ядра, в котором сосредоточена почти вся масса атома, и отрицательно заряженных электронов, в совокупности образующих электронную оболочку. Ядро содержит протоны, нейтроны и другие элементарные частицы.
Таблица 25
Основные характеристики протона, нейтрона и электрона
|
Частица |
Символ |
Масса покоя |
Заряд, Кл | ||
|
кг |
а.е.м. | ||||
|
протон |
р |
1,678·10-27 |
1,007276 |
1,602·10-19 | |
|
нейтрон |
п |
1,675·10-27 |
1,008665 |
0 | |
|
электрон |
е |
9,108·10-31 |
0,00549 |
1,602·10-19 | |
Размеры и массы атомов малы. Радиус атомов составляет 10-10 м, а радиус ядра – 10-15 м. Масса атома определяется делением массы одного моль атомов элемента на число атомов в 1 моль (NA = 6,02·1023 моль-1). Масса атомов изменяется в пределах 10-27~ 10-25 кг. Обычно массу атомов выражают в атомных единицах массы (а.е.м.). За а.е.м. принята 1/12 массы атома изотопа углерода 12С.
Основными характеристиками атома являются заряд его ядра (Z) и массовое число (А). Число электронов в атоме равно заряду его ядра. Свойства атомов определяются зарядом их ядер, числом электронов и их состоянием в атоме.
Основные свойства и строение ядра (теория состава атомных ядер)
1. Ядра атомов всех элементов (за исключением водорода) состоят из протонов и нейтронов.
2.Число протонов в ядре определяет значение его положительного заряда (Z). Z - порядковый номер химического элемента в периодической системе Менделеева.
3. Суммарное число протонов и нейтронов - значение его массы, так как масса атома в основном сосредоточена в ядре (99, 97% массы атома). Ядерные частицы - протоны и нейтроны - объединяются под общим названием нуклоны (от латинского слова nucleus, что означает “ядро”). Общее число нуклонов соответствует - массовому числу, т.е. округленной до целого числа его атомной массе А.
A=N+Z
Ядра с одинаковыми Z, но различными А называются изотопами. Ядра, которые при одинаковом А имеют различные Z, называются изобарами. Всего известно около 300 устойчивых изотопов химических элементов и более 2000 естественных и искусственно полученных радиоактивных изотопов
4. Число нейтронов в ядре N может быть найдено по разности между массовым числом (А) и порядковым номером (Z):
N = A - Z
5. Размер ядра характеризуется радиусом ядра, имеющим условный смысл ввиду размытости границы ядра.
Плотность ядерного вещества составляет по порядку величины 1017кг/м3 и постоянна для всех ядер. Она значительно превосходит плотности самых плотных обычных веществ.
Протонно-нейтронная теория позволила разрешить возникшие ранее противоречия в представлениях о составе атомных ядер и о его связи с порядковым номером и атомной массой.
Энергия связи ядраопределяется величиной той работы, которую нужно совершить, чтобы расщепить ядро на составляющие его нуклоны без придания им кинетической энергии. Из закона сохранения энергии следует, что при образовании ядра должна выделяться такая же энергия, какую нужно затратить при расщеплении ядра на составляющие его нуклоны. Энергия связи ядра является разностью между энергией всех свободных нуклонов, составляющих ядро, и их энергией в ядре.
При образовании ядра происходит уменьшение его массы: масса ядра меньше, чем сумма масс составляющих его нуклонов. Уменьшение массы ядра при его образовании объясняется выделением энергии связи. Если Wсв- величина энергии, выделяющейся при образовании ядра, то соответствующая ей масса Dm, равная
 (53)
(53)
называется дефектом массыи характеризует уменьшение суммарной массы при образовании ядра из составляющих его нуклонов. Одной атомной единице массы соответствуетатомная единица энергии(а.е.э.): а.е.э.=931,5016 МэВ.
Удельной
энергией связи ядра wсвназывается
энергия связи, приходящаяся на один
нуклон:wсв= .
Величинаwсвсоставляет в
среднем 8 МэВ/нуклон. По мере увеличения
числа нуклонов в ядре удельная энергия
связи убывает.
.
Величинаwсвсоставляет в
среднем 8 МэВ/нуклон. По мере увеличения
числа нуклонов в ядре удельная энергия
связи убывает.
Критерием устойчивости атомных ядерявляется соотношение между числом протонов и нейтронов в устойчивом ядре для данных изобаров. (А= const).
Ядерные силы
1. Ядерное взаимодействие свидетельствует о том, что в ядрах существуют особые ядерные силы, не сводящиеся ни к одному из типов сил, известных в классической физике (гравитационных и электромагнитных).
2. Ядерные силы являются короткодействующими силами. Они проявляются лишь на весьма малых расстояниях между нуклонами в ядре порядка 10-15м. Длина (1,5ј2,2)10-15м называетсярадиусом действия ядерных сил.
3.
Ядерные силы обнаруживают зарядовую
независимость: притяжение между двумя
нуклонами одинаково независимо от
зарядового состояния нуклонов - протонного
или нуклонного. Зарядовая независимость
ядерных сил видна из сравнения энергий
связи взеркальных ядрах. Так
называются ядра, в которых одинаково
общее число нуклонов, но число протонов
в одном равно числу нейтронов в другом.
Например, ядра гелия тяжелого водорода трития -
тяжелого водорода трития - .
.
4. Ядерные силы обладают свойством насыщения, которое проявляется в том, что нуклон в ядре взаимодействует лишь с ограниченным числом ближайших к нему соседних нуклонов. Именно поэтому наблюдается линейная зависимость энергий связи ядер от их массовых чисел (А). Практически полное насыщение ядерных сил достигается у a-частицы, которая является очень устойчивым образованием.
Радиоактивность, g -излучение, a и b - распад
1. Радиоактивностьюназывается превращение неустойчивых изотопов одного химического элемента в изотопы другого элемента, сопровождающееся испусканием элементарных частиц, ядер или жесткого рентгеновского излучения.Естественной радиоактивностьюназывается радиоактивность, наблюдающаяся у существующих в природе неустойчивых изотопов.Искусственной радиоактивностьюназывается радиоактивность изотопов, полученных в результате ядерных реакций.
2. Обычно все типы радиоактивности сопровождаются испусканием гамма-излучения - жесткого, коротковолнового электроволнового излучения. Гамма-излучение является основной формой уменьшения энергии возбужденных продуктов радиоактивных превращений. Ядро, испытывающее радиоактивный распад, называется материнским; возникающеедочернееядро, как правило, оказывается возбужденным, и его переход в основное состояние сопровождается испусканием g-фотона.
3.
Альфа-распадомназывается испускание
ядрами некоторых химических элементовa- частиц. Альфа-распад
является свойством тяжелых ядер с
массовыми числамиА>200 и зарядами
ядерZ>82. Внутри таких ядер происходит
образование обособленныхa-частиц,
состоящих каждая из двух протонов и
двух нейтронов, т.е.образуется атом
элемента, смещенного в таблице
периодической системы элементов Д.И.
Менделеева (ПСЭ) на две клеточки влево
от исходного радиоактивного элемента
с массовым числом меньшим не 4 единицы(правило Содди – Фаянса):
4. Термином бета-распад обозначают три типа ядерных превращений: электронный(b-) ипозитронный(b+) распады, а такжеэлектронный захват.
b-
распад происходит преимущественно у
сравнительно богатых нейтронами ядер.
При этом нейтрон ядра распадается на
протон, электрон и антинейтрино ( )
с нулевым зарядом и массой.
)
с нулевым зарядом и массой.

При b- распаде массовое число изотопа не изменяется, так как общее число протонов и нейтронов сохраняется, а заряд увеличивается на 1. Поэтому, атом образовавшегося химического элемента смещается ПСЭ на одну клеточку вправо от исходного элемента, а его массовое число не изменяется (правило Содди – Фаянса):

b+-
распад происходит преимущественно у
относительно богатых протонами ядер.
При этом протон ядра распадается на
нейтрон, позитрон и нейтрино( ).
).
 .
.
При b+- распаде массовое число изотопа не изменяется, так как общее число протонов и нейтронов сохраняется, а заряд уменьшается на 1. Поэтому, атом образовавшегося химического элемента смещается ПСЭ на одну клеточку влево от исходного элемента, а его массовое число не изменяется (правило Содди – Фаянса):

5. В случае электронного захвата превращение заключается в том, что исчезает один из электронов в ближайшем к ядру слое. Протон, превращаясь в нейтрон, как бы “захватывает” электрон; отсюда произошел термин ”электронный захват”. Электронный захват в отличие от b±-захвата сопровождается характеристическим рентгеновским излучением.
6. b--распад происходит у естественно-радиоактивных, а также искусственно-радиоактивных ядер;b+-распад характерен только для явления искусственной радиоактивности.
7. g- излучение: при возбуждении ядро атома испускает электромагнитное излучение с малой длиной волны и высокой частотой, обладающее большой жесткостью и проникающей способностью, чем рентгеновское излучение. В результате энергия ядра уменьшается, а массовое число и заряд ядра остаются не низменными. Поэтому превращение химического элемента в другой не наблюдается, а ядро атома переходит в менее возбужденное состояние.
