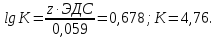- •C.М. Дрюцкая
- •Введение
- •Тема 1. Введение. Классы и номенклатура неорганических соединений. Основные законы и понятия химии. Закон эквивалентов.
- •1.1. Теоретические сведения
- •Химические свойства оксидов
- •Получение кислот
- •Химические свойства кислот
- •Получение оснований
- •Химические свойства оснований
- •Получение солей
- •Химические свойства средних солей
- •Числовые приставки
- •Систематические и тривиальные названия некоторых веществ
- •Систематические и международные названия некоторых сложных веществ
- •Названия наиболее распространенных кислот и их анионов
- •1.2. Контрольные вопросы и задания
- •1.3. Примеры решения задач
- •1.4. Индивидуальные задания
- •Варианты контрольного задания
- •Варианты контрольного задания
- •1.5. Тестовые задания
- •Тема 2. Способы выражения концентрации (состава) раствора.
- •2.1. Теоретические сведения
- •2.2. Контрольные вопросы и задания
- •2.3. Примеры решения задач
- •2.4. Индивидуальные задания
- •Варианты контрольного задания
- •2.5. Тестовые задания
- •Тема 3. Химическая термодинамика.
- •3.1. Теоретические сведения
- •3.2. Контрольные вопросы и задания
- •3.3. Примеры решения задач
- •Стандартные термодинамические функции
- •3.4. Индивидуальные задания
- •Варианты контрольного задания
- •Варианты контрольного задания
- •3.5. Тестовые задания
- •Тема 4. Химическая кинетика. Термодинамика химического равновесия
- •4.1.Теоретические сведения
- •4.2. Контрольные вопросы и задания
- •4.3. Примеры решения задач
- •4.4. Индивидуальные задания
- •Варианты контрольного задания
- •4.5. Тестовые задания
- •Тема 5. Строение атома. Периодический закон и периодическая система элементов д.И. Менделеева. Химическая связь и строение соединений. Межмолекулярные взаимодействия.
- •5.1. Теоретические сведения
- •Основные характеристики протона, нейтрона и электрона
- •Корпускулярно-волновые свойства частиц
- •Число подуровней на энергетических уровнях
- •Число орбиталей на энергетических подуровнях
- •Последовательность заполнение атомных орбиталей
- •Электронные формулы элементов
- •Потенциалы (энергии) ионизации i1, эВ
- •Потенциалы (энергии) ионизации i1, эВ элементов V группы
- •Значение энергии (Eср) сродства к электрону для некоторых атомов.
- •Относительная электроотрицательность элементов
- •Свойства веществ в разных агрегатных состояниях
- •Сравнительная характеристика аморфных и кристаллических веществ
- •Свойства кристаллических решеток
- •5.2. Контрольные вопросы и задания
- •5.3. Примеры решения задач
- •План характеристики элемента по положению в Периодической системе д.И. Менделеева
- •5.4. Индивидуальные задания
- •Варианты контрольного задания
- •Исходные данные
- •5.5. Тестовые задания
- •Тема 6. Реакции с переносом электронов. Окислительно-восстановительные равновесия и процессы
- •6.1. Теоретические сведения
- •Характеристика элементов и их соединений в овр
- •Типы овр
- •Составление уравнений окислительно-восстановительных реакций
- •Участие ионов в различных средах
- •Стандартные электродные потенциалы металлов
- •6.2. Контрольные вопросы и задания
- •6.3. Примеры решения задач
- •6.4. Индивидуальные задания
- •Варианты контрольного задания
- •Исходные данные
- •6.5. Тестовые задания
- •Тема 7. Лигандообменные равновесия и процессы. Комплексные соединения
- •Координационные числа ионов - комплексообразователей
- •Основные комплексообразователи в кс
- •Среднее поле
- •Слабое поле
- •Геометрическая структура кс и тип гибридизации
- •Видимый спектр длин волн (нм) и окраска кс при их поглощении
- •Варианты контрольного задания
- •Тема 8. Осмотические свойства растворов. Протолитические равновесия и процессы. Электролитическая ионизация. Степень и константа ионизации
- •Теория электролитической ионизации (диссоциации).
- •Варианты контрольного задания
- •Тема 9. Гетерогенные равновесия и процессы. Произведение растворимости, условия образования и растворения осадков
- •Условия смещения гетерогенного равновесия:
- •Варианты контрольного задания
- •Тема 10. Ионное произведение воды. РН. Гидролиз солей
- •Изменение окраски некоторых индикаторов
- •Примеры буферных растворов.
- •Уравнения Гендерсона – Гассельбаха
- •Варианты контрольного задания
- •Объем учебной дисциплины «Общая и неорганическая химия» и виды учебной работы для студентов очного отделения фармацевтического факультета
- •Календарный план лабораторных занятий по общей и неорганической химии для студентов дневного отделения фармацевтического факультета
- •I семестр (продолжительность - 5 часов)
- •Календарный план лекций по общей и неорганической химии для студентов дневного отделения фармацевтического факультета
- •I семестр (продолжительность - 2 часа)
- •Название важнейших кислот и солей.
- •Значения некоторых фундаментальных физческих постоянных
- •Термодинамические свойства веществ.
- •Стандартные электродные потенциалы (е0) некоторых систем
- •Константы устойчивости комплексных ионов
- •Константы нестойкости некоторых комплексных ионов
- •Константы ионизации кислот и оснований (Ки)
- •Коэффициенты активности (f) ионов при ионных силах раствора
- •Растворимость кислот, оснований и солей в воде
- •Константы растворимости
- •Ответы тестовых заданий
- •Оглавление
6.2. Контрольные вопросы и задания
Электронная теория ОВР Писаржевского Л.В.
Степени окисления и правила их расчета.
Окислительно-восстановительная двойственность.
Механизм возникновения электродного потенциала
Стандартный электродный потенциал. Формула Нернста.
Гальванический элемент. Направленность окислительно-восстановительных процессов.
Составление уравнений ОВР методом полуреакций.
Влияние среды на ОВР.
Значение ОВР в биологических процессах.
6.3. Примеры решения задач
Пример 1. Расставьте степени окисления элементов в представленной реакции. Уравняйте реакцию методом полуреакций, укажите окислитель, восстановитель, процессы окисления и восстановления. Рассчитайте молярные массы эквивалента окислителя и восстановителя. Найдите значения стандартных ЭДС, энергии Гиббса и константы равновесия реакции: Cu + HNO3 → Cu(NO3)2 + NO + H2O.
Решение. Расставляем степени окисления:
Cu0 + H+ + NO3- → Cu2+ + 2NO3- + N2+O2- + H+2O2-.
Переписываем его в сокращенном виде с учетом частиц, которые участвуют в ОВР: Cu0 + H+ + NO3- → Cu2+ + N2+O2- + H+2O2-.
Составляем схему процессов с учетом среды:
Cu0 – 2е → Cu2+ - восстановитель, процесс окисления
N5+O3- + 3е + 4H+ → N2+O2- + 2H2O – окислитель, процесс восстановления.
Для составления общего уравнения реакции уравниваем число отданных и принятых электронов, складываем полуреакции с учетом коэффициентов:
3│Cu0 – 2е → Cu2+
2│N5+O3- + 3е + 4H+ → N2+O2- + 2H2O
3Cu0 + 8H+ + 2NO3- → 3Cu2+ + 2NO +4 H2O
Молекулярное уравнение имеет вид: 3Cu+8HNO3→3Cu(NO3)2 +2NO+4H2O
МЭ (окислителя) = Мr(HNO3) / 3 = 63/3 = 21 г/моль;
МЭ (восстановителя) = Мr(Cu) / 2 = 64/2 = 32 г/моль.
ЭДС = Е0окислителя – Е0восстановителя
Е0 (Cu0|Cu2+) = 0,34 (табл. величина)
E0(NO3-| NO) = 0,96 (табл. величина)
ЭДС = 0,96-0,34 = 0,62 В > 0, следовательно ОВР протекает в прямом направлении.
Энергия Гиббса рассчитывается по формуле: ΔG0хр = - z· F · ЭДС = 6 · 96500 · 0,62 = - 358980 Дж = - 358,98 кДж. ΔG < 0, следовательно, процесс идет самопроизвольно.
Находим константу равновесия при стандартных условиях: lgK = z·ЭДС /0,059 = 6· 0,62/0,059 = 63. Следовательно, Кр = 1·1063. Согласно константе равновесия (Кр > 1) ОВР смещается вправо, в сторону продуктов реакции.
Пример 2. Установите, в каком направлении возможно самопроизвольное протекание реакции 2NaCl + Fe2(SO4)3 = 2FeSO4 + Cl2 + Na2SO4.
Решение. Уравнение реакции в ионно-молекулярной форме имеет вид:
2Cl- + 2Fe+3 = 2Fe+2 + Cl2
Находим стандартные электродные потенциалы электрохимических систем, участвующих в реакции (прил. 5):
Cl2 + 2e = 2Cl- E01 = 1,36 B;
Fe+3 + e = Fe+2 Е02 = 0,77 В.
Поскольку E01> Е02 , то окислителем будет хлор, а восстановителем – ион Fe+2; рассматриваемая реакция протекает справа налево.
Пример 3. Определить направление возможного самопроизвольного протекания реакции 2Hg + 2Ag+ = 2Ag + Hg2+2 при следующих концентрациях (моль/дм3) участвующих в реакции ионов: [Ag+] = 10-1, [Hg2+2] = 10-4.
Решение. Находим стандартные электродные потенциалы электрохимических систем, участвующих в реакции (прил. 5):
Hg2+2 + 2e = 2Hg E01 = 0,79 B;
Ag+ + e = Ag E02 = 0,80 B,
Вычисляем значения электродных потенциалов при указанных в условиях задачи концентрациях:
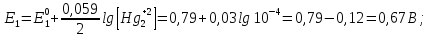
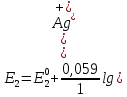
Поскольку Е1< Е2, то реакция протекает слева направо.
Пример 4. Найдите при 250 С константу равновесия реакции:
Hg2(NO3)2 + 2Fe(NO3)2 = 2Hg + 2Fe(NO3)3.
Решение. Уравнение реакции в ионно-молекулярной форме имеет вид:
Hg2+2 + 2Fe+2 = 2Hg + 2Fe+3
Находим стандартные электродные потенциалы электрохимических систем, участвующих в реакции (прил. 5):
Hg2+2 + 2e = 2Hg E01 = 0,79 B - окислитель;
Fe+3 + e = Fe+2 Е02 = 0,77 В - восстановитель.
Находим значение стандартной ЭДС процесса
ЭДС = E01 - Е02 = 0,79 – 0,77 = 0,02 В
Вычисляем константу равновесия реакции: