
- •C.М. Дрюцкая
- •Введение
- •Тема 1. Введение. Классы и номенклатура неорганических соединений. Основные законы и понятия химии. Закон эквивалентов.
- •1.1. Теоретические сведения
- •Химические свойства оксидов
- •Получение кислот
- •Химические свойства кислот
- •Получение оснований
- •Химические свойства оснований
- •Получение солей
- •Химические свойства средних солей
- •Числовые приставки
- •Систематические и тривиальные названия некоторых веществ
- •Систематические и международные названия некоторых сложных веществ
- •Названия наиболее распространенных кислот и их анионов
- •1.2. Контрольные вопросы и задания
- •1.3. Примеры решения задач
- •1.4. Индивидуальные задания
- •Варианты контрольного задания
- •Варианты контрольного задания
- •1.5. Тестовые задания
- •Тема 2. Способы выражения концентрации (состава) раствора.
- •2.1. Теоретические сведения
- •2.2. Контрольные вопросы и задания
- •2.3. Примеры решения задач
- •2.4. Индивидуальные задания
- •Варианты контрольного задания
- •2.5. Тестовые задания
- •Тема 3. Химическая термодинамика.
- •3.1. Теоретические сведения
- •3.2. Контрольные вопросы и задания
- •3.3. Примеры решения задач
- •Стандартные термодинамические функции
- •3.4. Индивидуальные задания
- •Варианты контрольного задания
- •Варианты контрольного задания
- •3.5. Тестовые задания
- •Тема 4. Химическая кинетика. Термодинамика химического равновесия
- •4.1.Теоретические сведения
- •4.2. Контрольные вопросы и задания
- •4.3. Примеры решения задач
- •4.4. Индивидуальные задания
- •Варианты контрольного задания
- •4.5. Тестовые задания
- •Тема 5. Строение атома. Периодический закон и периодическая система элементов д.И. Менделеева. Химическая связь и строение соединений. Межмолекулярные взаимодействия.
- •5.1. Теоретические сведения
- •Основные характеристики протона, нейтрона и электрона
- •Корпускулярно-волновые свойства частиц
- •Число подуровней на энергетических уровнях
- •Число орбиталей на энергетических подуровнях
- •Последовательность заполнение атомных орбиталей
- •Электронные формулы элементов
- •Потенциалы (энергии) ионизации i1, эВ
- •Потенциалы (энергии) ионизации i1, эВ элементов V группы
- •Значение энергии (Eср) сродства к электрону для некоторых атомов.
- •Относительная электроотрицательность элементов
- •Свойства веществ в разных агрегатных состояниях
- •Сравнительная характеристика аморфных и кристаллических веществ
- •Свойства кристаллических решеток
- •5.2. Контрольные вопросы и задания
- •5.3. Примеры решения задач
- •План характеристики элемента по положению в Периодической системе д.И. Менделеева
- •5.4. Индивидуальные задания
- •Варианты контрольного задания
- •Исходные данные
- •5.5. Тестовые задания
- •Тема 6. Реакции с переносом электронов. Окислительно-восстановительные равновесия и процессы
- •6.1. Теоретические сведения
- •Характеристика элементов и их соединений в овр
- •Типы овр
- •Составление уравнений окислительно-восстановительных реакций
- •Участие ионов в различных средах
- •Стандартные электродные потенциалы металлов
- •6.2. Контрольные вопросы и задания
- •6.3. Примеры решения задач
- •6.4. Индивидуальные задания
- •Варианты контрольного задания
- •Исходные данные
- •6.5. Тестовые задания
- •Тема 7. Лигандообменные равновесия и процессы. Комплексные соединения
- •Координационные числа ионов - комплексообразователей
- •Основные комплексообразователи в кс
- •Среднее поле
- •Слабое поле
- •Геометрическая структура кс и тип гибридизации
- •Видимый спектр длин волн (нм) и окраска кс при их поглощении
- •Варианты контрольного задания
- •Тема 8. Осмотические свойства растворов. Протолитические равновесия и процессы. Электролитическая ионизация. Степень и константа ионизации
- •Теория электролитической ионизации (диссоциации).
- •Варианты контрольного задания
- •Тема 9. Гетерогенные равновесия и процессы. Произведение растворимости, условия образования и растворения осадков
- •Условия смещения гетерогенного равновесия:
- •Варианты контрольного задания
- •Тема 10. Ионное произведение воды. РН. Гидролиз солей
- •Изменение окраски некоторых индикаторов
- •Примеры буферных растворов.
- •Уравнения Гендерсона – Гассельбаха
- •Варианты контрольного задания
- •Объем учебной дисциплины «Общая и неорганическая химия» и виды учебной работы для студентов очного отделения фармацевтического факультета
- •Календарный план лабораторных занятий по общей и неорганической химии для студентов дневного отделения фармацевтического факультета
- •I семестр (продолжительность - 5 часов)
- •Календарный план лекций по общей и неорганической химии для студентов дневного отделения фармацевтического факультета
- •I семестр (продолжительность - 2 часа)
- •Название важнейших кислот и солей.
- •Значения некоторых фундаментальных физческих постоянных
- •Термодинамические свойства веществ.
- •Стандартные электродные потенциалы (е0) некоторых систем
- •Константы устойчивости комплексных ионов
- •Константы нестойкости некоторых комплексных ионов
- •Константы ионизации кислот и оснований (Ки)
- •Коэффициенты активности (f) ионов при ионных силах раствора
- •Растворимость кислот, оснований и солей в воде
- •Константы растворимости
- •Ответы тестовых заданий
- •Оглавление
2.2. Контрольные вопросы и задания
1. Дайте определение понятий: раствор, растворитель, растворенное вещество, растворимость.
2. Дайте определение понятий: насыщенные, ненасыщенные, перенасыщенные растворы.
3. Что называется концентрацией раствора?
4. Способы выражения концентрации раствора.
5. Какая связь между молярной, нормальной и процентной концентрацией?
6. Охарактеризуйте правило смешения растворов и его разновидность – «правило креста».
2.3. Примеры решения задач
Пример 1. Определите массовую долю полученного раствора, если 18 дм3 48% раствора серной кислоты (ρ=1,38 г/см3) смешали с 2 дм3 20% раствора серной кислоты (ρ=1,143 г/см3).
Решение. Задачу решаем по формуле (14):
18000 см3·1,38 г/см3·48% + 2000 см3·1,143 г/см3·20% = (18000 см3·1,38 г/см3 + 2000 см3·1,143 г/см3)·Х
24840 г·48% + 2286 г·20% = (24840 г + 2286 г) ·Х
1192320 + 45720 = 27126 ·Х
Х = 45,6% - массовая доля полученного раствора.
Пример 2. Найдите молярную, нормальную и моляльную концентрацию раствора серной кислоты с массовой долей 15% (ρ = 1,10 г/см3).
Решение. Для расчета данных концентраций воспользуемся формулами перерасчета одной концентрации в другую:
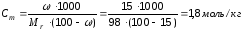


Пример 3. Приготовьте 100 см3 раствора гидроксида калия с массовой долей 5% (ρ=1,032 г/см3) из раствора с массовой долей 40% (ρ=1,308 г/см3). Сколько нужно взять исходного раствора и воды?
Решение. Решаем по правилу креста. В диагональную схему сразу водим плотности. Плотность воды равна 1 г/см3. Тогда разность большего и меньшего значений будет равна объему (см3).
|
1,308
г/см3
(40% раствор) |
|
0,032 см3 40% раствора |
|
|
1.032 г/см3 (5% раствор) |
|
|
1
г/см3
(вода) |
|
0,276 см3 воды |
Находим суммарный объем полученного раствора: 0,032 + 0,276 = 0,307 см3
Составляем пропорцию для нахождения объема исходного 40% раствора:
0,307 см3 – 0,032 см3
100
см3
- Х

Следовательно, для приготовления 100 см3 5% раствора необходимо взять 100-10,4 = 89,6 см3 воды и 10,4 см3 40% раствора гидроксида калия.
Пример 4. Определите титр (г/см3) раствора гашеной извести с молярной концентрацией гидроксида кальция 0,01 моль/дм3.
Решение. Находим массу гидроксида кальция из формулы:
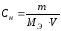 ;
;
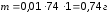
Находим титр раствора:

Пример 5. Найдите массу воды и медного купороса (CuSO4 · 5H2O), необходимого для приготовления 1 дм3 раствора, содержащего 8% безводной соли (ρ = 1,084 г/см3).
Решение. Находим массу полученного раствора:
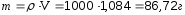
Молярная масса CuSO4 · 5H2O равна 249,7 г/моль
Молярная масса CuSO4 равна 159,6 г/моль
Составляем пропорцию: 249,7 г CuSO4 · 5H2O – 159,6 г CuSO4
Х - 86,7 г

Для приготовления 1 дм3 раствора медного купороса нужно 135,6 г кристаллогидрата CuSO4 · 5H2O и 1084-1354,6 = 948,4 г воды.
Пример 6. На нейтрализацию 50 см3 раствора кислоты израсходовано 25 см3 0,5 н раствора щелочи. Чему равна молярная концентрация эквивалентов кислоты?
Решение.
Вещества взаимодействуют в эквивалентных
количествах. По закону эквивалентов
при разных молярных концентрациях
эквивалентов объемы растворов реагирующих
веществ обратно пропорциональны их
нормальностям:
 ;
СН
= 0,25 н
;
СН
= 0,25 н






