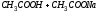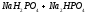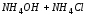- •C.М. Дрюцкая
- •Введение
- •Тема 1. Введение. Классы и номенклатура неорганических соединений. Основные законы и понятия химии. Закон эквивалентов.
- •1.1. Теоретические сведения
- •Химические свойства оксидов
- •Получение кислот
- •Химические свойства кислот
- •Получение оснований
- •Химические свойства оснований
- •Получение солей
- •Химические свойства средних солей
- •Числовые приставки
- •Систематические и тривиальные названия некоторых веществ
- •Систематические и международные названия некоторых сложных веществ
- •Названия наиболее распространенных кислот и их анионов
- •1.2. Контрольные вопросы и задания
- •1.3. Примеры решения задач
- •1.4. Индивидуальные задания
- •Варианты контрольного задания
- •Варианты контрольного задания
- •1.5. Тестовые задания
- •Тема 2. Способы выражения концентрации (состава) раствора.
- •2.1. Теоретические сведения
- •2.2. Контрольные вопросы и задания
- •2.3. Примеры решения задач
- •2.4. Индивидуальные задания
- •Варианты контрольного задания
- •2.5. Тестовые задания
- •Тема 3. Химическая термодинамика.
- •3.1. Теоретические сведения
- •3.2. Контрольные вопросы и задания
- •3.3. Примеры решения задач
- •Стандартные термодинамические функции
- •3.4. Индивидуальные задания
- •Варианты контрольного задания
- •Варианты контрольного задания
- •3.5. Тестовые задания
- •Тема 4. Химическая кинетика. Термодинамика химического равновесия
- •4.1.Теоретические сведения
- •4.2. Контрольные вопросы и задания
- •4.3. Примеры решения задач
- •4.4. Индивидуальные задания
- •Варианты контрольного задания
- •4.5. Тестовые задания
- •Тема 5. Строение атома. Периодический закон и периодическая система элементов д.И. Менделеева. Химическая связь и строение соединений. Межмолекулярные взаимодействия.
- •5.1. Теоретические сведения
- •Основные характеристики протона, нейтрона и электрона
- •Корпускулярно-волновые свойства частиц
- •Число подуровней на энергетических уровнях
- •Число орбиталей на энергетических подуровнях
- •Последовательность заполнение атомных орбиталей
- •Электронные формулы элементов
- •Потенциалы (энергии) ионизации i1, эВ
- •Потенциалы (энергии) ионизации i1, эВ элементов V группы
- •Значение энергии (Eср) сродства к электрону для некоторых атомов.
- •Относительная электроотрицательность элементов
- •Свойства веществ в разных агрегатных состояниях
- •Сравнительная характеристика аморфных и кристаллических веществ
- •Свойства кристаллических решеток
- •5.2. Контрольные вопросы и задания
- •5.3. Примеры решения задач
- •План характеристики элемента по положению в Периодической системе д.И. Менделеева
- •5.4. Индивидуальные задания
- •Варианты контрольного задания
- •Исходные данные
- •5.5. Тестовые задания
- •Тема 6. Реакции с переносом электронов. Окислительно-восстановительные равновесия и процессы
- •6.1. Теоретические сведения
- •Характеристика элементов и их соединений в овр
- •Типы овр
- •Составление уравнений окислительно-восстановительных реакций
- •Участие ионов в различных средах
- •Стандартные электродные потенциалы металлов
- •6.2. Контрольные вопросы и задания
- •6.3. Примеры решения задач
- •6.4. Индивидуальные задания
- •Варианты контрольного задания
- •Исходные данные
- •6.5. Тестовые задания
- •Тема 7. Лигандообменные равновесия и процессы. Комплексные соединения
- •Координационные числа ионов - комплексообразователей
- •Основные комплексообразователи в кс
- •Среднее поле
- •Слабое поле
- •Геометрическая структура кс и тип гибридизации
- •Видимый спектр длин волн (нм) и окраска кс при их поглощении
- •Варианты контрольного задания
- •Тема 8. Осмотические свойства растворов. Протолитические равновесия и процессы. Электролитическая ионизация. Степень и константа ионизации
- •Теория электролитической ионизации (диссоциации).
- •Варианты контрольного задания
- •Тема 9. Гетерогенные равновесия и процессы. Произведение растворимости, условия образования и растворения осадков
- •Условия смещения гетерогенного равновесия:
- •Варианты контрольного задания
- •Тема 10. Ионное произведение воды. РН. Гидролиз солей
- •Изменение окраски некоторых индикаторов
- •Примеры буферных растворов.
- •Уравнения Гендерсона – Гассельбаха
- •Варианты контрольного задания
- •Объем учебной дисциплины «Общая и неорганическая химия» и виды учебной работы для студентов очного отделения фармацевтического факультета
- •Календарный план лабораторных занятий по общей и неорганической химии для студентов дневного отделения фармацевтического факультета
- •I семестр (продолжительность - 5 часов)
- •Календарный план лекций по общей и неорганической химии для студентов дневного отделения фармацевтического факультета
- •I семестр (продолжительность - 2 часа)
- •Название важнейших кислот и солей.
- •Значения некоторых фундаментальных физческих постоянных
- •Термодинамические свойства веществ.
- •Стандартные электродные потенциалы (е0) некоторых систем
- •Константы устойчивости комплексных ионов
- •Константы нестойкости некоторых комплексных ионов
- •Константы ионизации кислот и оснований (Ки)
- •Коэффициенты активности (f) ионов при ионных силах раствора
- •Растворимость кислот, оснований и солей в воде
- •Константы растворимости
- •Ответы тестовых заданий
- •Оглавление
Примеры буферных растворов.
|
Кислотные буферы |
Основные буферы |
|
ацетатный
буфер (рН 3,7-5,4) фосфатный
буфер (рН 5,9-7,6) карбонатный буфер (рН 4,7 – 6,3) Н2СО3 + NaHCO3 цитратный буфер (рН 1,1 – 4,9) H3C6H5O7·NaOH |
аммиачный
буфер (рН 8,4 – 10,3) боратный буфер (рН 8,1 – 10,1) Н3ВО3 + КН2ВО3
|
Такие смеси содержат большой резерв ионных и молекулярных частиц и поэтому обладают способностью поддерживать почти постоянное значение рН при добавлении в них небольших количеств сильной кислоты или сильного основания.
Уравнения Гендерсона – Гассельбаха
для буферных систем 1-го типа (слабая кислота и её анион):
pH = pKa + lg([акцептор протона]/[донор протона])
pH = pKa + lg([соль]/[кислота])
для буферных систем 2-го типа (слабое основание и его катион):
pH = pKa + lg([акцептор протона]/[ донор протона]) = pKa + lg([основание]/[соль])
pH = 14 – pKв - lg([соль]/[основание])
Поясним на ацетатном буфере (система 1 типа: слабая кислота и ее анион).
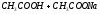 в
растворе существует равновесие:
в
растворе существует равновесие:
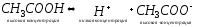
Высокая концентрация ацетат ионов обусловлена полной диссоциацией сильного электролита – ацетата натрия. Если к раствору добавить сильную кислоту (соляную), ацетат ионы будут связывать ионы водорода, образуя слабую (уксусную) кислоту. Если же к раствору добавить сильное основание (гидроксид натрия), молекулы уксусной кислоты будут реагировать с гидроксид ионами с образованием воды и ацетат иона. В обоих случаях низкая концентрация протонов водорода будет оставаться практически постоянной.
Теперь охарактеризуем количественно способность буферной системы поддерживать постоянное значение рН.
Пусть Суксусной кислоты = Сацетата натрия = 0,1 мол/дм3. Киониз. Уксуснй кислоты:
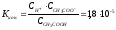
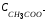 =0,1
моль/дм3
(так как эти ионы получаются в основном
за счет соли), тогда:
=0,1
моль/дм3
(так как эти ионы получаются в основном
за счет соли), тогда:
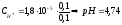
К данному буферу добавим 0,05 моль/дм3 Н+. За счет имеющегося резерва в растворе ацетат ионов большая часть введенных протонов водорода будет нейтрализована: Н+ + СН3СОО- = СН3СООН
Если
не учитывать разбавления раствора,
концентрация уксусной кислоты станет
равной 0,15 моль/дм3,
а концентрация ацетат ионов – 0,05
моль/дм3.
Подставляем значения в выражение
константы диссоциации:
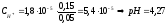
Таким образом, в результате добавления соляной кислоты изменение рН буферного раствора составило 0,47. При добавлении такого же количества кислоты к воде величина ее рН изменилась от 7 до 1,3.
Аналогичным образом добавление к буферу небольшого количества гидроксида натрия вызовет лишь незначительное изменение рН по сравнению с тем, что имело бы место для чистой воды.
Следует отметить, что если в буфер добавить сильную кислоту в количестве, превышающем имеющийся в растворе количество ацетат ионов, буферное действие раствора прекратится. Буферы способны противодействовать изменению рН до определенных пределов. Количественной оценкой эффективного действия буфера является буферная емкость.
Буферная емкость (В) – количество эквивалента сильной кислоты (щелочи), которое необходимо добавить к 1 дм3 буферного раствора, чтобы величина его рН изменилась на единицу.
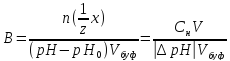 (80)
(80)
Буферная емкость зависит от соотношения компонентов смеси, от концентрации их в растворе. С увеличением концентрации увеличивается резерв, с помощью которого удерживается постоянство значения рН. Наибольшая величина буферной емкости достигается при равенстве концентраций обоих компонентов буфера.
Буферные растворы играют жизненно важную роль, поддерживая приблизительно постоянное значение рН во многих процессах, которые протекают в биологических и других системах.
ГИДРОЛИЗ.
Гидролиз лежит в основе многих процессов в химической промышленности. В больших масштабах осуществляется гидролиз древесины. Гидролизная промышленность вырабатывает из непищевого сырья (древесины, соломы, хлопковой шелухи, подсолнечной лузги, кукурузной кочерыжки) ряд ценных продуктов: этанол, белковые дрожжи, глюкозу, фурфурол, метанол, лигнин и др.
В живых организмах протекает гидролиз полисахаридов, белков и других органических соединений.
Гидролиз (греч. hydor – вода, lysis - разрушение) - реакции обменного разложения вещества водой с образованием слабого электролита и с изменением рН. Зависит от концентрации вещества и температуры.
В присутствии ионов сильного электролита гидролиз протекает обратимо. Различат три случая обратимого гидролиза:
катионный
анионный
катионно-анионный
Гидролиз – результат поляризационного взаимодействия иона с гидратной оболочкой. Результатом гидролиза является поляризация связи, сопровождающаяся ее разрывом. Чем больше поляризационное действие иона, тем полнее протекает гидролиз.
Гидролиз
определяется поляризующим действием
иона Рi,
зависящим
от его заряда и радиуса: Рi,=
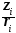 .
.
Механизм гидролиза по катиону.
Катионы d-, p- элементов.
Имеют вакантные внутренние орбитали, поэтому обладают высокой поляризационной способностью.
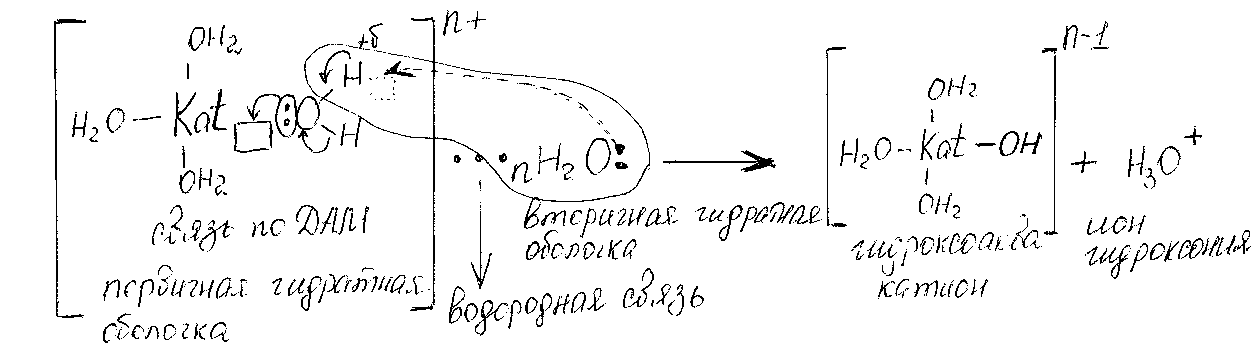
Чем меньше размеры катиона и больше его заряд, тем сильнее его акцепторная способность, т.е. прочнее связь ОН-Кat, тем сильнее поляризуется связь ОН в координационной молекуле воды, тем слабее удерживается ион водорода. Потенциально возникает свободная орбиталь, связь ОН поляризуется, ослабевает и разрывается, при этом водородная связь между вторичной гидратной оболочкой и ионом водорода превращается в ковалентную по донорно-акцепторному механизму.
рН<7 (кислая), накапливаются ионы Н+
Данный механизм справедлив для катионов: меди, железа, хрома алюминия и др. – катионы слабых оснований. Обладают сильно выраженным поляризующим действием.
Катионы s – элементов
Катионы щелочных и щелочноземельных металлов: лития, калия, натрия, кальция, стронция, бария - не имеют вакантных орбиталей, поэтому обладают слабым поляризующим действием. Связь ОН не поляризуется в координационных молекулах воды, гидролиз не протекает.
Механизм гидролиза по аниону.
1. Анионы, обладающие высоким поляризующим действием: сульфид, карбонат, ацетат, сульфит, фосфат, цианид, силикат – анионы слабых кислот. У них вакантной орбитали нет, работает избыточный отицательный заряд.
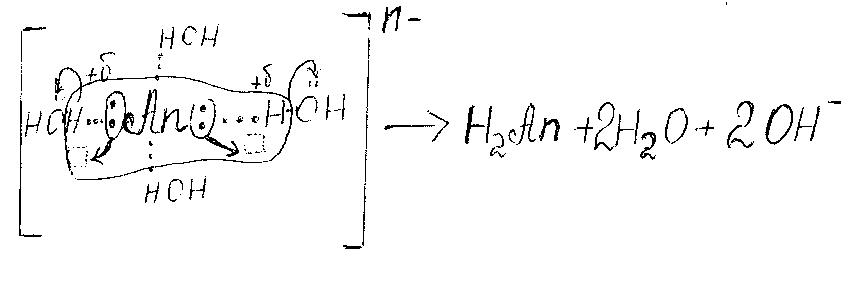
Анион, обладающий хорошо выраженной донорной способностью. Донор вызывает поляризацию гидратной оболочки. Результат поляризации – изменение рН > 7 (щелочная)
2. Анионы, не способные поляризовать гидртную оболочку (водородная связь не превращается в ковалентную, отрыва иона Н+ не наблюдается). Это слабые доноры электронной пары, поэтому взаимодействия между молекулами воды и анионом не будет. Это анионы сильных кислот: хлорид, бромид, сульфат, нитрат, перхлорат. рН вменятся не будет.
Количественной характеристикой гидролиза является степень гидролиза и константа гидролиза.
1. Гидролиз обратим, существует равновесие. Для любой равновесной системы справедлив ЗДМ, по которому можно определить Кр.
Произведение Кр и концентрации воды – есть Кгидролиза.
2. Степень гидролиза (h) – отношение количества соли, подвергшиеся гидролизу, к общему количеству растворенной соли. Она изменяется, не табличная величина.
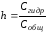 (81)
(81)
Связь между константой гидролиза и степенью гидролиза выражаются соотношением:
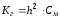 (82)
(82)
Из формулы видно, что степень гидролиза увеличивается при разбавлении раствора, она также увеличивается при повышении температуры.
Примеры гидролиза:
Кат и Ан не поляризуют гидратную оболочку (Соль сильной кислоты и сильной щелочи).
NaCl + HOH = NaOH + HCl
Na+ + Cl- + HOH = Na+ + OH- + H+ + Cl-
HOH = OH- + H+ (смещение равновесия ←)
Вывод: гидролиз не протекает, рН не меняется (рН=7).
Кат не поляризует гидратную оболочку, а Ан обладает поляризующим действием (Соль слабой кислоты и сильной щелочи).
CH3COONa + HOH = CH3COOH + NaOH
CH3COO- + HOH + Na+ = CH3COOH + OH- + Na+
CH3COO- + HOH = CH3COOH + OH-
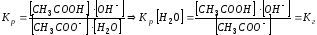
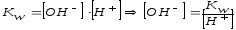
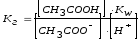
Тогда:
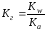 (83)
(83)
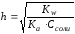 (84)
(84)
Гидролиз многозарядных ионов протекает ступенчато
CO32- + HOH ↔ HCO3- + OH- 1-я ступень
HCO3- + HOH ↔ CO2∙H2O + OH- 2-я ступень практически не протекает.
В выражение константы гидролиза подставляется константа ионизации той стадии, на которой получен гидролизующийся ион.
Чем меньше константа ионизации, тем больше константа гидролиза. Чем слабее образующееся кислота, тем полнее протекает гидролиз.
Вывод: протекает обратимый гидролиз (по аниону), рН меняется, рН>7 (щелочная).
Ан не поляризует гидратную оболочку, а Кат обладает поляризующим действием (Соль сильной кислоты и слабого основания).
AlСl3 + HOH ↔ AlOHCl2 + HCl 1-я ступень гидролиза
Al3+ + HOH + 3Cl- = AlOH2+ + 2Cl- + H+ + Cl-
Al3+ + HOH = AlOH2+ + H+
2-я и 3-я ступень практически не протекают вследствие обратимости процесса.
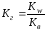 (85)
(85)
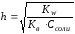 (86)
(86)
Вывод: протекает обратимый гидролиз (по катиону), рН меняется, рН<7 (кислая).
Ан и Кат поляризуют гидратную оболочку (обладают поляризующим действием) (Соль слабой кислоты и слабого основания).
Al2(CO3)3 + 6HOH → 2Al(OH)3↓ + 3H2CO3
2Al3+ + 3CO32- + 6HOH → 2Al(OH)3↓ + 3CO2↑ + 3HOH
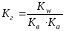 (87)
(87)
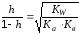 (88)
(88)
Вывод: гидролиз необратим, протекает ступенчато, полностью. рН ≈ 7.
При одновременном гидролизе катиона и аниона рН определяется более сильным электролитом – с большей Кд и меньшим рК:
CH3COONH4 + HOH → NH3·H2O + CH3COOH
Kb=1,8·10-5 Кa=1,86·10-5 => рН ≈ 7
(NH4)2S + HOH → NH3·H2O + H2S
Kb=1,8·10-5 Кa =5, 6·10-12 => рН > 7
Факторы, влияющие на смещение химического равновесия процесса гидролиза (согласно принципу Ле-Шателье):
Так как гидролиз процесс эндотермический (ΔΗ>0), то повышение температуры увеличивает процесс гидролиза (равновесие смещается вправо).
Разбавление раствора водой способствует протеканию процесса, связанного с его поглощением, т.е. усилению гидролиза.
Введение разноименных ионов также усиливает гидролиз.
К2СО3 + Н2О = 2КОН + Н2СО3
2К+ + СО32- + Н2О = 2К+ + 2ОН- + Н2СО3
СО32- + Н2О = 2ОН- + Н2СО3, введение Н+ связывает ОН- в воду и тем самым смещает равновесие вправо.
При добавлении кислоты к раствору соли кислой среды или добавлении щелочи к раствору соли щелочной среды гидролиз подавляется за счет увеличения концентрации одного из продуктов реакции (равновесие смещается влево – введение одноименных ионов)
К2СО3 + Н2О = 2КОН + Н2СО3
2К+ + СО32- + Н2О = 2К+ + 2ОН- + Н2СО3
СО32- + Н2О = 2ОН- + Н2СО3, введение ОН- смещает равновесие влево.
Рассматривая поведение кислых и основных солей в растворе, следует учитывать как процессы ионизации, так и процессы гидролиза. Например, NaH2PO4 и PbOHCl подвергаются: а) первичной ионизации ионизации, которая протекает практически полностью:
NaH2PO4 ↔ Na+ + H2PO4-
PbOHCl ↔ PbOH+ + Cl-
б) вторичной ионизации сложных ионов:
H2PO4- ↔ Н+ + НРО42-
PbOH+ ↔ Pb2+ + OH-
в) и гидролизу сложных ионов:
H2PO4- + НОН ↔ Н3РО4 + ОН-
PbOH+ + HOH ↔ Pb(OH)2 + H+
Процессы а) определяют исходную концентрацию сложных ионов в растворе; последняя будет, очевидно, равна концентрации соли, поскольку соли – сильные электролиты. Процессы б) и в) определяют равновесную концентрацию простых и сложных ионов в растворе, а также концентрацию Н+ и ОН-.
Чтобы определить, какую реакцию исеет раствор кислой соли, например, NaH2PO4, кислую или щелочную, следует определить, какой процесс протекает в большей степени: ионизация (б) или гидролиз (в). Для этого надо сравнить константу ионизации H2PO4- с константой гидролиза этого иона:
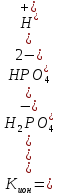
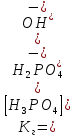
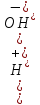 ,
где КW
– ионное
произведение воды.
,
где КW
– ионное
произведение воды.
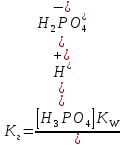 =
1,33·10-12
=
1,33·10-12
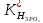 -
константа ионизации Н3РО4
по I ступени. Равна 7,3·10-3
(прилож. 7).
-
константа ионизации Н3РО4
по I ступени. Равна 7,3·10-3
(прилож. 7).
Кион > КГ, в растворе будет преодладать процесс ионизации, поэтому рН < 7 (среда кислая).
В расчетах необходимо придерживаться правилом: в константу гидролиза подставляется ионизации той стадии, на которой появился данный ион, подвергающийся гидролизу.
Н3РО4 ↔ Н2РО4- + Н+ (I стадия).
Контрольные вопросы и задания
Что называется ионным произведением воды? Чему оно равно?
Что такое рН раствора? Какой раствор называется нейтральным, щелочным, кислым?
Определите рН, если [H+] = 2·10-5 моль/дм3.
Определите [H+] в растворе, если рН = 5,4.
Что такое буферный раствор, буферная емкость? Значение буферных растворов в медицине и фармации.
Что называется гидролизом? Механизм гидролиза. Гидролиз аквакатионов. Гидролиз анионов. Совместный гидролиз (катиона и аниона).
Катионы и анионы как сопряженные кислота и основание.
Как можно провести гидролиз до конца и наоборот, замедлить процесс гидролиза? Какой принцип из ранее изученных тем следует здесь применить?
Степень и константа гидролиза (определение, расчет).
Значение гидролиза и применение его в медицине и фармации.
Примеры решения задач
Пример 1. Концентрация ионов водорода в растворе равна 4 · 10-3 моль/дм3. Определите рН раствора.
Решение. рН = -lg[H+] = -lg 4 · 10-3 = -(-3 + 0,6) = 2,4
Пример 2. Определите концентрацию ионов водорода в растворе, рН которого 4,6.
Решение. –lg[H+] = 4,6, следовательно, по таблице логарифмов находим: [H+] = 2,5 · 10-5 моль/дм3.
Пример 3. Определите концентрации НСО3- и СО32- в 0,01 М растворе угольной кислоты, если рН этого раствора равен 4,18.
Решение. Находим концентрацию ионов водорода в растворе: -lg[H+] = 4,18, по таблице логарифмов находим: [H+] = 6,61 · 10-5 моль/дм3.
Н2СО3
↔ Н+
+ НСО3-
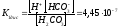 (табл.
величина).
(табл.
величина).
Находим [HCO3-] = 4,45 · 10-7 · 0,01 / 6,61 · 10-5 = 6,73 · 10-5 моль/дм3.
НСО3-
↔ Н+
+ СО32-
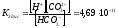 (табл. величина).
(табл. величина).
Находим [CO32-] = 4,69 · 10-11 · 6,73 · 10-5 / 6,61 · 10-5 = 4,48 · 10-11 моль/дм3.
Пример 4. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: а) KCN; б) Na2CO3; в) ZnSO4. определите реакцию среды растворов этих солей.
Решение. KCN – соль слабой синильной кислоты и сильного основания. Поэтому гидролиз протекает по аниону. В результате гидролиза в растворе появляется избыток гидроксид-ионов. Раствор KCN имеет щелочную реакцию (рН>7): KCN + НОН ↔ НCN + КОН
K+ + CN- + НОН ↔ НCN + К+ + ОН-
CN- + НОН ↔ НCN + ОН-
Na2CO3 – соль слабой угольной кислоты и сильного основания. Поэтому гидролиз протекает по аниону. В результате гидролиза в растворе появляется избыток гидроксид-ионов. Раствор Na2CO3 имеет щелочную реакцию (рН>7): Na2CO3 + НОН ↔ NaНCO3 + NaОН
2Na+ + CO32- + НОН ↔ Na+ + НCO3- + Na+ + ОН-
CO32- + НОН ↔ НCO3- + ОН-
ZnSO4 – соль сильной серной кислоты и слабо многокислотного основания Zn(ОН)2. Поэтому гидролиз протекает по катиону. В результате гидролиза в растворе появляется избыток ионов водорода. Раствор ZnSO4 имеет кислую реакцию (рН<7): 2ZnSO4 + 2НОН ↔ (ZnОН)2SO4 + Н2SO4
2Zn2+ + 2SO42- + НОН ↔ 2ZnОН+ + SO42- + 2Н+ + SO42-
2Zn2+ + НОН ↔ 2ZnОН+ + 4Н+
Пример 5. Какие продукты образуются при смешивании растворов Al(NO3)3 и К2СО3? Составьте ионно-молекулярное и молекулярное уравнения реакции.
Решение. Al(NO3)3 подвергается гидролизу по катиону. К2СО3 подвергается гидролизу по аниону. Если эти растворы находятся в одном сосуде, то идет взаимное усиление гидролиза, т.к. ионы Н+ и ОН- образуют молекулу слабого электролита – Н2О. Реакция гидролиза смещается вправо, идет необратимо в сторону образования продуктов гидролиза:
2 Al(NO3)3 + 3 К2СО3 + 3 НОН → 2 Al(ОН)3↓ + 3 СО2↑ + 6 КNO3
2 Al3+ + 6NO3- + 6К+ + 3СО32- + 3НОН → 2Al(ОН)3↓ + 3СО2↑ + 6К+ + 6NO3-
2 Al3+ + 3СО32- + 3НОН → 2Al(ОН)3↓ + 3СО2↑
Пример 6. Вычислите константу гидролиза, степень гидролиза и рН ацетата калия в 0,1 М растворе.
Решение. Гидролиз идет по аниону: СН3СОО- + НОН →СН3СООН + ОН- Ка(СН3СООН) = 1,8· 10-5 (табл. величина)
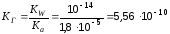 ;
;
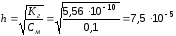
Для вычисления рН следует принять во внимание, что в результате гидролиза каждого ацетат иона образуется один гидроксид ион. Если исходная концентрация гидролизующихся анионов С моль/л, а гидролизу подвергалась доля этих анионов, то при этом образовалось С моль/л ионов ОН-, т.е.
[OH-] = h· C = 7,5 · 10-5 · 0,1 = 7,5 · 10-6 моль/л
рОН = - lg[OH] = - lg 7,5 · 10-6 = - (-6 + 0,88) = 5,12
Отсюда рН = 14 – рОН = 14 – 5,12 = 8,88.
Индивидуальные задания
Задание. Решите задачи своего варианта (табл. 52).
Таблица 52