
- •C.М. Дрюцкая
- •Введение
- •Тема 1. Введение. Классы и номенклатура неорганических соединений. Основные законы и понятия химии. Закон эквивалентов.
- •1.1. Теоретические сведения
- •Химические свойства оксидов
- •Получение кислот
- •Химические свойства кислот
- •Получение оснований
- •Химические свойства оснований
- •Получение солей
- •Химические свойства средних солей
- •Числовые приставки
- •Систематические и тривиальные названия некоторых веществ
- •Систематические и международные названия некоторых сложных веществ
- •Названия наиболее распространенных кислот и их анионов
- •1.2. Контрольные вопросы и задания
- •1.3. Примеры решения задач
- •1.4. Индивидуальные задания
- •Варианты контрольного задания
- •Варианты контрольного задания
- •1.5. Тестовые задания
- •Тема 2. Способы выражения концентрации (состава) раствора.
- •2.1. Теоретические сведения
- •2.2. Контрольные вопросы и задания
- •2.3. Примеры решения задач
- •2.4. Индивидуальные задания
- •Варианты контрольного задания
- •2.5. Тестовые задания
- •Тема 3. Химическая термодинамика.
- •3.1. Теоретические сведения
- •3.2. Контрольные вопросы и задания
- •3.3. Примеры решения задач
- •Стандартные термодинамические функции
- •3.4. Индивидуальные задания
- •Варианты контрольного задания
- •Варианты контрольного задания
- •3.5. Тестовые задания
- •Тема 4. Химическая кинетика. Термодинамика химического равновесия
- •4.1.Теоретические сведения
- •4.2. Контрольные вопросы и задания
- •4.3. Примеры решения задач
- •4.4. Индивидуальные задания
- •Варианты контрольного задания
- •4.5. Тестовые задания
- •Тема 5. Строение атома. Периодический закон и периодическая система элементов д.И. Менделеева. Химическая связь и строение соединений. Межмолекулярные взаимодействия.
- •5.1. Теоретические сведения
- •Основные характеристики протона, нейтрона и электрона
- •Корпускулярно-волновые свойства частиц
- •Число подуровней на энергетических уровнях
- •Число орбиталей на энергетических подуровнях
- •Последовательность заполнение атомных орбиталей
- •Электронные формулы элементов
- •Потенциалы (энергии) ионизации i1, эВ
- •Потенциалы (энергии) ионизации i1, эВ элементов V группы
- •Значение энергии (Eср) сродства к электрону для некоторых атомов.
- •Относительная электроотрицательность элементов
- •Свойства веществ в разных агрегатных состояниях
- •Сравнительная характеристика аморфных и кристаллических веществ
- •Свойства кристаллических решеток
- •5.2. Контрольные вопросы и задания
- •5.3. Примеры решения задач
- •План характеристики элемента по положению в Периодической системе д.И. Менделеева
- •5.4. Индивидуальные задания
- •Варианты контрольного задания
- •Исходные данные
- •5.5. Тестовые задания
- •Тема 6. Реакции с переносом электронов. Окислительно-восстановительные равновесия и процессы
- •6.1. Теоретические сведения
- •Характеристика элементов и их соединений в овр
- •Типы овр
- •Составление уравнений окислительно-восстановительных реакций
- •Участие ионов в различных средах
- •Стандартные электродные потенциалы металлов
- •6.2. Контрольные вопросы и задания
- •6.3. Примеры решения задач
- •6.4. Индивидуальные задания
- •Варианты контрольного задания
- •Исходные данные
- •6.5. Тестовые задания
- •Тема 7. Лигандообменные равновесия и процессы. Комплексные соединения
- •Координационные числа ионов - комплексообразователей
- •Основные комплексообразователи в кс
- •Среднее поле
- •Слабое поле
- •Геометрическая структура кс и тип гибридизации
- •Видимый спектр длин волн (нм) и окраска кс при их поглощении
- •Варианты контрольного задания
- •Тема 8. Осмотические свойства растворов. Протолитические равновесия и процессы. Электролитическая ионизация. Степень и константа ионизации
- •Теория электролитической ионизации (диссоциации).
- •Варианты контрольного задания
- •Тема 9. Гетерогенные равновесия и процессы. Произведение растворимости, условия образования и растворения осадков
- •Условия смещения гетерогенного равновесия:
- •Варианты контрольного задания
- •Тема 10. Ионное произведение воды. РН. Гидролиз солей
- •Изменение окраски некоторых индикаторов
- •Примеры буферных растворов.
- •Уравнения Гендерсона – Гассельбаха
- •Варианты контрольного задания
- •Объем учебной дисциплины «Общая и неорганическая химия» и виды учебной работы для студентов очного отделения фармацевтического факультета
- •Календарный план лабораторных занятий по общей и неорганической химии для студентов дневного отделения фармацевтического факультета
- •I семестр (продолжительность - 5 часов)
- •Календарный план лекций по общей и неорганической химии для студентов дневного отделения фармацевтического факультета
- •I семестр (продолжительность - 2 часа)
- •Название важнейших кислот и солей.
- •Значения некоторых фундаментальных физческих постоянных
- •Термодинамические свойства веществ.
- •Стандартные электродные потенциалы (е0) некоторых систем
- •Константы устойчивости комплексных ионов
- •Константы нестойкости некоторых комплексных ионов
- •Константы ионизации кислот и оснований (Ки)
- •Коэффициенты активности (f) ионов при ионных силах раствора
- •Растворимость кислот, оснований и солей в воде
- •Константы растворимости
- •Ответы тестовых заданий
- •Оглавление
Получение солей
|
1. С использованием металлов
|
Средние (нормальные) соли | |
|
металл+неметалл |
| |
|
металл
(стоящий до Н) + кислота (кроме
|
| |
|
металл (более активный, чем металл в соли) +соль |
| |
|
2. С использованием оксидов |
основной оксид+кислота |
|
|
кислотный оксид +основание |
| |
|
кислотный+основной оксиды |
| |
|
основной+амфотерный оксиды |
| |
|
3. Реакция нейтрализации |
кислота+основание |
|
|
4. Из солей |
соль+соль |
|
|
соль+щелочь |
| |
|
соль+кислота |
| |
|
| ||
|
| ||
|
Основные соли образуются при взаимодействии солей со щелочами (при избытке щелочи) | ||
|
| ||
Между классами неорганических соединений существует тесная генетическая связь.
Генетические ряды. Генетическая связь между классами неорганических веществ
Генетические связи - это связи между разными классами, основанные на их взаимопревращениях. Зная классы неорганических веществ, можно составить генетические ряды металлов и неметаллов. В основу этих рядов положен один и тот же элемент.
Таблица 7
Химические свойства средних солей
|
Разложение при прокаливании |
|
|
Cоль+металл |
|
|
Соль+соль |
|
|
Соль+щелочь |
|
|
Соль+кислота |
|
Среди металлов выделяют два разновидности рядов:
1. Генетический ряд, в котором в качестве основания выступает щёлочь. Этот ряд можно представить с помощью следующих превращений: металлосновный оксидщёлочьсоль.
Пример:
 .
.
2. Генетический ряд, где в качестве основания выступает нерастворимое основание, тогда ряд можно представить цепочкой превращений: металлосновный оксидсольнерастворимое основаниеосновный оксидметалл.
Пример:
Среди неметаллов также можно выделить две разновидности рядов:
1. Генетический ряд неметаллов, где в качестве звена ряда выступает растворимая кислота. Цепочку превращений можно представить в следующем виде: неметаллкислотный оксидрастворимая кислотасоль.
Пример:
 .
.
2. Генетический ряд неметаллов, где в качестве звена ряда выступает нерастворимая кислота: неметалл→кислотный оксид →соль →кислота → кислотный оксид→неметалл.
Пример:

Взаимосвязь между солями
Из средних солей можно получить кислые и основные соли, но возможен и обратный процесс.

Пример:







НОМЕНКЛАТУРА НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Химическая номенклатура – свод правил, позволяющих однозначно составить ту, или иную формулу или название любого химического вещества, зная его состав и строение.
Для составления названия неорганических соединений применяют тривиальную и рациональную номенклатуры (рис. 2).

Рис. 2. Номенклатура неорганических соединений
Тривиальные названия, исторически закрепившиеся, за какими либо соединениями, и не соответствующие никакой номенклатуре. Они не вытекают из каких-либо единых систематических принципов, не выражают строения соединения и чрезвычайно разнообразны.
К
тривиальным относятся все названия
минералов (природных веществ, составляющих
горные породы), например: кварц ( );
каменная соль, или галит (
);
каменная соль, или галит ( );
цинковая обманка, или сфалерит (
);
цинковая обманка, или сфалерит ( );
магнитный железняк или магнетит (
);
магнитный железняк или магнетит ( );
пиролюзит (
);
пиролюзит ( );
плавиковый шпат или флюорит (
);
плавиковый шпат или флюорит ( ).
Некоторых солей: желтая кровяная соль
(гексацианоферрат (II)
калия
).
Некоторых солей: желтая кровяная соль
(гексацианоферрат (II)
калия
 ),
краснаякровяная
соль
(гексацианоферрат (III)
калия
),
краснаякровяная
соль
(гексацианоферрат (III)
калия
 ),
медный купорос (сульфат меди
),
медный купорос (сульфат меди )
игидроксидов:
соляная кислота (хлороводородная
)
игидроксидов:
соляная кислота (хлороводородная
 )
и т.д. (см. табл. 10).
)
и т.д. (см. табл. 10).
В
основу русской
номенклатуры
положено использование русских названий
химических элементов. При этом используют
корни слов или усеченные корни слов.
Например:
 –
хлористый натрий.
–
хлористый натрий.
Согласно
устаревшей отечественной номенклатуре,
если элемент образует только один оксид,
то последний назывался окисью.
Так,
 назывался окисью кальция.
назывался окисью кальция.
Если существует два или несколько оксидов данного элемента, то их названия образовывались в соответствии с числом атомов кислорода, приходящихся на один атом элемента, например: Э2О - полуокись, ЭО - одноокись, Э2О3 - полутораокись, ЭО2 - двуокись, Э2О5 - полупятиокись, ЭО3 - трехокись (символом Э здесь обозначен атом соответствующего элемента).
Примеры:
 - одноокись железа,
- одноокись железа,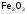 - полутораокись железа,
- полутораокись железа, - полуокись меди,
- полуокись меди, - одноокись меди. Иногда оксиды, в которых
элемент проявляет низшую валентность,
назывались закисями (
- одноокись меди. Иногда оксиды, в которых
элемент проявляет низшую валентность,
назывались закисями ( -
закись меди,
-
закись меди, - закись азота), а кислотные оксиды -
ангидридами соответствующих кислот (
- закись азота), а кислотные оксиды -
ангидридами соответствующих кислот ( - азотный ангидрид,
- азотный ангидрид, - марганцовый ангидрид).
- марганцовый ангидрид).
По русской номенклатуре для обозначения солей применяют суффиксы –ист- для указания либо единственной, либо низшей степени окисления и –н- (иногда –ов-, -ев-) для высшей степени окисления. Для обозначения степени окисления также пользуются русскими числительными и римскими цифрами.
Примеры:
 — бромистый
калий;
— бромистый
калий;
 — хлористое
железо, двухлористое
железо, хлористое железо (II); FeCl3
— хлорное
железо, трёххлористое железо, хлористое
железо (III).
— хлористое
железо, двухлористое
железо, хлористое железо (II); FeCl3
— хлорное
железо, трёххлористое железо, хлористое
железо (III).
В устаревшей русской номенклатуре названия оснований обычно образовывались, прибавлением к названию соответствующего оксида приставку гидро- или слово гидрат.
Так,
 -гидроокись
кальция,
-гидроокись
кальция,
 -гидрат
закиси железа,
-гидрат
закиси железа,
 -гидроокись
или гидрат окиси железа
-гидроокись
или гидрат окиси железа
В настоящее время используются названия соединений по русской номенклатуре. Номенклатура других соединений считается устаревшей и не употребляется.
По
международной
(полусистематической) номенклатуре
неорганических соединений, в отличие
от русской номенклатуры, название
бинарных соединений составляется из
корня латинского названия элемента и
суффикса -ид
(от греческого суффикса -idēs, означавшего
отчество в собственных именах). На второе
место ставится название электроположительного
элемента в родительном падеже (например,
 — хлорид натрия). Степень окисления
электроположительного элемента указывают
либо римской цифрой в скобках (что
предпочтительнее), либо приставками,
заимствованными из греческих количественных
числительных (табл.8,9):
— хлорид натрия). Степень окисления
электроположительного элемента указывают
либо римской цифрой в скобках (что
предпочтительнее), либо приставками,
заимствованными из греческих количественных
числительных (табл.8,9):
Таблица 8


 )
)





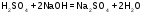



 Кислые
соли
получают такими же способами, что и
средние, но при других мольных
соотношениях (при избытке кислоты)
Кислые
соли
получают такими же способами, что и
средние, но при других мольных
соотношениях (при избытке кислоты)





