
- •C.М. Дрюцкая
- •Введение
- •Тема 1. Введение. Классы и номенклатура неорганических соединений. Основные законы и понятия химии. Закон эквивалентов.
- •1.1. Теоретические сведения
- •Химические свойства оксидов
- •Получение кислот
- •Химические свойства кислот
- •Получение оснований
- •Химические свойства оснований
- •Получение солей
- •Химические свойства средних солей
- •Числовые приставки
- •Систематические и тривиальные названия некоторых веществ
- •Систематические и международные названия некоторых сложных веществ
- •Названия наиболее распространенных кислот и их анионов
- •1.2. Контрольные вопросы и задания
- •1.3. Примеры решения задач
- •1.4. Индивидуальные задания
- •Варианты контрольного задания
- •Варианты контрольного задания
- •1.5. Тестовые задания
- •Тема 2. Способы выражения концентрации (состава) раствора.
- •2.1. Теоретические сведения
- •2.2. Контрольные вопросы и задания
- •2.3. Примеры решения задач
- •2.4. Индивидуальные задания
- •Варианты контрольного задания
- •2.5. Тестовые задания
- •Тема 3. Химическая термодинамика.
- •3.1. Теоретические сведения
- •3.2. Контрольные вопросы и задания
- •3.3. Примеры решения задач
- •Стандартные термодинамические функции
- •3.4. Индивидуальные задания
- •Варианты контрольного задания
- •Варианты контрольного задания
- •3.5. Тестовые задания
- •Тема 4. Химическая кинетика. Термодинамика химического равновесия
- •4.1.Теоретические сведения
- •4.2. Контрольные вопросы и задания
- •4.3. Примеры решения задач
- •4.4. Индивидуальные задания
- •Варианты контрольного задания
- •4.5. Тестовые задания
- •Тема 5. Строение атома. Периодический закон и периодическая система элементов д.И. Менделеева. Химическая связь и строение соединений. Межмолекулярные взаимодействия.
- •5.1. Теоретические сведения
- •Основные характеристики протона, нейтрона и электрона
- •Корпускулярно-волновые свойства частиц
- •Число подуровней на энергетических уровнях
- •Число орбиталей на энергетических подуровнях
- •Последовательность заполнение атомных орбиталей
- •Электронные формулы элементов
- •Потенциалы (энергии) ионизации i1, эВ
- •Потенциалы (энергии) ионизации i1, эВ элементов V группы
- •Значение энергии (Eср) сродства к электрону для некоторых атомов.
- •Относительная электроотрицательность элементов
- •Свойства веществ в разных агрегатных состояниях
- •Сравнительная характеристика аморфных и кристаллических веществ
- •Свойства кристаллических решеток
- •5.2. Контрольные вопросы и задания
- •5.3. Примеры решения задач
- •План характеристики элемента по положению в Периодической системе д.И. Менделеева
- •5.4. Индивидуальные задания
- •Варианты контрольного задания
- •Исходные данные
- •5.5. Тестовые задания
- •Тема 6. Реакции с переносом электронов. Окислительно-восстановительные равновесия и процессы
- •6.1. Теоретические сведения
- •Характеристика элементов и их соединений в овр
- •Типы овр
- •Составление уравнений окислительно-восстановительных реакций
- •Участие ионов в различных средах
- •Стандартные электродные потенциалы металлов
- •6.2. Контрольные вопросы и задания
- •6.3. Примеры решения задач
- •6.4. Индивидуальные задания
- •Варианты контрольного задания
- •Исходные данные
- •6.5. Тестовые задания
- •Тема 7. Лигандообменные равновесия и процессы. Комплексные соединения
- •Координационные числа ионов - комплексообразователей
- •Основные комплексообразователи в кс
- •Среднее поле
- •Слабое поле
- •Геометрическая структура кс и тип гибридизации
- •Видимый спектр длин волн (нм) и окраска кс при их поглощении
- •Варианты контрольного задания
- •Тема 8. Осмотические свойства растворов. Протолитические равновесия и процессы. Электролитическая ионизация. Степень и константа ионизации
- •Теория электролитической ионизации (диссоциации).
- •Варианты контрольного задания
- •Тема 9. Гетерогенные равновесия и процессы. Произведение растворимости, условия образования и растворения осадков
- •Условия смещения гетерогенного равновесия:
- •Варианты контрольного задания
- •Тема 10. Ионное произведение воды. РН. Гидролиз солей
- •Изменение окраски некоторых индикаторов
- •Примеры буферных растворов.
- •Уравнения Гендерсона – Гассельбаха
- •Варианты контрольного задания
- •Объем учебной дисциплины «Общая и неорганическая химия» и виды учебной работы для студентов очного отделения фармацевтического факультета
- •Календарный план лабораторных занятий по общей и неорганической химии для студентов дневного отделения фармацевтического факультета
- •I семестр (продолжительность - 5 часов)
- •Календарный план лекций по общей и неорганической химии для студентов дневного отделения фармацевтического факультета
- •I семестр (продолжительность - 2 часа)
- •Название важнейших кислот и солей.
- •Значения некоторых фундаментальных физческих постоянных
- •Термодинамические свойства веществ.
- •Стандартные электродные потенциалы (е0) некоторых систем
- •Константы устойчивости комплексных ионов
- •Константы нестойкости некоторых комплексных ионов
- •Константы ионизации кислот и оснований (Ки)
- •Коэффициенты активности (f) ионов при ионных силах раствора
- •Растворимость кислот, оснований и солей в воде
- •Константы растворимости
- •Ответы тестовых заданий
- •Оглавление
3.2. Контрольные вопросы и задания
1. Что называется системой? Какими параметрами характеризуется система?
2. Охарактеризуйте внутреннюю энергию системы, понятие об изохорных и изобарных процессах.
3. Что называется энтальпией?
4. Охарактеризуйте энтальпию образования соединений, стандартные энтальпии сгорания и образования веществ.
5. Закон Гесса и его следствия, его применение в термохимических расчетах.
6. Определение теплот (энтальпий) нейтрализации, растворения, гидратации.
7. Энтропия. Уравнение Больцмана. Как изменяется энтропия с изменением температуры?
8. Энергия Гиббса. Критерии самопроизвольного протекания процесса.
9.
Пользуясь справочными данными приложения
3, вычислите изменение стандартной
энтальпии реакции ( ):
):
10.
Пользуясь справочными данными приложения
3, вычислите изменение стандартной
энтропии реакции ( ):
):
11.
Вычислить
 реакции при 8460
С, если
реакции при 8460
С, если
 =
230 кДж,
=
230 кДж, =
593 Дж/К.
=
593 Дж/К.
3.3. Примеры решения задач
Пример 1. Реакция горения этилового спирта выражается термохимическим уравнением С2Н5ОН(Ж) + 3О2(Г) = 2СО2(Г) + 3Н2О(Ж). Вычислите тепловой эффект реакции, если известно, что молярная теплота парообразования С2Н5ОН(Ж) равна +42,36 кДж, а теплоты образования С2Н5ОН(Г) = -235,31 кДж, СО2(Г) = -393,51 кДж, Н2О(Ж) = -285,84 кДж.
Решение. Для определения ΔΗ реакции необходимо знать теплоту образования С2Н5ОН(Ж). Последнюю находим из данных:
С2Н5ОН(Ж) = С2Н5ОН(Г); ΔΗ = +42,36 кДж
+42,36 = -235,31 – ΔΗ(С2Н5ОН(Ж))
ΔΗ(С2Н5ОН(Ж)) = -235,31-42,36 = -277,67 кДж
Вычисляем ΔΗ реакции, применяя следствия из закона Гесса:
ΔΗХ.Р. = 2(-393,51) + 3(-285,84) + 277,67 = -1366,87 кДж.
Тепловой эффект реакции 1366,87 кДж.
Пример 2. Рассчитать ΔΗХР восстановления оксида железа (III) различными восстановителями при стандартных условиях:
а) Fe2O3(К) + 3H2(Г) = 2Fe(К) + 3H2O(Г)
б) Fe2O3(К) + 3СО(Г) = 2Fe(К) + 3СО2(Г)
В каком случае на этот процесс потребуется больше затратить энергии?
Решение. Для расчета ΔΗХР воспользуемся формулой следствия из закона Гесса и стандартными энтальпиями образования каждого вещества [Приложение 3]:
а) ΔΗХР = 2ΔΗ(Fe) + 3ΔΗ(H2O) – (ΔΗ(Fe2O3) + 3ΔΗ(H2)) = 2(0) + 3(-241,8) – ((-822,2) + 3(0)) = -725,4 + 822,2 = 96,8 кДж.
б) ΔΗХР = 2ΔΗ(Fe) + 3ΔΗ(СO2) – (ΔΗ(Fe2O3) + 3ΔΗ(СО)) = 2(0) + 3(-393,5) – ((-822,2) + 3(-110,5)) = -1180,5 + 822,2 + 331,5 = -26,5 кДж.
Согласно расчетам, процесс а) – восстановление оксида железа (III) водородом, требует больше затрат энергии, чем процесс б). В процессе б) реакция даже носит экзотермический характер (выделяется энергия в виде тепла).
Пример 3. Водяной газ представляет собой смесь равных объемов водорода и оксида углерода (II). Найдите количество теплоты, выделяющейся при сжигании 112 л водяного газа, (н.у.).
Решение. Составим термохимическое уравнение процесса:
Н2(Г) + СО(Г) + О2(Г) = Н2О(Г) + СО2(Г) ΔΗХР = - Q.
Рассчитаем ΔΗХР, когда сгорает 2 моля водяного газа (1 моль Н2 и й моль СО), т.е. 22,4 л/моль · 2 моль = 44,8 л. Расчет ведем по формуле следствия закона Гесса и стандартными энтальпиями образования каждого вещества [Доп. 3]:
ΔΗХР = ΔΗ(Н2О) + ΔΗ(СО2) – (ΔΗ(Н2) + ΔΗ(СО) + ΔΗ(О2)) = -241,8 – 393,5 – (0 – 110,5 + 0) = - 635,3 + 110,5 = - 524,8 кДж
Составляем пропорцию:
Сгорает 44,8 л водяного газа – выделяется 524,8 кДж тепла
112 л - Х кДж
Х = 112 · 524,8 / 44,8 = 1312 кДж
При сжигании 112 л водяного газа выделяется 1312 кДж тепла.
Пример 4. Дайте термодинамическую характеристику процесса Ga + HCl) ↔ GaCl3(т) + Н2(г) по плану:
Запишите стехиометрическое уравнение.
Выпишите термодинамические функции участвующих веществ.
Рассчитайте изменение стандартной энтальпии химической реакции и постройте энтальпийную диаграмму.
Определите, является реакция экзо- или эндотермической; увеличивается или уменьшается температура в системе в результате протекания данной реакции.
Рассчитайте изменение стандартной энтропии реакции, объясните изменение энтропии в ходе реакции.
Рассчитайте стандартное изменение энергии Гиббса по балансовому уравнению и уравнению Гиббса. Дайте анализ полученным данным.
Сопоставьте знаки величин
 .
и
.
и
 Сделайте вывод об обратимости реакции.
Сделайте вывод об обратимости реакции.Для обратимой реакции рассчитайте равновесную температуру согласно уравнению Гиббса допуская, что предельно допустимой температурой является 3000 К. Сделайте вывод: Тр – реализуема или не реализуема.
Рассчитайте величину
 при трех значениях температур (500, 1000 и
1500 К). Постройте графическую зависимость
при трех значениях температур (500, 1000 и
1500 К). Постройте графическую зависимость ..
..Сделайте вывод о самопроизвольности протекания химической реакции. Определите условия, при которых реакция возможна
Решение.
1 Записываем стехиометрическое уравнение.
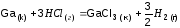
2. Выписываем стандартные термодинамические функции образования компонентов реакции (табл. 21) (термодинамические параметры веществ из [Приложение 3]).
Таблица 21
