
- •C.М. Дрюцкая
- •Введение
- •Тема 1. Введение. Классы и номенклатура неорганических соединений. Основные законы и понятия химии. Закон эквивалентов.
- •1.1. Теоретические сведения
- •Химические свойства оксидов
- •Получение кислот
- •Химические свойства кислот
- •Получение оснований
- •Химические свойства оснований
- •Получение солей
- •Химические свойства средних солей
- •Числовые приставки
- •Систематические и тривиальные названия некоторых веществ
- •Систематические и международные названия некоторых сложных веществ
- •Названия наиболее распространенных кислот и их анионов
- •1.2. Контрольные вопросы и задания
- •1.3. Примеры решения задач
- •1.4. Индивидуальные задания
- •Варианты контрольного задания
- •Варианты контрольного задания
- •1.5. Тестовые задания
- •Тема 2. Способы выражения концентрации (состава) раствора.
- •2.1. Теоретические сведения
- •2.2. Контрольные вопросы и задания
- •2.3. Примеры решения задач
- •2.4. Индивидуальные задания
- •Варианты контрольного задания
- •2.5. Тестовые задания
- •Тема 3. Химическая термодинамика.
- •3.1. Теоретические сведения
- •3.2. Контрольные вопросы и задания
- •3.3. Примеры решения задач
- •Стандартные термодинамические функции
- •3.4. Индивидуальные задания
- •Варианты контрольного задания
- •Варианты контрольного задания
- •3.5. Тестовые задания
- •Тема 4. Химическая кинетика. Термодинамика химического равновесия
- •4.1.Теоретические сведения
- •4.2. Контрольные вопросы и задания
- •4.3. Примеры решения задач
- •4.4. Индивидуальные задания
- •Варианты контрольного задания
- •4.5. Тестовые задания
- •Тема 5. Строение атома. Периодический закон и периодическая система элементов д.И. Менделеева. Химическая связь и строение соединений. Межмолекулярные взаимодействия.
- •5.1. Теоретические сведения
- •Основные характеристики протона, нейтрона и электрона
- •Корпускулярно-волновые свойства частиц
- •Число подуровней на энергетических уровнях
- •Число орбиталей на энергетических подуровнях
- •Последовательность заполнение атомных орбиталей
- •Электронные формулы элементов
- •Потенциалы (энергии) ионизации i1, эВ
- •Потенциалы (энергии) ионизации i1, эВ элементов V группы
- •Значение энергии (Eср) сродства к электрону для некоторых атомов.
- •Относительная электроотрицательность элементов
- •Свойства веществ в разных агрегатных состояниях
- •Сравнительная характеристика аморфных и кристаллических веществ
- •Свойства кристаллических решеток
- •5.2. Контрольные вопросы и задания
- •5.3. Примеры решения задач
- •План характеристики элемента по положению в Периодической системе д.И. Менделеева
- •5.4. Индивидуальные задания
- •Варианты контрольного задания
- •Исходные данные
- •5.5. Тестовые задания
- •Тема 6. Реакции с переносом электронов. Окислительно-восстановительные равновесия и процессы
- •6.1. Теоретические сведения
- •Характеристика элементов и их соединений в овр
- •Типы овр
- •Составление уравнений окислительно-восстановительных реакций
- •Участие ионов в различных средах
- •Стандартные электродные потенциалы металлов
- •6.2. Контрольные вопросы и задания
- •6.3. Примеры решения задач
- •6.4. Индивидуальные задания
- •Варианты контрольного задания
- •Исходные данные
- •6.5. Тестовые задания
- •Тема 7. Лигандообменные равновесия и процессы. Комплексные соединения
- •Координационные числа ионов - комплексообразователей
- •Основные комплексообразователи в кс
- •Среднее поле
- •Слабое поле
- •Геометрическая структура кс и тип гибридизации
- •Видимый спектр длин волн (нм) и окраска кс при их поглощении
- •Варианты контрольного задания
- •Тема 8. Осмотические свойства растворов. Протолитические равновесия и процессы. Электролитическая ионизация. Степень и константа ионизации
- •Теория электролитической ионизации (диссоциации).
- •Варианты контрольного задания
- •Тема 9. Гетерогенные равновесия и процессы. Произведение растворимости, условия образования и растворения осадков
- •Условия смещения гетерогенного равновесия:
- •Варианты контрольного задания
- •Тема 10. Ионное произведение воды. РН. Гидролиз солей
- •Изменение окраски некоторых индикаторов
- •Примеры буферных растворов.
- •Уравнения Гендерсона – Гассельбаха
- •Варианты контрольного задания
- •Объем учебной дисциплины «Общая и неорганическая химия» и виды учебной работы для студентов очного отделения фармацевтического факультета
- •Календарный план лабораторных занятий по общей и неорганической химии для студентов дневного отделения фармацевтического факультета
- •I семестр (продолжительность - 5 часов)
- •Календарный план лекций по общей и неорганической химии для студентов дневного отделения фармацевтического факультета
- •I семестр (продолжительность - 2 часа)
- •Название важнейших кислот и солей.
- •Значения некоторых фундаментальных физческих постоянных
- •Термодинамические свойства веществ.
- •Стандартные электродные потенциалы (е0) некоторых систем
- •Константы устойчивости комплексных ионов
- •Константы нестойкости некоторых комплексных ионов
- •Константы ионизации кислот и оснований (Ки)
- •Коэффициенты активности (f) ионов при ионных силах раствора
- •Растворимость кислот, оснований и солей в воде
- •Константы растворимости
- •Ответы тестовых заданий
- •Оглавление
1.2. Контрольные вопросы и задания
1. Что называется химическим эквивалентом?
2. Сформулируйте закон эквивалентов.
3. Как вычисляют эквиваленты элементов, оксидов, оснований, кислот, солей? Приведите примеры.
4. Определите эквивалент серы в соединениях: H2S, SO2, H2SO3, H2SO4.
5. Что такое моль эквивалентов и молярная масса эквивалентов?
6. Вычислите молярные массы эквивалента следующих веществ в реакциях обмена: KOH, H2S, H2SO4, Ca(OH)2, NH4OH, CuSO4. Составьте уравнения реакций.
7. Определите эквивалент двухвалентного металла, если 0,0977 г этого металла вытесняет 28 мл водорода при н.у.
8. При взаимодействии 0,5 г кальция с водородом образовалось 0,525 г гидрида кальция. Вычислите молярную массу эквивалента кальция и его эквивалент.
9. Вычислите молярную массу эквивалента металла, зная, что его хлорид содержит 79,78% хлора. Молярная масса эквивалента хлора равна 35,5 г/моль.
10. 0,304 г. Магния вытеснили 0,28 л водорода из соляной кислоты. Вычислите эквивалент магния и молярную массу его эквивалента.
1.3. Примеры решения задач
Пример
1. Распределите
соединения по классам и определите
характер, назовите их:
 ,
,
 ,
, ,
,
Решение. Представим результаты в виде таблицы (13).
Таблица 13
|
Соединение |
Класс |
Химический характер |
Название |
|
|
оксид |
основной |
оксид кальция |
|
|
гидроксид |
кислотный |
азотистая кислота |
|
|
соль |
средняя (нормальная) |
хлорат калия |
|
|
гидроксид |
амфотерный |
гидроксид бериллия |
Пример
2. Докажите
химический характер
 и
и с
помощью реакций.
с
помощью реакций.
Решение.
 –
оксид кальция, основной оксид. Реагирует
с кислотой и кислотными оксидами:
–
оксид кальция, основной оксид. Реагирует
с кислотой и кислотными оксидами:

 –гидроксид
бериллия. Обладает как основными, так
и кислотными свойствами:
–гидроксид
бериллия. Обладает как основными, так
и кислотными свойствами:

Пример 3. Осуществите превращение: напишите уравнения реакций, укажите условия протекания процесса, дайте названия соединениям:

Решение.





Пример
4. Рассчитайте
молярную массу эквивалентов серы в
соединениях
 .
.
Решение Расчет ведем по формуле (8):
а) SO2 – оксид серы, валентность серы в данном соединении равна 4
МЭ(S) = 32/ 4 = 8 г/моль
б) H2SO4 –серная кислота, валентность серы в данном соединении равна 6
МЭ(S) = 32/ 6 = 5,33 г/моль
в) H2S – сероводород, валентность серы в данном соединении равна 2
МЭ(S) = 32/ 2 = 16 г/моль
Пример
5. Рассчитайте
молярные массы эквивалентов (Мэ)
следующих веществ

Решение.
 -
гидроксид
кальция, основание. Расчет ведем по
формуле (10):
-
гидроксид
кальция, основание. Расчет ведем по
формуле (10):
 =
40 + 2·(16 + 2) = 76 г/моль
=
40 + 2·(16 + 2) = 76 г/моль
Так
как в молекуле
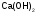 ,
имеются две гидроксидные группы (ОН),
то в случае замещения в реакции одной
из нихn
= 1
,
имеются две гидроксидные группы (ОН),
то в случае замещения в реакции одной
из нихn
= 1
 =
76/1= 76 г/моль, а двух,n
= 2
=
76/1= 76 г/моль, а двух,n
= 2
 )
= 76/ 2 = 38
г/моль
)
= 76/ 2 = 38
г/моль
 –серная
кислота. Расчет ведем по формуле (9):
–серная
кислота. Расчет ведем по формуле (9):
 =
2 + 32 + 16·4 = 98 г/моль,
=
2 + 32 + 16·4 = 98 г/моль,
Так
как в кислоте два атома водорода, то в
случае замещения одного n
= 1,
 =98/1
=98 г/моль, а двухn
= 2,
=98/1
=98 г/моль, а двухn
= 2, 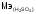 )
= 98/ 2 = 49 г/моль.
)
= 98/ 2 = 49 г/моль.
 –нитрат
магния, соль. Расчет ведем по формуле
(11):
–нитрат
магния, соль. Расчет ведем по формуле
(11):
 =
24 + 2·(14 + 16·3) = 148 г/моль; n
= 1 (количество
атомов металла), Z
= 2 (валентность
металла)
=
24 + 2·(14 + 16·3) = 148 г/моль; n
= 1 (количество
атомов металла), Z
= 2 (валентность
металла)
 =
148/ 2 = 74 г/моль
=
148/ 2 = 74 г/моль
 –оксид
алюминия. Расчет ведем по формуле (12):
–оксид
алюминия. Расчет ведем по формуле (12):
 =
27·2 + 16·3 = 102 г/моль; n
= 2 (количество
металла), Z
= 3 (валентность
металла)
=
27·2 + 16·3 = 102 г/моль; n
= 2 (количество
металла), Z
= 3 (валентность
металла)
 =
102 / 6 = 17 г/моль
=
102 / 6 = 17 г/моль
Пример 6. При сгорании металла образуется 9,43 г его оксида. Молярная масса эквивалента оксида металла равно 17 г/моль. Какая масса металла вступала в реакцию?
Решение.
Учитывая, что
 ,
можно найти молярную массу эквивалентов
металла:
,
можно найти молярную массу эквивалентов
металла: г/моль, по закону эквивалентов формула
(4) найдем количество металла, вступившего
в реакцию:m
(металла)=
9,439/
17=4,99 г
г/моль, по закону эквивалентов формула
(4) найдем количество металла, вступившего
в реакцию:m
(металла)=
9,439/
17=4,99 г
Пример 7. На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 л водорода (н.у.). Вычислите молярную массу эквивалентов оксида и молярную массу эквивалентов металла.
Решение. Молярная масса водорода равная 2 г/моль при н.у. занимает объем 22,4 л, то объем молярной массы эквивалентов водорода (1 г/моль) будет равен 22,4 : 2 = 11,2 л
По
закону эквивалентов формула (5):

 =
7,09·11,2 / 2,24 = 35,45 г/моль
=
7,09·11,2 / 2,24 = 35,45 г/моль
Согласно
закону эквивалентов
 =
= -
- =35,45–8=27,45
г/моль.
=35,45–8=27,45
г/моль.
Пример 8. Сколько металла, эквивалентная масса которого 12,16 г/моль, взаимодействует с 310 мл кислорода (н.у.)?
Решение. Молярная масса кислорода равная 32 г/моль при н.у. занимает объем 22,4 дм3, то объем молярной массы эквивалентов кислорода (8 г/моль) будет равен 22,4 : 4 = 5,6 л = 5600 мл.
По
закону эквивалентов формула (7):
 ;
; =
=
Отсюда
 =
310·12,16 : 5600 = 0,673 г
=
310·12,16 : 5600 = 0,673 г
Пример 9. Из 3,85 г нитрата металла получено 1,6 г его гидроксида. Вычислите молярную массу эквивалентов металла.
Решение. Молярная масса эквивалента химического соединения равна сумме молярных масс эквивалентов составляющих его частей.
 ;
;
Молярная масса эквивалентов иона (катиона, аниона) равна отношению молярной массе иона к величине заряда иона.

 =
15 г/моль.
=
15 г/моль.
Пример 10. Определить при н.у. объем азота собранного над водой при 20 0С и Р = 100 кПа. Рводяного пара = 2,3 кПа, Объем азота равен 120 см3.
Решение. Разота
= Р – Рводяного
пара = 100 – 2,3
= 97,7 кПа. По формуле (4) объем азота равен:
 .
.




