
- •C.М. Дрюцкая
- •Введение
- •Тема 1. Введение. Классы и номенклатура неорганических соединений. Основные законы и понятия химии. Закон эквивалентов.
- •1.1. Теоретические сведения
- •Химические свойства оксидов
- •Получение кислот
- •Химические свойства кислот
- •Получение оснований
- •Химические свойства оснований
- •Получение солей
- •Химические свойства средних солей
- •Числовые приставки
- •Систематические и тривиальные названия некоторых веществ
- •Систематические и международные названия некоторых сложных веществ
- •Названия наиболее распространенных кислот и их анионов
- •1.2. Контрольные вопросы и задания
- •1.3. Примеры решения задач
- •1.4. Индивидуальные задания
- •Варианты контрольного задания
- •Варианты контрольного задания
- •1.5. Тестовые задания
- •Тема 2. Способы выражения концентрации (состава) раствора.
- •2.1. Теоретические сведения
- •2.2. Контрольные вопросы и задания
- •2.3. Примеры решения задач
- •2.4. Индивидуальные задания
- •Варианты контрольного задания
- •2.5. Тестовые задания
- •Тема 3. Химическая термодинамика.
- •3.1. Теоретические сведения
- •3.2. Контрольные вопросы и задания
- •3.3. Примеры решения задач
- •Стандартные термодинамические функции
- •3.4. Индивидуальные задания
- •Варианты контрольного задания
- •Варианты контрольного задания
- •3.5. Тестовые задания
- •Тема 4. Химическая кинетика. Термодинамика химического равновесия
- •4.1.Теоретические сведения
- •4.2. Контрольные вопросы и задания
- •4.3. Примеры решения задач
- •4.4. Индивидуальные задания
- •Варианты контрольного задания
- •4.5. Тестовые задания
- •Тема 5. Строение атома. Периодический закон и периодическая система элементов д.И. Менделеева. Химическая связь и строение соединений. Межмолекулярные взаимодействия.
- •5.1. Теоретические сведения
- •Основные характеристики протона, нейтрона и электрона
- •Корпускулярно-волновые свойства частиц
- •Число подуровней на энергетических уровнях
- •Число орбиталей на энергетических подуровнях
- •Последовательность заполнение атомных орбиталей
- •Электронные формулы элементов
- •Потенциалы (энергии) ионизации i1, эВ
- •Потенциалы (энергии) ионизации i1, эВ элементов V группы
- •Значение энергии (Eср) сродства к электрону для некоторых атомов.
- •Относительная электроотрицательность элементов
- •Свойства веществ в разных агрегатных состояниях
- •Сравнительная характеристика аморфных и кристаллических веществ
- •Свойства кристаллических решеток
- •5.2. Контрольные вопросы и задания
- •5.3. Примеры решения задач
- •План характеристики элемента по положению в Периодической системе д.И. Менделеева
- •5.4. Индивидуальные задания
- •Варианты контрольного задания
- •Исходные данные
- •5.5. Тестовые задания
- •Тема 6. Реакции с переносом электронов. Окислительно-восстановительные равновесия и процессы
- •6.1. Теоретические сведения
- •Характеристика элементов и их соединений в овр
- •Типы овр
- •Составление уравнений окислительно-восстановительных реакций
- •Участие ионов в различных средах
- •Стандартные электродные потенциалы металлов
- •6.2. Контрольные вопросы и задания
- •6.3. Примеры решения задач
- •6.4. Индивидуальные задания
- •Варианты контрольного задания
- •Исходные данные
- •6.5. Тестовые задания
- •Тема 7. Лигандообменные равновесия и процессы. Комплексные соединения
- •Координационные числа ионов - комплексообразователей
- •Основные комплексообразователи в кс
- •Среднее поле
- •Слабое поле
- •Геометрическая структура кс и тип гибридизации
- •Видимый спектр длин волн (нм) и окраска кс при их поглощении
- •Варианты контрольного задания
- •Тема 8. Осмотические свойства растворов. Протолитические равновесия и процессы. Электролитическая ионизация. Степень и константа ионизации
- •Теория электролитической ионизации (диссоциации).
- •Варианты контрольного задания
- •Тема 9. Гетерогенные равновесия и процессы. Произведение растворимости, условия образования и растворения осадков
- •Условия смещения гетерогенного равновесия:
- •Варианты контрольного задания
- •Тема 10. Ионное произведение воды. РН. Гидролиз солей
- •Изменение окраски некоторых индикаторов
- •Примеры буферных растворов.
- •Уравнения Гендерсона – Гассельбаха
- •Варианты контрольного задания
- •Объем учебной дисциплины «Общая и неорганическая химия» и виды учебной работы для студентов очного отделения фармацевтического факультета
- •Календарный план лабораторных занятий по общей и неорганической химии для студентов дневного отделения фармацевтического факультета
- •I семестр (продолжительность - 5 часов)
- •Календарный план лекций по общей и неорганической химии для студентов дневного отделения фармацевтического факультета
- •I семестр (продолжительность - 2 часа)
- •Название важнейших кислот и солей.
- •Значения некоторых фундаментальных физческих постоянных
- •Термодинамические свойства веществ.
- •Стандартные электродные потенциалы (е0) некоторых систем
- •Константы устойчивости комплексных ионов
- •Константы нестойкости некоторых комплексных ионов
- •Константы ионизации кислот и оснований (Ки)
- •Коэффициенты активности (f) ионов при ионных силах раствора
- •Растворимость кислот, оснований и солей в воде
- •Константы растворимости
- •Ответы тестовых заданий
- •Оглавление
Корпускулярно-волновые свойства частиц
Характеристика состояния электронов в атоме основана на положении квантовой механики о двойственной природе электрона, обладающего одновременно свойствами частицы и волны.
Впервые двойственная корпускулярно-волновая природа была установлена для света. Исследования ряда явлений (излучение раскаленных тел, фотоэффект, атомные спектры) привели к выводу, что энергия испускается и поглощается не непрерывно, а дискретно, отдельными порциями (квантами). Предположение о квантовании энергии впервые было высказано Максом Планком (1900 г.) и обосновано Альбертом Эйнштейном (1905 г.): энергия кванта (∆Е) зависит от частоты излучения (ν):
∆Е = hν, где h = 6,63·10-34 Дж·с – постоянная Планка.
Приравнивая энергию фотона hν к полному запасу его энергии mс2 и, учитывая, что ν=с/λ, получаем соотношение выражающее взаимосвязь волновых и корпускулярных свойств фотона:
 (54)
(54)
В 1924 году Луи де Бройль предположил, что двойственная корпускулярно-волновая природа присуща не только излучению, но и любой материальной частице: каждой частице, имеющей массу(m) и движущейся со скоростью (υ) соответствует волновой процесс с длиной волны λ:
λ = h / m υ (55)
Чем меньше масса частицы, тем больше длина волны. Поэтому обнаружить волновые свойства у макрочастиц трудно.
В 1927 г. Американские ученые Девиссон и Джермер, англичанин Томсон и советский ученый Тартаковский независимо друг от друга обнаружили дифракцию электронов, что явилось экспериментальным подтверждением волновых свойств электронов. Позднее была открыта дифракция (интерференция) α-частиц, нейтронов, протонов, атомов и даже молекул. В настоящее время дифракция электронов используется для исследования строения вещества.
В волновых свойствах элементарных частиц заложен один из принципов волновой механики: принцип неопределенности (В. Гейзенберг 1925 г.): для малых тел атомного масштаба невозможно одновременно точно определить положение частицы в пространстве и ее скорость (импульс). Сем точнее определены координаты частицы, тем менее определенной становится ее скорость, и наоборот. Соотношение неопределенностей имеет вид:
 (
(
 )
)
 (56)
(56)
где ∆х – неопределенность положения частицы, ∆Рх – неопределенность величины импульса или скорости в направлении х. Аналогичные соотношения записываются и для координат y и z. Величина ℏ, входящая в соотношение неопределенности, очень мала, поэтому для макрочастиц неопределенности в значениях координат и импульсов ничтожны.
Следовательно, нельзя рассчитать траекторию движения электрона в поле ядра, можно лишь оценить вероятность его нахождения в атоме с помощью волновой функции ψ, которая заменяет классическое понятие траектории. Волновая функция ψ характеризует амплитуду волны в зависимости от координат электрона, а ее квадрат ψ2 определяет пространственное распределение электрона в атоме. В наиболее простом варианте волновая функция зависит от трех пространственных координат и дает возможность определить вероятность нахождения электрона в атомном пространстве или его орбиталь. Таким образом, атомная орбиталь (АО) – область атомного пространства, в котором вероятность нахождения электрона наибольшая.
Волновые функции получаются при решении основополагающего соотношения волновой механики – уравнения Шредингера (1926 г):
 (57)
(57)
где
h-
постоянная Планка,
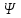 - переменная величина, U – потенциальная
энергия частицы, Е – полная энергия
частицы, x, y,z, - координаты.
- переменная величина, U – потенциальная
энергия частицы, Е – полная энергия
частицы, x, y,z, - координаты.
Таким образом, квантование энергии микросистемы вытекает непосредственно из решения волнового уравнения. Волновая функция полностью характеризует состояние электрона.
Волновая функция системы – это функция состояния системы, квадрат которой равен плотности вероятности нахождения электронов в каждой точке пространства. Она должна удовлетворять стандартным условиям: быть непрерывной, конечной, однозначной, обращаться в нуль там, где электрон отсутствует.
Точное решение получается для атома водорода или водородоподобных ионов, для многоэлектронных систем используются различные приближения. Поверхность, ограничивающая 90–95 % вероятности нахождения электрона или электронной плотности, называют граничной. Атомная орбиталь и плотность электронного облака имеют одинаковую граничную поверхность (форму) и одинаковую пространственную ориентацию. Атомные орбитали электрона, их энергия и направление в пространстве зависят от четырех параметров – квантовых чисел:главного, орбитального, магнитного и спинового. Первые три характеризуют движение электрона в пространстве, а четвертое – вокруг собственной оси.
Квантовое число n – главное. Оно определяет энергетический уровень электрона в атоме, удаленность уровня от ядра и размер электронного облака. Принимает целые значения от 1 до ∞ и соответствует номеру периода. Из периодической системы для любого элемента по номеру периода можно определить число энергетических уровней атома, и какой энергетический уровень является внешним. Чем больше n, тем больше энергия взаимодействия электрона с ядром. При n = 1 атом водорода находится в основном состоянии, при n> 1 – в возбужденном. Если n ∞, то электрон покинул атомный объем. Произошла ионизация атома.
|
Главное квантовое число |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Обозначение энергетического уровня |
K |
L |
M |
N |
O |
P |
Q |
Например, элемент кадмий Cd расположен в пятом периоде, значит n=5. В его атоме электроны распределены по пяти энергетическим уровням (n = 1, n = 2, n = 3, n = 4, n = 5); внешним будет пятый уровень (n = 5).
Так как электрон обладает наряду со свойствами волны и свойствами материальной частицы, то он, обладая массой m, скоростью движения V, и находясь на расстоянии от ядра r, обладает моментом количества движения: μ=mVr.
Момент количества движения – это вторая (после энергии) характеристика электрона и выражается через побочное (азимутальное, орбитальное) квантовое число.
Орбитальное квантовое число l - определяет форму электронного облака (рис. 7), энергию электрона на подуровне, количество энергетических подуровней. Принимает значения от 0 до n – 1. Кроме числовых значений l имеет буквенные обозначения. Электроны с одинаковым значением l образуют подуровень.
|
Орбитальное квантовое число l |
0 |
1 |
2 |
3 |
4 |
… |
|
Подуровень |
s |
p |
d |
f |
g |
… |
В каждом квантовом уровне число подуровней строго ограничено и равно номеру слоя. Подуровни, как и энергетические уровни, нумеруются в порядке их удаления от ядра (табл. 26).
Таблица 26
