
- •1. Вводная лекция
- •1.1. Общие сведения о редких металлах
- •1.2. Классификация редких металлов
- •1.3. Особенности технологии производства редких металлов из рудного сырья
- •1.4. История развития промышленности редких металлов в стране
- •2. Металлургия тугоплавких редких металлов
- •2.1. Металлургия вольфрама
- •2.1.1 Краткие исторические сведения
- •2.1.2. Основные свойства вольфрама и его соединений
- •2.1.3. Области применения
- •2.1.4. Минералы, руды, концентраты
- •2.1.5. Основные месторождения
- •2.1.6. Способы переработки вольфрамовых концентратов
- •2.1.7. Спекание вольфрамитовых концентратов с содой и селитрой
- •2.1.8. Спекание шеелитовых концентратов с содой и песком
- •2.1.9. Выщелачивание содовых спеков
- •2.1.10. Автоклавно-содовое вскрытие вольфрамитовых и шеелитовых концентратов
- •2.1.11. Разложение вольфрамитовых концентратов растворами едкого натра
- •2.1.12. Переработка растворов вольфрамата натрия
- •2.1.12.1. Очистка растворов от примесей
- •2.1.12.2. Осаждение вольфрамовой кислоты
- •2.1.13. Очистка технической вольфрамовой кислоты
- •2.1.14. Получение паравольфрамата аммония и триоксида вольфрама
- •2.1.15. Экстракционный способ переработки растворов вольфрамата натрия
- •2.1.16. Разложение шеелитового концентрата растворами кислот
- •2.1.17. Получение вольфрамового порошка
- •2.1.17.1. Восстановление вольфрамового ангидрида до металла водородом
- •2.1.17.2. Восстановление трёхокиси вольфрама углеродом.
- •2.1.18. Производство компактного металла методом порошковой металлургии
- •2.1.19. Плавка вольфрама
- •2.1.19.1. Дуговая плавка
- •2.1.19.2. Электронно-лучевая плавка
- •2.2. Металлургия молибдена
- •2.2.1. Краткая историческая справка
- •2.2.2. Свойства молибдена и его соединений
- •2.2.3. Области применения молибдена
- •2.2.4. Минералы, руды и рудные концентраты молибдена
- •2.2.5. Способы переработки молибденовых концентратов
- •2.2.6. Окислительный обжиг молибденитовых концентратов
- •2.2.6.1. Окисление молибденита
- •2.2.6.2. Окисление примесей других сульфидов
- •2.2.6.3. Образование молибдатов
- •2.2.7. Практика обжига
- •2.2.7.1. Обжиг в многоподовых печах.
- •2.2.7.2. Обжиг в печах кипящего слоя (кс)
- •2.2.8. Производство чистого триоксида молибдена
- •2.2.9. Способ возгонки
- •2.2.10. Гидрометаллургический способ переработки огарков
- •2.2.10.1. Аммиачное выщелачивание
- •2.2.10.2. Очистка растворов от примесей меди и железа.
- •2.2.10.3. Выделение молибдена из аммиачных растворов
- •2.2.10.4. Извлечение молибдена из хвостов аммиачного выщелачивания огарков
- •2.2.10.5. Термическое разложение парамолибдата аммония
- •2.2.11. Азотнокислый способ переработки молибденитового концентрата
- •2.2.12. Производство молибденовых порошков
- •2.2.13. Получение молибдена из его триоксида восстановлением водородом
- •2.2.14. Производство компактного молибдена методом порошковой металлургии
- •2.2.14.1. Прессование штабиков
- •2.2.14.2. Гидростатическое прессование
- •2.2.14.3. Спекание штабиков
- •2.2.14.4. Спекание крупных заготовок
- •2.2.15. Плавка молибдена
- •2.3. Металлургия тантала и ниобия
- •2.3.1. Краткая историческая справка
- •2.3.2. Физические и химические свойства тантала и ниобия
- •2.3.3. Свойства важнейших химических соединений тантала и ниобия
- •2.3.4. Области применения
- •2.3.5. Минералы, руды и месторождения руд
- •2.3.6. Металлургическая переработка танталито – колумбитовых концентратов
- •2.3.6.1. Сплавление со щелочами
- •2.3.6.2. Разложение плавиковой кислотой
- •2.3.7. Переработка лопаритовых концентратов
- •2.3.7.1. Способ хлорирования
- •2.3.7.2. Сернокислотный способ
- •2.3.8. Разделение тантала и ниобия и очистка их соединений от примесей
- •2.3.8.1. Дробная кристаллизация комплексных фторидов
- •2.3.8.2. Разделение тантала и ниобия экстракцией
- •2.3.8.3. Разделение тантала и ниобия ректификацией хлоридов
- •2.3.9. Получение металлических тантала и ниобия
- •2.3.9.1. Натриетермическое восстановление тантала и ниобия из фтортанталата калия и фторниобата калия
- •2.3.9.2. Карботермический способ получения ниобия и тантал.
- •2.3.9.3. Алюминотермический способ получения ниобия и тантала из их пятиокисей
- •2.3.9.4. Получение тантала и ниобия восстановлением из хлоридов водородом
- •2.3.9.5. Электролитический способ получения тантала
- •2.3.10. Получение компактных тантала и ниобия
- •2.3.11. Обработка тантала и ниобия давлением
- •2.4. Металлургия титана и ванадия
- •2.4.1. Общие сведения. Краткая историческая справка
- •2.4.2. Важнейшие свойства титана и его химических соединений
- •2.4.3. Области применения титана
- •2.4.4. Титановые минералы, руды и рудные концентраты
- •2.4.5. Производство химических соединений титана
- •2.4.6. Выплавка титанового шлака из ильменита
- •2.4.7. Производство четыреххлористого титана
- •2.4.7.1. Подготовка сырья
- •2.4.7.2. Хлорирование
- •2.4.7.3. Конденсация и разделение продуктов хлорирования
- •2.4.7.4. Очистка технического тетрахлорида титана
- •2.4.8. Производство диоксида титана
- •2.4.8.1. Сернокислотный способ
- •2.4.8.2. Способ «сжигания»
- •2.4.9. Способы производства титана
- •2.4.9.1. Восстановление тетрахлорида титана магнием.
- •2.4.9.2. Восстановление тетрахлорида титана натрием.
- •2.4.9.3. Восстановление диоксида титана кальцием или гидридом кальция
- •2.4.10. Рафинирование титана
- •2.4.10.1. Электролитическое рафинирование титана
- •2.4.10.2. Иодидный метод рафинирования титана
- •2.4.11. Производство компактного титана
- •2.4.11.1. Метод порошковой металлургии
- •2.4.11.2. Плавка титана.
- •2.4.12. История открытия ванадия
- •2.4.13. Физические и химические свойства ванадия
- •2.4.14. Соединения ванадия
- •2.4.15. Области применения ванадия и его соединений
- •2.4.16. Сырьевые источники ванадия
- •2.4.17. Обогащение ванадийсодержащих руд
- •2.4.18. Производство ванадия из железных руд
- •2.4.18.1. Получение ванадиевых шлаков
- •2.4.18.2. Переработка ванадиевого шлака
- •2.4.18.3. Выплавка феррованадия
- •2.4.18.4. Получение металлического ванадия
- •2.4.19. Извлечение ванадия из руд
- •2.4.20. Хлорирование феррованадия
- •2.5. Металлургия циркония и гафния
- •2.5.1. Общие сведения. Краткая историческая справка
- •2.5.2. Важнейшие свойства циркония и гафния и их химических соединений
- •2.5.3. Области применение циркония и гафния
- •2.5.4. Циркониевые минералы, руды и рудные концентраты Весовое содержание циркония в земной коре – 0,025 %. Известно около 20 минералов циркония.
- •2.5.5. Производство химических соединений циркония
- •2.5.5.1. Разложение циркона спеканием с содой
- •2.5.5.2. Разложение циркона спеканием с карбонатом кальция
- •2.5.5.3. Выделение циркония из солянокислых и сернокислых растворов
- •2.5.5.4. Производство фторцирконата калия
- •2.5.5.5. Производство четыреххлористого циркония
- •2.5.6. Разделение циркония и гафния
- •2.5.6.1. Фракционная кристаллизация комплексных фторидов
- •2.5.6.2. Жидкостная экстракция
- •2.5.7. Способы производства циркония и гафния
- •2.5.7.1. Производство губчатого циркония и гафния магниетермическим восстановлением хлорида циркония и гафния
- •2.5.7.2. Получение циркония из его фторцирконата калия восстановлением натрием
- •2.5.7.3. Получение циркония из его диоксида восстановлением кальцием или гидридом кальция
- •2.5.7.4. Получение циркония и гафния электролизом
- •2.5.8. Иодидный метод рафинирования циркония и гафния
- •3. Металлургия рассеянных редких металлов
- •3.1 Металлургия рения
- •3.1.1. Краткая историческая справка
- •3.1.2. Свойства рения
- •3.1.3. Свойства важнейших соединений рения
- •3.1.4. Области применения рения
- •3.1.5. Сырьевые источники рения
- •3.1.6. Распределение рения при переработке молибденитовых концентратов и в производстве меди
- •3.1.7. Извлечение рения из растворов
- •3.1.8. Получение рениевого порошка
- •3.1.9. Получение компактного рения
- •3.2. Металлургия индия
- •3.2.1. Общие сведения
- •3.2.2. Свойства индия
- •3.2.3. Химические соединения индия
- •3.2.4. Применение индия
- •3.2.5. Сырьевые источники индия
- •3.2.6. Поведение индия в производстве цветных металлов
- •3.2.7. Первичная обработка индийсодержащего сырья
- •3.2.8. Получение индиевых концентратов
- •3.2.9. Получение чернового индия
- •3.2.10. Рафинирование чернового индия
- •3.2.10.1. Химические методы
- •3.2.10.2. Электрохимические методы
- •3.2.10.3. Физические методы
- •3.2.10.4. Кристаллофизические методы
- •3.3. Металлургия галлия
- •3.3.1. Краткая историческая справка
- •3.3.2. Свойства галлия и его соединений
- •3.3.3. Химические соединения галлия
- •3.3.4. Области применения галлия
- •3.3.5. Источники получения галлия
- •3.3.6. Поведение галлия при переработке сульфидных цинковых концентратов
- •3.3.7. Поведение галлия при переработке углей
- •3.3.8. Поведение галлия в производстве алюминия
- •3.3.12. Цементация галлия на галламе алюминия
- •3.3.13. Выделение галлия из гидратного осадка второй карбонизации
- •3.3.14. Способы получения металлического галлия
- •3.3.15. Рафинирование чернового галлия
- •3.4. Металлургия таллия, селена и теллура
- •3.4.1. Краткая историческая справка о таллии
- •3.4.2. Свойства таллия и его соединений
- •3.4.3. Химические соединения таллия
- •3.4.4. Области применения таллия
- •3.4.5. Сырьевые источники таллия
- •3.4.6. Поведение таллия при переработке свинцовых, цинковых и медных концентратов
- •3.4.7. Извлечение таллия из обогащенных им продуктов
- •3.4.8. Получение таллиевых концентратов
- •3.4.9. Получение чернового таллия и его рафинирование
- •3.4.10. Общие сведения о селене и теллуре
- •3.4.11. Физические свойства селена и теллура
- •3.4.12. Химические свойства слена и тллура
- •3.4.13. Химические соединения и их свойства
- •3.4.14. Области применения
- •3.4.15. Источники сырья
- •3.4.16. Технология переработки продуктов, содержащих селен и теллур
- •3.4.17. Извлечение селена и теллура из медеэлектролитных анодных шламов
- •3.4.18. Извлечение селена и теллура из шламов сернокислотного и целлюлозно-бумажного производства
- •3.4.19. Рафинирование селена и теллура
- •3.4.20. Техника безопасности при работе с селеном и теллуром
- •3.5. Металлургия германия
- •3.5.1. Краткая историческая справка
- •3.5.2. Свойства германия и его соединений
- •3.5.3. Химические соединения германия
- •3.5.4. Области применения
- •3.5.5. Источники сырья
- •3.5.6. Поведение германия при переработке сульфидного сырья
- •3.5.7. Поведение германия при переработке углей
- •3.5.8. Способы первичной обработки германиевых концентратов
- •3.5.9. Способы осаждения германия
- •3.5.10. Общая схема переработки германиевых концентратов
- •3.5.10.1. Разложение концентратов
- •3.5.10.2. Очистка от примесей
- •3.5.10.3. Получение чистого диоксида германия
- •3.5.10.4. Получение металлического германия Наиболее распространенный способ получения металлического германия – восстановление двуокиси германия водородом.
- •3.5.10.5. Рафинирование металлического германия Рафинирование проводят кристаллизационными способами:
- •4. Металлургия легких редких металлов
- •4.1 Металлургия лития
- •4.1.1. Краткая историческая справка
- •4.1.2. Свойства лития и его соединений
- •4.1.3. Применение лития и его соединений
- •4.1.4. Источники сырья
- •4.1.5. Технология производства соединений лития из рудных концентратов
- •4.1.5.1. Сернокислотный способ
- •4.1.5.2. Сульфатный способ
- •4.1.5.3. Известковый способ
- •4.1.6. Получение чистого хлорида лития
- •4.1.7.1. Получение лития электролитическим способом
- •4.1.8. Рафинирование лития
- •4.2. Металлургия цезия и рубидия
- •4.2.1. Краткая историческая справка
- •4.2.2. Свойства рубидия и цезия
- •4.2.3. Соединения рубидия и цезия
- •4.2.4. Области применения
- •4.2.5. Сырьевые источники цезия и рубидия
- •4.2.6. Переработка поллуцитового концентрата
- •4.2.6.1. Кислотные способы
- •4.2.6.2. Способы спекания
- •4.2.7. Извлечение рубидия и цезия из лепидолитового концентрата
- •4.2.8. Извлечение рубидия из карналлита
- •4.2.9. Получение металлического рубидия и цезия
- •4.2.9.1. Металлотермические способы
- •4.2.9.2. Электролитические способы
- •4.3. Металлургия бериллия
- •4.3.1. Краткие исторические сведения
- •4.3.2. Свойства бериллия и его соединений
- •4.3.3. Области применения бериллия
- •4.3.4. Сырьевые источники бериллия
- •4.3.5. Методы обогащения руд
- •4.3.6. Способы переработки берилловых концентратов
- •4.3.6.1. Сульфатный способ
- •4.3.6.2. Фторидный способ
- •4.3.7. Получение чистого оксида бериллия
- •4.3.8. Получение фторида бериллия
- •4.3.9. Получение хлорида бериллия
- •4.3.10. Производство металлического бериллия
- •4.3.10.1. Магниетермическое восстановление фторида бериллия
- •4.3.10.2. Получение бериллия электролизом
- •4.3.11. Получение компактного бериллия
- •5. Металлургия редкоземельных и радиоактивных металлов
- •5.1. Металлургия редкоземельных металлов
- •5.1.1. Общие сведения о редкоземельных металлах
- •5.1.2. Историческая справка
- •5.1.3. Физические свойства лантаноидов
- •5.1.4. Химические свойства
- •5.1.5. Области применения
- •5.1.6. Источники сырья. Минералы, руды, концентраты
- •5.1.7. Способы переработки монацитовых концентратов
- •5.1.7.1. Сернокислотный способ
- •5.1.7.2. Щелочной способ
- •5.1.8. Методы разделения редкоземельных металлов
- •5.1.8.1. Избирательное окисление
- •5.1.8.2. Избирательное восстановление
- •5.1.8.3. Разделение рзэ экстракцией
- •5.1.8.4. Разделение рзэ методом ионообменной хроматографии
- •5.1.8.5. Общие схемы полного разделения
- •5.1.9. Технология получения редкоземельных металлов
- •5.1.9.1. Получение хлоридов
- •5.1.9.2. Получение фторидов
- •5.1.9.3. Электролитическое получение редкоземельных металлов
- •5.1.9.4. Металлотермические способы получения лантаноидов из галогенидов
- •5.1.9.4.1. Восстановление галогенидов кальцием
- •5.1.9.4.2. Восстановление хлоридов кальцием
- •5.1.9.4.3. Восстановление фторидов кальцием
- •5.1.9.4.4. Литиетермический способ восстановления рзм из хлоридов
- •5.1.9.4.5. Восстановление самария, европия и иттербия из оксидов
- •5.1.10. Очистка редкоземельных металлов дистилляцией
- •5.2. Металлургия скандия
- •5.2.1. Общие сведения
- •5.2.2. Свойства скандия
- •5.2.3. Соединения скандия
- •5.2.4. Области применения скандия
- •5.2.5. Сырьевые источники скандия
- •5.2.6. Переработка скандийсодержащего сырья
- •5.2.6.1. Методы осаждения скандия из растворов
- •5.2.6.2. Переработка тортвейтита
- •5.2.6.3. Переработка уран - ториевых руд
- •5.2.6.4. Переработка титаномагнетитовых концентратов
- •5.2.6.5. Переработка отходов вольфрамового и оловянного производства
- •5.2.6.6. Переработка шлаков ферровольфрамового u oловянного производства
- •5.2.7. Получение металлического скандия
- •5.3. Металлургия тория и урана
- •5.3.1. Общие сведения о металлах
- •5.3.2. Свойства тория и урана
- •5.3.3. Химические соединения тория
- •5.3.4. Химические соединения урана
- •5.3.5. Области применения
- •5.3.6. Сырьевые источники урана
- •5.3.7. Извлечение урана из руд
- •5.3.8. Извлечение урана из растворов
- •5.3.9. Очистка концентратов
- •5.3.10. Получение тетрафторида урана
- •5.3.11. Производство урана
- •5.3.12. Восстановление тетрафторида урана кальцием
- •5.3.13. Восстановление тетрафторида урана магнием
- •5.3.14. Плавка урана
- •5.3.15. Получение чистых соединений тория
- •5.3.16. Производство тория
- •5.3.16.1. Восстановление диоксида тория кальцием
- •5.3.16.2. Восстановление тетрафторида тория кальцием
- •5.3.17. Получение компактного тория
4.1.6. Получение чистого хлорида лития
Безводный хлорид лития, служащий исходным материалом для производства лития, обычно получают из карбоната лития. Содержание примесей, %: натрия 0,12; кальция 0,03; алюминия 0,05; железа 0,005; сульфат-иона 0,1; оксида кремния 0,05; фосфат-иона 0,005.
Для получения хлорида лития обычно требуется предварительная очистка карбоната лития от примесей. Очистку проводят методом перекристаллизации через хорошо растворимый бикарбонат лития (способ Труста). С этой целью через водную суспензию Li2CO3 пропускают СО2, что приводит к переходу лития в раствор в виде бикарбоната LiHCO3.
При кипячении раствора бикарбонат разрушается, из раствора осаждается очищенный Li2CO3.
Для получения хлорида лития влажный карбонат растворяют в 30 %-ной соляной кислоте. Раствор очищают от примесей, выпаривают (трудности выпаривания и последующего обезвоживания хлорида обусловлены высокой коррозирующей способностью LiCl и его растворов, для выпаривания используют аппараты из керамики или специальных сплавов, а для обезвоживания хлорида – керамическую аппаратуру), кристаллизуют хлорид LiCl∙Н2О, хлорид обезвоживают (сушат) при 120 – 150 оС с получением LiCl.
4.1.7. Технология производства металлического лития
Вследствие высокого сродства к кислороду и к галогенам литий получают либо электролизом расплавленных сред, либо металлотермическим восстановлением с отгонкой лития.
4.1.7.1. Получение лития электролитическим способом
Электролиз проводят в электролите при соотношении LiCl : KCl = 1 : 1 (по массе), что близко к составу эвтектики в системе LiCl – KCl, плавящейся при 361 оС. Это позволяет проводить электролиз при 400 - 460 оС.
На рисунке 4.3 показана принципиальная схема электролизера с двумя прикатодными пространствами, отделенными от анодного пространства диафрагмами. Стальной кожух ванны футеруют графитом – наиболее устойчивым материалом по отношению к хлориду лития.
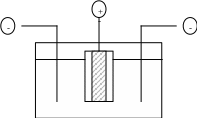
Рис. 4.3 – Схема электролизера для получения лития
Катодами служат пластины из низкоуглеродистой стали, анодами – графитовые стержни. Потенциалы разложения LiCl и KCl в электролите эвтектического состава при 400 оС равны 3,78 и 3,89 В соответственно, что обусловливает частичное выделение калия на катоде.
Электролиз ведут при 400 - 430 оС при плотности тока на катоде и аноде 2,0 - 5,0 и 0,8 - 1,5 А/см2 соответственно. Выход по току достигает 90-95 %.
Растворимость калия в литии плохая (0,5 – 1,5 %), поэтому он образует новую фазу, окисляется в электролизере до K2O и растворяется в электролите. Выделяющийся на катоде жидкий литий всплывает на поверхность электролита, и его вычерпывают железной сетчатой ложкой по мере накопления. Металл защищен от окисления тонкой пленкой солей, хорошо смачивающих жидкий литий. Примерное содержание примесей в электролитическом литии, %: Na 0,3 - 2,5; K 0,02 - 1,5; Cu, Fe, Ca от 0,001 до 0,4; Si 0,004 - 0,8; Al 0,002 - 0,12; Mg 0,003; Cl 0,01. Полученный литий переплавляют в парафине и хранят в банках с парафином. По ходу электролиза в анодное пространство периодически вводят LiCl, поддерживая в ванне его содержание 55 - 57 % (по массе). Хлор из анодного пространства направляется в абсорбер, орошаемый известковым молоком.
Электролизом, помимо лития, можно получать сплавы лития с другими металлами (кальцием, магнием, тяжелыми металлами). Для этого либо вводят в электролит хлорид соответствующего металла, либо ведут электролиз с растворимым анодом из металла – компонента сплава с литием.
4.1.7.2. Получение лития вакуумтермическим способом
Электролитический метод получения лития имеет определенные недостатки: исходный хлорид лития относительно дорог. Вследствие близости потенциалов выделения лития, калия и натрия электролитический литий содержит заметное количество примесей калия и натрия, что требует его дополнительной очистки. Необходимо поглощение или утилизация выделяющегося на катоде хлора. В связи с этим разработаны варианты вакуумтермических методов получения лития восстановлением из оксида лития, моноалюмината (Li2O∙Al2O3), а также непосредственно из сподумена.
Восстановление оксида лития. Сначала термическим разложением карбоната лития получают оксид лития. При 810, 890 и 1270 оС давление СО2 над карбонатом лития равно 2; 4,4 и 101 кПа соответственно. Чтобы в процессе разложения карбоната лития не происходило его расплавления (температура плавления Li2CO3 735 оС), что затрудняло бы удаление СО2, оксид лития получают прокаливанием брикетированной смеси Li2CO3 и СаО (при соотношении 1:1,5 по массе) при 850 оС в вакууме (для сдвига реакции в сторону выделения СО2). В результате получают смесь Li2О с СаО. Последняя является полезным компонентом шихты.
В качестве доступного восстановителя оксида лития применяют порошкообразный кремний:
2 Li2O + Si = SiO2 + 4 Li (4.9)
При стандартных условиях реакция характеризуется положительным изменением энергии Гиббса и является эндотермической: G0298 К = 298 кДж, Н0298 К = 320 кДж.
Следовательно, реакция может протекать при повышенных температурах в вакууме с отгонкой газообразного лития из сферы реакции. Однако в этих условиях часть оксида лития связывается в ортосиликат:
4 Li2O + Si = 4 Liгаз + Li4SiO4 (4.10)
Присутствующий в исходной шихте оксид кальция предотвращает эту реакцию, связывая SiO2 в ортосиликат кальция (G01000 K = - 351 кДж):
Li4SiO4 + Si + 4 CaO = 4 Liгаз + 2 Ca2SiO4 (4.11)
Прокаленную смесь оксидов лития и кальция измельчают, смешивают с порошком кремния (избыток 10 % против расчетного количества) и брикеты из этой смеси нагревают в вакуумной печи при 1000 - 1300 оС и давлении в печи 0,113 Па. Литий переходит в газовую фазу, конденсируется и собирается в конденсаторе. Выход лития при 1000 оС – 75 %, при 1300 оС – до 95 %. Основные примеси: 0,04 % кальция и 0,01 % кремния.
Восстановление алюмината лития. Литий высокой чистоты с выходом 95 - 98 % можно получить восстановлением моноалюмината лития алюминием в вакууме при 1150 - 1200 оС. Алюминат лития получают прокаливанием смеси Li2CO3 с Al2O3 при 1300 оС, при этом образуется Li2OAl2O3. Полученный продукт измельчают, добавляют порошкообразный алюминий, делают брикеты и проводят восстановление. Восстановление протекает по реакции:
3 (Li2OAl2O3) + 2 Al = 6 Liгаз + 4 Al2O3 (4.12)
Равновесное давление лития для этой реакции при 1100 оС равно 33,3 Па. Следовательно, восстановление можно проводить при 1200 оС и остаточном давлении около 13,3 Па. Для достижения высокого извлечения лития применяют избыток алюминия. Восстановление алюмината лития не требует введения в шихту оксида кальция, что обеспечивает получение металла более высокой чистоты.
Образующийся в результате восстановления оксид алюминия используют для получения алюмината лития.
