
- •Содержание
- •Введение
- •Объекты анализа материалов микроэлектроники
- •1. Основы качественного анализа
- •Классификация анионов
- •2. Аналитические реакции катионов
- •Лабораторная работа № 1 Частные реакции катионов I - II групп Опыт 1. Обнаружение катиона калия
- •Опыт 2. Обнаружение катиона натрия
- •Опыт 3. Обнаружение магния в растворе
- •Опыт 4. Определение иона аммония
- •Реакции катионов I группы
- •Опыт 5. Обнаружение катиона бария
- •Опыт 6. Обнаружение катиона стронция
- •Опыт 6. Обнаружение катиона стронция
- •Опыт 7. Обнаружение катиона кальция
- •Лабораторная работа № 2 Анализ смеси катионов I и II групп
- •3. Аналитические реакции катионов III группы
- •Лабораторная работа № 3 Частные реакции катионов III группы Опыт 1. Обнаружение катиона алюминия
- •Опыт 2. Обнаружение хрома
- •Реакции хромат- и бихромат-ионов
- •Опыт 3. Обнаружение железа
- •Опыт 5. Обнаружение цинка в растворе
- •Опыт 6. Обнаружение кобальта
- •Опыт 7. Обнаружение никеля
- •Лабораторная работа № 4 Анализ смеси катионов III, II и I групп
- •4. Аналитические реакции катионов IV и V групп
- •Опыт 2. Обнаружение катионов кадмия
- •Опыт 3. Обнаружение катионов висмута
- •Подгруппа мышьяка Опыт 5. Обнаружение ионов мышьяка
- •Реакции катионов подгруппы меди
- •Обнаружение арсенит-ионов
- •Обнаружение арсенат-ионов
- •Опыт 6. Обнаружение ионов сурьмы
- •Обнаружение ионов сурьмы (III)
- •Обнаружение ионов сурьмы (V)
- •Опыт 7. Обнаружение ионов олова
- •Обнаружение ионов олова (II)
- •Обнаружение ионов олова (IV)
- •Лабораторная работа № 6 Анализ смеси катионов IV группы
- •Лабораторная работа № 7 Частные реакции катионов V группы Опыт I. Определение катионов серебра
- •Опыт 2. Обнаружение катионов свинца
- •Лабораторная работа № 8 Анализ смеси катионов V - I групп
- •Реакции катионов V группы
- •5. Аналитические реакции анионов
- •Опыт 2. Определение аниона со32–
- •Опыт 3. Определение аниона ро4–
- •Опыт 4. Определение аниона SiO32–
- •Опыт 5. Определение аниона f –
- •Вторая аналитическая группа анионов Опыт 6. Определение аниона с1–
- •Опыт 7. Определение аниона Вr –
- •Опыт 8. Определение аниона I –
- •Опыт 9. Определение аниона s2–
- •Третья аналитическая группа анионов Опыт 10. Определение аниона no3–
- •Опыт п. Определение анионов no2–
- •6. Количественный анализ
- •7. Гравиметрия
- •Весовые методы определения некоторых элементов
- •Лабораторная работа № 10 Весовое определение серы в сульфиде кадмия
- •Оборудование и реактивы
- •Описание определения
- •Определение серы
- •Лабораторная работа №11 Весовое определение никеля и железа в резистивных сплавах Определение никеля
- •Оборудование и реактивы
- •Описание определения
- •Определение железа
- •Оборудование и реактивы
- •Описание определения
- •8. Титриметрия
- •Растворение образца.
- •Описание определения
- •Лабораторная работа № 16 Определение стехиометрического состава сверх проводящей керамики ( система y-Ba-Cu )
- •Определение бария
- •Реактивы
- •Описание определения
- •Иодометрическое титрование
- •Стандартизация раствора тиосульфата натрия по бихромату калия
- •Реактивы
- •Описание определения
- •Определение меди
- •Реактивы
- •Описание определения
- •Определение иттрия комплексонометрическим титрованием
- •Реактивы
- •Описание определения
- •Расчет стехиометрии y1 Ва2 Cu3o7
- •9.Физико-химические методы анализа
- •А. Определение фосфора по желтой форме
- •Оборудование и реактивы
- •Описание определения
- •Б. Определение фосфора в виде фосфорномолибденовой сини
- •Оборудование и реактивы
- •Описание определения
- •В. Определение кремния
- •Оборудование и реактивы
- •Описание определения
- •Оборудование и реактивы
- •Описание определения
- •Б. Фотометрическое определение железа в виде роданидного комплекса
- •Оборудование и реактивы
- •Описание определения
- •Лабораторная работа № 19 Экстракционно – фотометрическое определение германия в полупроводниковых халькогенидных стеклах системы Te–As-Si-Ge
- •Оборудование и реактивы
- •Описание определения
- •Лабораторная работа № 20 Спектрофотометрическое определение хрома и марганца при совместном присутствии в контактных проводниковых сплавах
- •Оборудование и реактивы
- •Описание определения
- •Лабораторная работа № 21 Спектрофотометрическое определение висмута в присутствии свинца
- •Оборудование и реактивы
- •Описание определения
- •11. Люминесцентный анализ
- •Оборудование и реактивы
- •Описание определения
- •12. Инфракрасная спектроскопия
- •Лабораторная работа № 23 Измерение толщины пленок диоксида и нитрида кремния методом икс
- •Применение икс для исследования материалов микроэлектроники
- •Оборудование и реактивы
- •Описание определения
- •В отчете долж ны быть представлены:
- •Пример расчета:
- •13.Эмиссионный спектральный анализ
- •Лабораторная работа № 24 Определение примесей металлов методом трех эталонов
- •А. Фотографирование спектров трех эталонов и образцов Оборудование и реактивы
- •Описание определения
- •Характерные группы линий железа на планшетах атласа
- •В. Измерение почернений линий примесей на микрофотометре и построение калибровочных графиков
- •Оборудование и реактивы
- •Описание определения
- •Форма записи результатов наблюдений
- •Последовательность фотографирования образцов
- •Форма записи результатов наблюдений
- •Длины волн определяемых примесей
- •14. Электрохимические методы анализа
- •15.Потенциометрия
- •Прямая потенциометрия (ионометрия)
- •Оборудование и реактивы
- •Описание определения
- •Результаты ионометрического определения ионов в воде
- •Б. Определение фторид-ионов
- •Оборудование и реактивы
- •Описание определения
- •Лабораторная работа № 27 Определение рН в водных растворах
- •Оборудование и реактивы
- •Описание определения
- •Потенциометрическое титрование (пт)
- •Результаты титрования
- •Лабораторная работа № 28 Определение соляной кислоты в травильной ванне
- •Оборудование и реактивы
- •Описание определения
- •Лабораторная работа № 29 Определение соляной и уксусной кислот в растворе при совместном присутствии
- •Оборудование и реактивы
- •Описание определения
- •Лабораторная работа № 30 Определение соляной и борной кислот в растворе при совместном присутствии
- •Оборудование и реактивы
- •Описание определения
- •Лабораторная работа № 31 Определение содержания кобальта (II) в растворе
- •Оборудование и реактивы
- •Описание определения
- •Лабораторная работа № 32 Определение концентрации хлорида железа (III)
- •Оборудование и реактивы
- •Описание определения
- •16. Кондуктометрическое титрование
- •Лабораторная работа № 33 Дифференцированное определение солей железа (п) и(ш) в травильных растворах
- •Оборудование и реактивы
- •Описание определения
- •17. Вольтамперометрия
- •Лабораторная работа № 34 Определение примеси цинка в фосфоре
- •18. Инверсионная вольтамперометрия
- •Лабораторная работа № 36 Определение примесей цинка, кадмия, свинца и меди методом инверсионной вольтамперометрии
- •Оборудование и реактивы
- •Описание определения
- •19. Хроматография
- •Раздельное вымывание примесей с катионита ку-2
- •Лабораторная работа № 37 Определение меди и цинка при их совместном присутствии на катионите ку-2
- •Оборудование и реактивы
- •Описание определения
- •Описание определения
- •Определение кадмия
- •Результаты хроматографического определения ионов кадмия
- •Определение теллура
- •20. Рекомендуемая литература
- •Реакции катионов III группы
- •Реакции ионов подгруппы мышьяка
Лабораторная работа № 34 Определение примеси цинка в фосфоре
Фосфор используют для получения бинарных и более сложных полупроводниковых материалов. Известны, например, фосфиды индия и галлия, поэтому необходимо проводить периодический аналитический контроль за степенью чистоты фосфора. Определение примеси цинка в фосфоре удобно проводить полярографическим методом с использованием ртутного капельного электрода. Фосфор после растворения образца в азотной кислоте находится в растворе в виде полярографически неактивного аниона РО43–. Чувствительность определения цинка 1·10–5%.
Оборудование и реактивы
Полярограф.
Мерные колбы, 50 мл, 5-6 шт.
Стандартный раствор фосфата, 10–2 М.
Фон - смесь 1,0 н раствора NH4OH с 1,0 н. раствором NH4Cl.
Описание определения
Навеску фосфора растворяют в азотной кислоте при нагревании. Избыток кислоты удаляют выпариванием. Раствор разбавляют водой в мерной колбе.
10 мл полученного раствора в полярографической ячейке продувают в течение 15 мин азотом и регистрируют полярограмму цинка при потециале –1,4 В. Содержание цинка в образцах фосфора определяют методом добавок или по калибровочному графику.
Лабораторная работа № 35
Определенно примеси сурьмы в олове
Для определения сурьмы в олове образец растворяют в соляной кислоте в присутствии хлорида кобальта, являющегося катализатором. В данном случае олово и сурьма окисляются до низших степеней окисления, что устраняет необходимость применения восстановителей.
Оборудование и реактивы
Полярограф.
Мерные колбы, 50 мл, 5-6 шт.
Стандартный раствор соли олова, 10–2 М.
Хлорид кобальта, кристаллический.
Соляная кислота, 10 н раствор.
Описание определения
Олово растворяют в 10 н. соляной кислоте в присутствии 2-3 кристалликов хлорида кобальта при 60-70 °С. Раствор охлаждают и разбавляют водой. Стакан ставят в электролизер и в течение 5 – 10 мин проводят электролиз на амальгамном пленочном электроде. В этих условиях определению сурьмы не мешает свинец, цинк, кадмий, индий, медь и висмут. Электролиз ведут при потенциале – 0,4 В. При этом потенциале предельный диффузионный ток олова не достигается, так как ЕSn = –0,48 В. Содержание сурьмы определяют методом добавок. Чувствительность определения 1·10–6 %.
18. Инверсионная вольтамперометрия
Сущность инверсионного вольтамперометрического метода (ИВА) заключается в том, что определяемый ион концентрации 10–7-10–10 моль/л некоторое время подвергается электролизу на индикаторном электроде. При этом определяемый элемент концентрируется на ртутной пленке в виде амальгамы. Степень концентрирования зависит от времени электролиза (≤ 5 мин). Далее выделенный элемент анодно растворяют . Анодная вольтамперограмма при этом в отличие от классической имеет вид характерного пика.
Высота волны и пика пропорциональна концентрации вещества в растворе. Волны или пики могут быть анодными (электрохимическое вещество окисляется) (рис.11) или катодными (электрохимическое вещество восстанавливается.
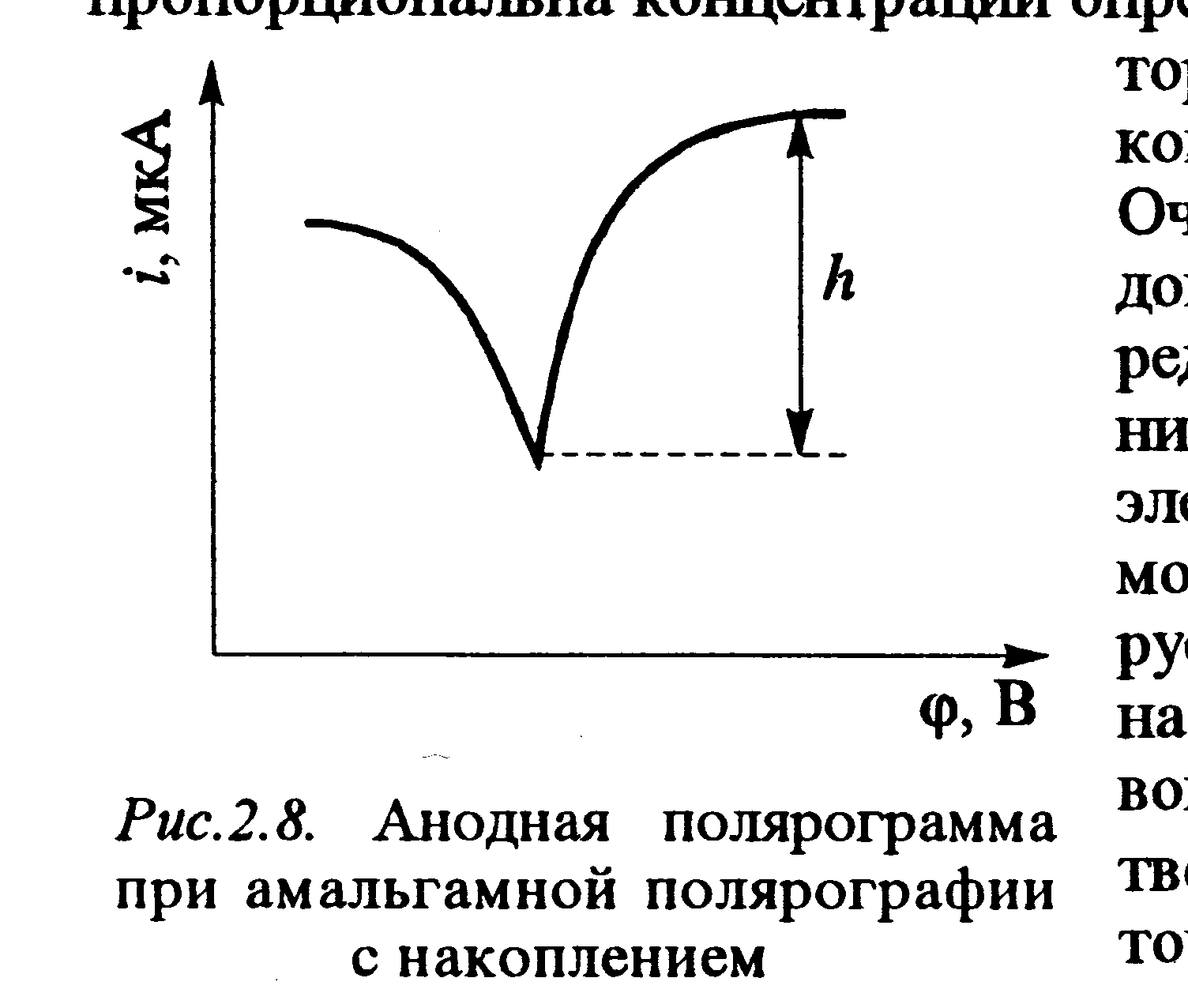
Рис 11. Анодная полярограмма с предварительным накоплением
Потенциал полуволны или пика определяется, в основном природой реагирующих веществ. Благодаря этому он может быть критерием для проведения качественного анализа.
Если в растворе присутствуют несколько ионов металлов. образующих со ртутью амальгаммы ( медь, цинк, олово, свинец, висмут, индий, кадмий и многие другие) их можно определять одновременно. На рис 12 приведена полярограмма смеси катионов.
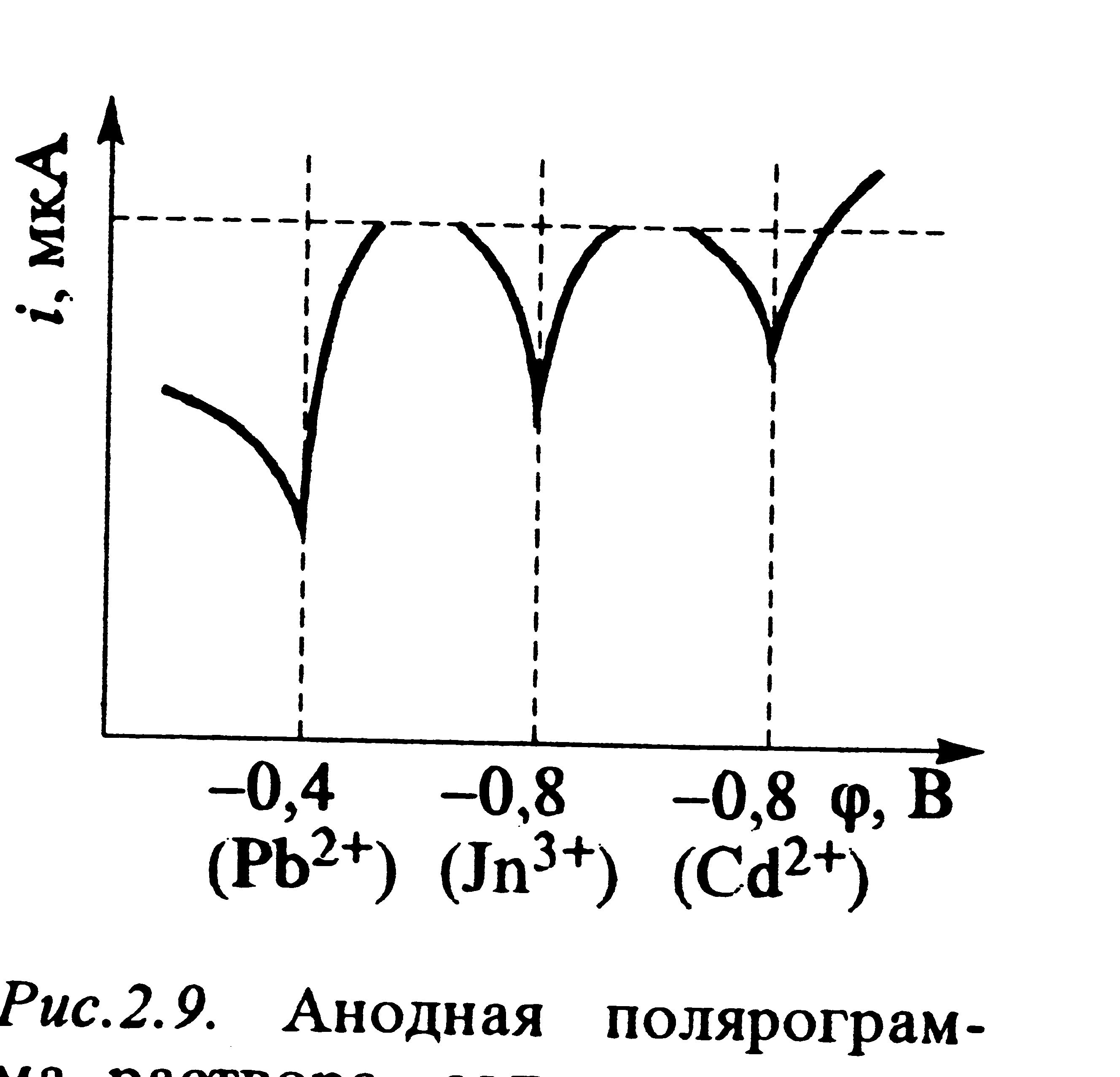
Рис 12. Анодная полярограмма раствора, содержавшего три катиона
В инверсионной вольтамперометрии применяются стационарные ртутные электроды, что позволяет исключить использование больших количеств токсичной ртути, а наличие стадии концентрирования определяемого вещества повышает чувствительность метода на несколько порядков (предел обнаружения составляет 10-5 – 10-6 мг/л).
Существуют несколько методов определения концентрации: метод калибровочного графика, метод стандартных растворов и метод добавок.
Наибольшее распространение получил метод добавок. Он, как и метод калибровочного графика основан на зависимости анодного тока от концентрации:
I=K∙C,
где K – константа, зависящая от условий опыта.
Из анализируемого раствора Cx готовят раствор с известной добавкой определяемого вещества Cx + Cдоб и снимают вольтамперограммы обоих растворов. Находят:
![]()
![]()
![]()
где Ix - максимальный анодный ток анализируемого раствора;
Iдоб - ток добавки.
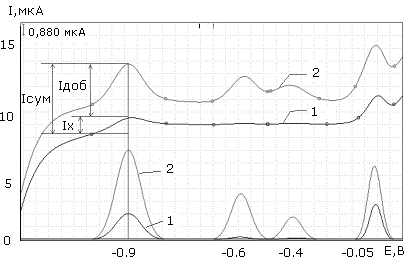
Рис.13. Волььамперограммы цинка, свинца, кадмия и меди в анализируемом растворе: 1 – анализируемый раствор, 2 – проба с добавкой
На рис.13 представлены вольтамперограммы анализируемого раствора, содержащего ионы цинка, кадмия, свинца, меди (1), и пробы с добавкой (2).
.Достоинством метода ИВ является высокая чувствительность определения следов на уровне 0,01 - 0,001 мкг.
