
- •Содержание
- •Введение
- •Объекты анализа материалов микроэлектроники
- •1. Основы качественного анализа
- •Классификация анионов
- •2. Аналитические реакции катионов
- •Лабораторная работа № 1 Частные реакции катионов I - II групп Опыт 1. Обнаружение катиона калия
- •Опыт 2. Обнаружение катиона натрия
- •Опыт 3. Обнаружение магния в растворе
- •Опыт 4. Определение иона аммония
- •Реакции катионов I группы
- •Опыт 5. Обнаружение катиона бария
- •Опыт 6. Обнаружение катиона стронция
- •Опыт 6. Обнаружение катиона стронция
- •Опыт 7. Обнаружение катиона кальция
- •Лабораторная работа № 2 Анализ смеси катионов I и II групп
- •3. Аналитические реакции катионов III группы
- •Лабораторная работа № 3 Частные реакции катионов III группы Опыт 1. Обнаружение катиона алюминия
- •Опыт 2. Обнаружение хрома
- •Реакции хромат- и бихромат-ионов
- •Опыт 3. Обнаружение железа
- •Опыт 5. Обнаружение цинка в растворе
- •Опыт 6. Обнаружение кобальта
- •Опыт 7. Обнаружение никеля
- •Лабораторная работа № 4 Анализ смеси катионов III, II и I групп
- •4. Аналитические реакции катионов IV и V групп
- •Опыт 2. Обнаружение катионов кадмия
- •Опыт 3. Обнаружение катионов висмута
- •Подгруппа мышьяка Опыт 5. Обнаружение ионов мышьяка
- •Реакции катионов подгруппы меди
- •Обнаружение арсенит-ионов
- •Обнаружение арсенат-ионов
- •Опыт 6. Обнаружение ионов сурьмы
- •Обнаружение ионов сурьмы (III)
- •Обнаружение ионов сурьмы (V)
- •Опыт 7. Обнаружение ионов олова
- •Обнаружение ионов олова (II)
- •Обнаружение ионов олова (IV)
- •Лабораторная работа № 6 Анализ смеси катионов IV группы
- •Лабораторная работа № 7 Частные реакции катионов V группы Опыт I. Определение катионов серебра
- •Опыт 2. Обнаружение катионов свинца
- •Лабораторная работа № 8 Анализ смеси катионов V - I групп
- •Реакции катионов V группы
- •5. Аналитические реакции анионов
- •Опыт 2. Определение аниона со32–
- •Опыт 3. Определение аниона ро4–
- •Опыт 4. Определение аниона SiO32–
- •Опыт 5. Определение аниона f –
- •Вторая аналитическая группа анионов Опыт 6. Определение аниона с1–
- •Опыт 7. Определение аниона Вr –
- •Опыт 8. Определение аниона I –
- •Опыт 9. Определение аниона s2–
- •Третья аналитическая группа анионов Опыт 10. Определение аниона no3–
- •Опыт п. Определение анионов no2–
- •6. Количественный анализ
- •7. Гравиметрия
- •Весовые методы определения некоторых элементов
- •Лабораторная работа № 10 Весовое определение серы в сульфиде кадмия
- •Оборудование и реактивы
- •Описание определения
- •Определение серы
- •Лабораторная работа №11 Весовое определение никеля и железа в резистивных сплавах Определение никеля
- •Оборудование и реактивы
- •Описание определения
- •Определение железа
- •Оборудование и реактивы
- •Описание определения
- •8. Титриметрия
- •Растворение образца.
- •Описание определения
- •Лабораторная работа № 16 Определение стехиометрического состава сверх проводящей керамики ( система y-Ba-Cu )
- •Определение бария
- •Реактивы
- •Описание определения
- •Иодометрическое титрование
- •Стандартизация раствора тиосульфата натрия по бихромату калия
- •Реактивы
- •Описание определения
- •Определение меди
- •Реактивы
- •Описание определения
- •Определение иттрия комплексонометрическим титрованием
- •Реактивы
- •Описание определения
- •Расчет стехиометрии y1 Ва2 Cu3o7
- •9.Физико-химические методы анализа
- •А. Определение фосфора по желтой форме
- •Оборудование и реактивы
- •Описание определения
- •Б. Определение фосфора в виде фосфорномолибденовой сини
- •Оборудование и реактивы
- •Описание определения
- •В. Определение кремния
- •Оборудование и реактивы
- •Описание определения
- •Оборудование и реактивы
- •Описание определения
- •Б. Фотометрическое определение железа в виде роданидного комплекса
- •Оборудование и реактивы
- •Описание определения
- •Лабораторная работа № 19 Экстракционно – фотометрическое определение германия в полупроводниковых халькогенидных стеклах системы Te–As-Si-Ge
- •Оборудование и реактивы
- •Описание определения
- •Лабораторная работа № 20 Спектрофотометрическое определение хрома и марганца при совместном присутствии в контактных проводниковых сплавах
- •Оборудование и реактивы
- •Описание определения
- •Лабораторная работа № 21 Спектрофотометрическое определение висмута в присутствии свинца
- •Оборудование и реактивы
- •Описание определения
- •11. Люминесцентный анализ
- •Оборудование и реактивы
- •Описание определения
- •12. Инфракрасная спектроскопия
- •Лабораторная работа № 23 Измерение толщины пленок диоксида и нитрида кремния методом икс
- •Применение икс для исследования материалов микроэлектроники
- •Оборудование и реактивы
- •Описание определения
- •В отчете долж ны быть представлены:
- •Пример расчета:
- •13.Эмиссионный спектральный анализ
- •Лабораторная работа № 24 Определение примесей металлов методом трех эталонов
- •А. Фотографирование спектров трех эталонов и образцов Оборудование и реактивы
- •Описание определения
- •Характерные группы линий железа на планшетах атласа
- •В. Измерение почернений линий примесей на микрофотометре и построение калибровочных графиков
- •Оборудование и реактивы
- •Описание определения
- •Форма записи результатов наблюдений
- •Последовательность фотографирования образцов
- •Форма записи результатов наблюдений
- •Длины волн определяемых примесей
- •14. Электрохимические методы анализа
- •15.Потенциометрия
- •Прямая потенциометрия (ионометрия)
- •Оборудование и реактивы
- •Описание определения
- •Результаты ионометрического определения ионов в воде
- •Б. Определение фторид-ионов
- •Оборудование и реактивы
- •Описание определения
- •Лабораторная работа № 27 Определение рН в водных растворах
- •Оборудование и реактивы
- •Описание определения
- •Потенциометрическое титрование (пт)
- •Результаты титрования
- •Лабораторная работа № 28 Определение соляной кислоты в травильной ванне
- •Оборудование и реактивы
- •Описание определения
- •Лабораторная работа № 29 Определение соляной и уксусной кислот в растворе при совместном присутствии
- •Оборудование и реактивы
- •Описание определения
- •Лабораторная работа № 30 Определение соляной и борной кислот в растворе при совместном присутствии
- •Оборудование и реактивы
- •Описание определения
- •Лабораторная работа № 31 Определение содержания кобальта (II) в растворе
- •Оборудование и реактивы
- •Описание определения
- •Лабораторная работа № 32 Определение концентрации хлорида железа (III)
- •Оборудование и реактивы
- •Описание определения
- •16. Кондуктометрическое титрование
- •Лабораторная работа № 33 Дифференцированное определение солей железа (п) и(ш) в травильных растворах
- •Оборудование и реактивы
- •Описание определения
- •17. Вольтамперометрия
- •Лабораторная работа № 34 Определение примеси цинка в фосфоре
- •18. Инверсионная вольтамперометрия
- •Лабораторная работа № 36 Определение примесей цинка, кадмия, свинца и меди методом инверсионной вольтамперометрии
- •Оборудование и реактивы
- •Описание определения
- •19. Хроматография
- •Раздельное вымывание примесей с катионита ку-2
- •Лабораторная работа № 37 Определение меди и цинка при их совместном присутствии на катионите ку-2
- •Оборудование и реактивы
- •Описание определения
- •Описание определения
- •Определение кадмия
- •Результаты хроматографического определения ионов кадмия
- •Определение теллура
- •20. Рекомендуемая литература
- •Реакции катионов III группы
- •Реакции ионов подгруппы мышьяка
Оборудование и реактивы
Кондуктометр.
Ячейка для измерения электропроводности.
Магнитная мешалка.
ЭДТА, 0,1 н. раствор.
Ацетатная буферная смесь, раствор с рН = 5.
Мерная колба, 100 мл.
Мерный цилиндр, 20 мл.
Химический стакан, 150 мл.
Бюретка для титрования.
Описание определения
Аликвотную часть анализируемого раствора (50,00 мл) переносят в химический стакан. Туда же помещают ячейку для измерения электропроводности так, чтобы электроды ее были полностью закрыты раствором. При необходимости в раствор можно добавить дистиллированную воду. Подключают ячейку к кондуктометру, и при постоянном перемешивании титруют раствор комплексоном Ш. До первой точки эквивалентности (рис. 6) электропроводность будет повышаться, а затем, после достижения точки эквивалентности начнет падать. В этот момент добавляют еще две-три порции титранта, фиксируя при этом электропроводность. Затем в анализируемый раствор вносят 20 мл ацетатной буферной смеси и продолжают титрование до определения второй точки эквивалентности. По результатам титрования строят кривую титрования и определяют точки эквивалентности.
Нормальную концентрацию (N) ионов Fe3+ определяют по формуле:
![]() ,
,
где N нормальная концентрация; Nk - нормальная концентрация раствора комплексона Ш;
V0 – объем аликвотной части анализируемого раствора, мл;
V1 - эквивалентный объем комплексона Ш в первой точке эквивалентности, мл.
Концентрацию ионов Fe2+ определяют по формуле:
![]() ,
,
где V2 - объем раствора ЭДТА во второй точке эквивалентности, мл.
17. Вольтамперометрия
Вольтамперометрические методы анализа основаны на изучении зависимости силы тока от приложенного к электролитической ячейке внешнего напряжения. По вольтамперограмме можно судить об электродном процессе, протекающем на индикаторном электроде. В случае, если индикаторным электродом является ртутный капающий электрод, кривую зависимости силы тока от внешнего напряжения называют полярограммой.
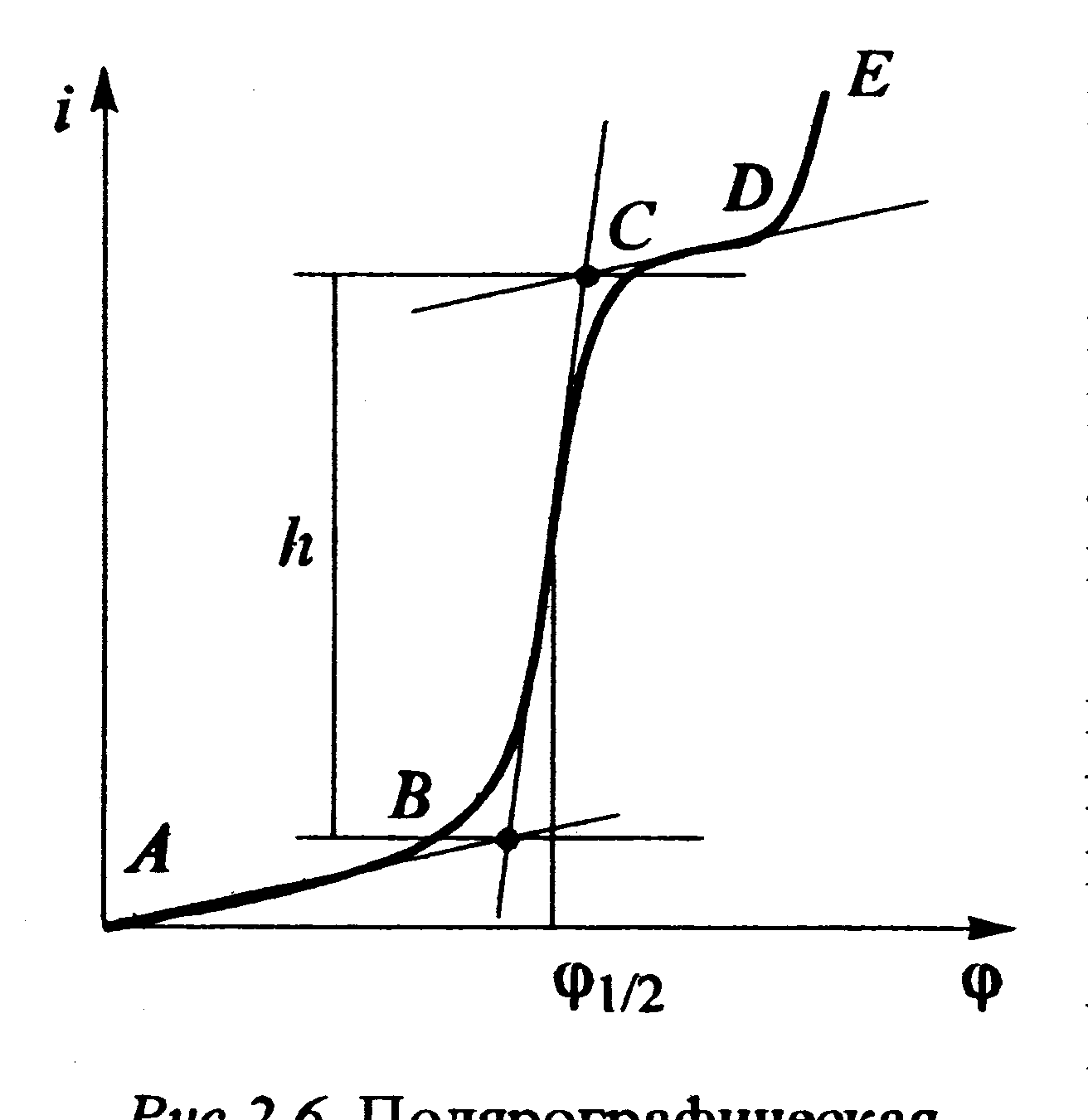
Характеристиками классической полярограммы являются потенциал полуволны, диффузионный ток и наклон (рис. 9, а).
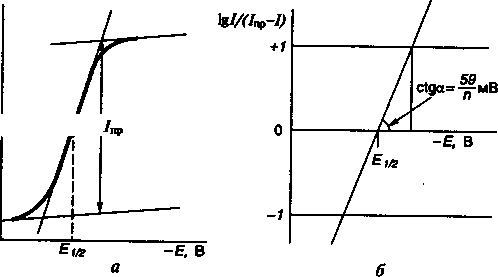
а) б)
Рис.9. Полярографическая кривая: а) в координатах i – φ (или Е) и б) lgI/(Iпр – I)
На полярограмме можно выделить четыре участка:
АВ - остаточный ток (ток заряжения и ток за счет примесей),
ВС - процесс восстановления, состоит из нескольких стадий:
- диффузия иона к поверхности электрода,
- процесс восстановления (передача ē электродом иону),
- продукты реакции покидают сферу реакции .
Скорость процесса восстановления определяется самой медленной стадией - диффузией иона к электроду.
СД - предельный диффузионный ток,
ДЕ - начало разложения воды,
h - высота волны.
1. Потенциал полуволны, Е½ или φ½ (В), характеризует природу разряжающегося иона, не зависит от концентрации определяемого вещества в растворе, а определяется только составом раствора (фоном).
2. Диффузионный ток, I (мкА). Если при регистрации полярограммы в ячейке присутствует большое количество (0,1 — 1 М) индифферентного электролита и раствор не перемешивают, величина тока, протекающего через ячейку, определяется скоростью диффузии разряжающихся ионов. По мере восстановления ионов их концентрация в приэлектродном слое убывает и наступает такой момент, когда их концентрация вблизи поверхности электрода становится равной нулю. Дальнейшее увеличение тока становится невозможным, при этом электрод оказывается в состоянии концентрационной поляризации. Ток, протекающий в этом случае через электрохимическую ячейку – предельный диффузионный ток или пропорциональная ему высота волны (h, мм) согласно уравнению Ильковича линейно зависят от концентрации разряжающегося иона в растворе:
iдиф = 605∙n∙D1/2∙m2/3∙t1/6∙C,
где iдиф. – предельный диффузионный ток, мкА;
n –число электронов;
D – коэффициент диффузии, см2∙сек–1;
m – масса ртути, вытекающей из капилляра за 1 сек., мг;
t – время образования капли, сек.;
C – концентрация ионов, ммоль.
Все перечисленные величины (кроме С) можно объединить в const (K),
учитывающую условия опыта:
iдиф = K∙ C.
Эта зависимость служит основой количественного полярографического анализа.
3. Наклон
полярограммы, (ctg
α,мВ).
На рис.9 б
представлена полярограмма в координатах
![]() .
Котангенс угла наклона для обратимого
процесса равен 59/n
мВ (25 ºС).
.
Котангенс угла наклона для обратимого
процесса равен 59/n
мВ (25 ºС).
Сравнение экспериментальной величины котангенса с теоретической при известном числе электронов позволяет оценить обратимость электродного процесса. Если независимым методом доказана обратимость электродного процесса, эта же зависимость позволяет определить число электронов. участвкющих в электродном процессе.
Для количественного анализа используют:
1. Метод калибровочного графика
2. Метод добавок
По первому методу снимают три полярограммы растворов с известной концентрацией С1, С2, С3 и строят калибровочный график в координатах : h (высота волны) – С (концентрация).
По методу добавок - снимают полярограмму анализируемого раствора (Сx) и анализируемого раствора с добавкой (Сx + С0). Определив по двум полярограммам высоту волны h1 и h2, можно рассчитать концентрацию Сx:
h1 = K∙Cx; h2 = K(Сx + С0);
Сx
= C0
∙![]() ;
;
Метод полярографии применим для анализа микропримесей, С ~ 10–6 %.
Предварительным концентрированием можно повысить предел обнаружения на один – два порядка.
Разновидностью классической полярографии является дифференциальная полярография. В этом методе полярограмму строят в координатах di/dφ – φ. Полярографические кривые имеют максимумы, положение которых на оси абсцисс соответствует потенциалу полуволны, а высота – концентрации определяемых элементов(рис.10).
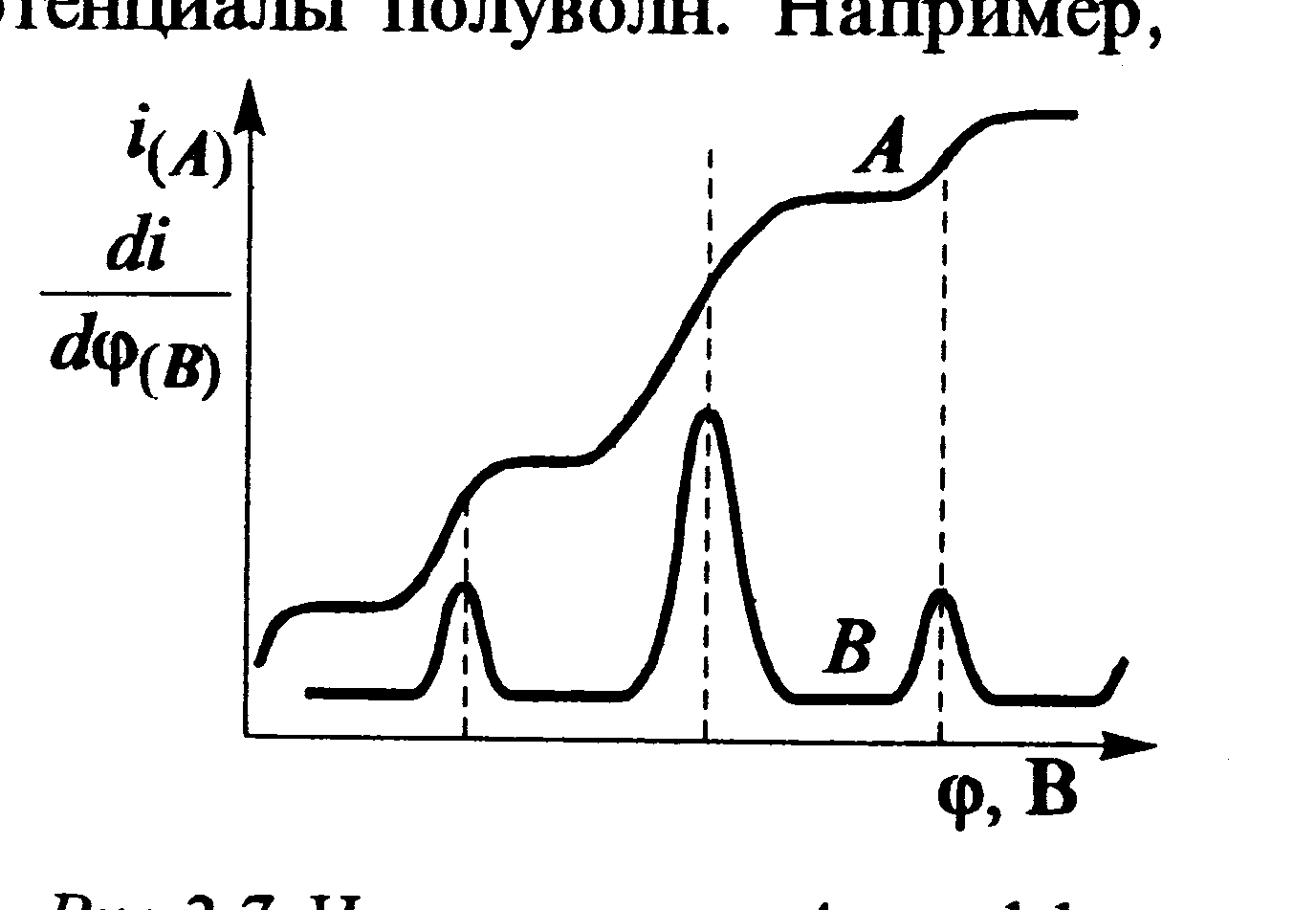
Рис.10. Интегральная (А) и дифференциальная (В) полярограммы.
Метод дифференциальной полярографии обладает более высоким разрешением и позволяет в некоторых случаях анализировать смеси веществ, имеющие близкие потенциалы полуволн.
Чувствительность классической полярографии часто оказывается недостаточной при анализе особо чистых веществ. Поэтому в настоящее время созданы полярографические методы, позволяющие повысить чувствительность определения. Так за счет повышения скорости развертки потенциала в осциллографической полярографии удалось достичь чувствительности 10–6моль/л, в импульсной полярографии – 5·10–7 моль/л, а в квадратноволновой переменнотоковой – 5·10–8 моль/л.
