
- •Элементы viia подгруппы
- •Работа №1 Галогены
- •Опыт 1. Получение хлора из соляной кислоты действием различных окислителей
- •Опыт 2. Получение брома
- •Опыт 3. Растворимость брома и йода в органических растворителях
- •Опыт 4. Окислительные свойства галогенов
- •Опыт 5. Сравнительная характеристика окислительных cвойств свободных галогенов
- •Опыт 6. Сравнительная характеристика восстановительных свойств галогенид-ионов
- •Опыт 7. Гипохлориты и их окислительные свойства
- •Опыт 8. Хлораты и йодаты
- •Контрольные вопросы и задания
- •2. Элементы via подгруппы
- •Работа №2 Сера
- •Опыт 2. Получение малорастворимых сульфидов металлов.
- •Опыт 3. Окислительно – восстановительные свойства сернистой кислоты и сульфит - ионов ()
- •Опыт 4. Окислительные свойства персульфатов.
- •Опыт 5. Гидролиз солей.
- •Опыт 6. Качественное определение ионов серы.
- •Контрольные вопросы и задания
- •3.Халькогениды металлов
- •Значения пр некоторых сульфидов металлов
- •Растворители сульфидов
- •Работа № 3 Получение сульфидов металлов и исследование их свойств
- •Опыт 1. Получение осадков сульфидов металлов и исследование их растворимости
- •Опыт 2. Изучение растворимости осадков сульфидов металлов
- •Опыт 3 (контрольная задача). Качественное определение ионов металлов
- •Опыт 4. Получение пленки CdS методом осаждения из растворов
- •Контрольные вопросы и задания
- •4. Элементы vа подгруппы
- •Мышьяк. Сурьма. Висмут.
- •Работа № 4 а. Азот. Фосфор
- •Опыт 1. Восстановительные свойства аммиака.
- •Опыт 2. Свойства азотистой кислоты и нитритов.
- •Опыт 3. Качественное определение ионов азота
- •Опыт 4. Качественная реакция на фосфат-ион (po43-)
- •Опыт 7. Получение гидроксида висмута (III) и исследование его свойств
- •Опыт 8. Окислительно-восстановительные свойства соединений висмута (III)
- •Опыт 9. Окислительные свойства соединений висмута (V)
- •Контрольные вопросы и задания
- •5. Элементы iva подгруппы
- •Гидролиз солей олова и свинца протекает с образованием основных солей. Например:
- •Работа № 5 а. Кремний. Германий
- •Опыт 1 (демонстрационный). Получение аморфного кремния восстановлением диоксида кремния металлическим магнием Получение аморфного кремния основано на реакции
- •Опыт 2. Получение геля кремниевой кислоты
- •Опыт 3. Гидролиз силиката натрия
- •Опыт 7. Определение химической природы диоксида германия
- •Б. Олово. Свинец Опыт 8. Взаимодействие олова с концентрированными кислотами
- •Опыт 9. Получение гидроксида олова (II) и исследование его свойств
- •Опыт 10. Гидролиз солей олова (II)
- •Опыт 11. Восстановительные свойства соединений олова (II). Восстановление железа (III)
- •Опыт 12. Вытеснение свинца из раствора его соли более активными металлами
- •Опыт 13. Отношение свинца к разбавленным кислотам
- •Опыт 14. Малорастворимые соли свинца (п)
- •Опыт 15. Получение гидроксида свинца (п) и изучение его свойств
- •Опыт 16. Амфотерные свойства диоксида свинца
- •Опыт 17. Окислительные свойства соединений свинца (IV)
- •Контрольные вопросы и задания
- •6. Комплексные соединения
- •Работа №6. А Свойства комплексных соединений
- •Опыт 1. Получение и свойства аммиаката никеля.
- •Опыт 2. Получение и свойства ацидокомплекса ртути и изучение его свойств.
- •Опыт 3. Получение соединения,
- •Опыт 6. Разрушение комплексов.
- •Б Синтез двойных и комплексных солей
- •Синтез двойных солей.
- •Частные реакции на ионы
- •Синтез комплексных солей
- •Контрольные вопросы и задания
- •7. Металлы
- •Ib. Медь, серебро, золото
- •Iib. Цинк, кадмий, ртуть
- •Iiia. Элементы iiia подгруппы
- •Алюминий, галлий, индий, таллий
- •Viiib. Железо, кобальт, никель
- •Работа № 7. Химические свойства металлов
- •Опыт 1. Растворение металлов в кислотах и щелочах
- •Опыт 2. Получение гидроксидов металлов и исследование их свойств
- •Опыт 3. Получение сульфидов металлов
- •Опыт 4. Гидролиз солей некоторых металлов
- •Опыт 5. Комплексные соединения d-элементов
- •Опыт 6. Окислительно-восстановительные свойства ионов металлов
- •Индивидуальные задания.
- •Контрольные вопросы и задания
- •8. Элементы iа подгруппы
- •Работа № 8. Натрий
- •Опыт 1. Взаимодействие натрия с водой.
- •Опыт 2. Свойства пероксида натрия.
- •Опыт 3. Гидролиз карбоната и гидрокарбоната натрия.
- •Контрольные вопросы и задания
- •9. Элементы iiа подгруппы
- •Работа №9. Свойства металлов iia подгруппы и их соединений
- •Опыт 1. Получение гидроксида бериллия и исследование его свойств.
- •Опыт 2. Гидролиз хлорида бериллия.
- •Контрольные вопросы и задания
- •10. Элементы vib подгруппы
- •Изменение характера оксидов и гидроксидов хрома
- •Работа № 8. Хром
- •Опыт 1. Получение оксида хрома (ш) разложением бихромата аммония
- •Опыт 2. Получение гидроксида хрома (III) и исследование его свойств
- •Опыт 3. Гидролиз солей хрома
- •Опыт 4. Окисление хрома (III) до хрома (VI)
- •Опыт 5. Хроматы и бихроматы
- •Опыт 6. Получение малорастворимых хроматов бария, свинца, серебра
- •Опыт 7. Окислительные свойства хрома (VI) в кислой среде
- •Опыт 8. Образование надхромовой кислоты h2CrO6
- •Опыт 9. Травление хромовых покрытий
- •Опыт 10. Пассивирование (оксидирование) хрома
- •Контрольные вопросы и задания
- •11. Элементы viib подгруппы
- •Работа № 11. Марганец
- •Опыт 1. Получение гидроксида марганца (II)
- •Опыт 4. Окислительно-восстановительные свойства манганатов (реакция диспропорционирования)
- •Опыт 5. Окислительные свойства перманганатов
- •Опыт 6. Влияние среды на окислительные свойства перманганата
- •Контрольные вопросы и задания
- •12. Элементы viiiв подгруппы
- •Работа 12. Железо. Кобальт. Никель
- •Опыт 1. Получение гидроксида железа (II) и исследование его свойств.
- •Опыт 2. Получение гидроксидов кобальта (II) и никеля (II) и исследование их свойств.
- •Опыт 3. Получение гидроксида железа (III) и исследование его свойств.
- •Опыт 4. Гидролиз солей железа (II) и (III).
- •Опыт 5. Получение малорастворимых сульфидов железа, кобальта, никеля.
- •Опыт 6. Восстановительные свойства соединений железа (II).
- •Опыт 7. Окислительные свойства соединений железа (III).
- •Опыт 8. Комплексные соединения железа, кобальта, никеля.
- •Контрольные вопросы и задания
- •Приложение. Таблицы физико-химических констант.
- •Константы нестойкости некоторых комплексных ионов
- •Растворимость некоторых солей и оснований в воде
- •Оглавление
Министерство образования Российской Федерации
Московский государственный институт электронной техники
(Технический университет)
Т.И. Хаханина, Н.Г. Никитина, В.И. Гребенькова, Шутова Р.Ф.
Лабораторный практикум по курсу
"Неорганическая химия"
Утверждено редакционно-издательским советом института
Москва 2007
УДК 546(076.1)
Хаханина Т.И., Никитина Н.Г., Гребенькова В.И., Шутова Р.Ф.
Лабораторный практикум по курсу "Неорганическая химия".-
М.: МИЭТ, 2007.
Приведены лабораторные работы по курсу "Неорганическая химия", дополненные примерами применения химических процессов как в микроэлектронике, так и для оценки экологической обстановки окружающей среды. Лабораторный практикум рекомендуется студентам факультета ЭТМО, специализирующихся в области «Инженерная защита окружающей среды», а также в области материалов и технологических процессов микроэлектроники.
Никитина Нина Георгиевна,
Гребенькова Валентина Иосифовна,
Хаханина Татьяна Ивановна,
Шутова Раиса Фроловна.
Лабораторный практикум по курсу
"Неорганическая химия"
©МИЭТ, 2007
Элементы viia подгруппы
Фтор,
хлор, бром, йод, астат составляют VПА
подгруппу, имеют конфигурацию внешнего
уровня ns2p5
Астат получают искусственным путем,
радиоактивен, период полураспада
![]() =
8,3 часа, поэтому он изучен недостаточно.
Фтор проявляет единственную степень
окисления — 1, остальные элементы могут
распаривать свои электроны в пустыеd-ячейки
и проявлять дополнительно степени
окисления +1, +3, +5, +7.
=
8,3 часа, поэтому он изучен недостаточно.
Фтор проявляет единственную степень
окисления — 1, остальные элементы могут
распаривать свои электроны в пустыеd-ячейки
и проявлять дополнительно степени
окисления +1, +3, +5, +7.
При обычных условиях молекулы галогенов двухатомны и существуют в виде Г2 (в отличие от элементов VIIB подгруппы).
Растворимость галогенов в различных растворителях может быть хорошей иллюстрацией правила "подобное растворяется в подобном". Неполярные молекулы галогенов плохо растворяются в воде и хорошо - в неполярных органических растворителях (бензоле, толуоле, СС1 и др.). Способность хорошо растворяться в органических растворителях используют для извлечения галогенов из водных растворов методом экстракции.
Химическая активность галогенов от фтора к йоду уменьшается. Так, фтор реагирует практически со всеми элементами при комнатной температуре (даже с золотом и платиной), для хлора некоторые реакций идут лишь при нагревании, для брома температура реакции должна быть еще выше, йод даже при сильном нагревании реагирует с ограниченным количеством элементов.
Взаимодействие наиболее активных фтора и хлора с простыми и сложными веществами может быть представлено схемой:
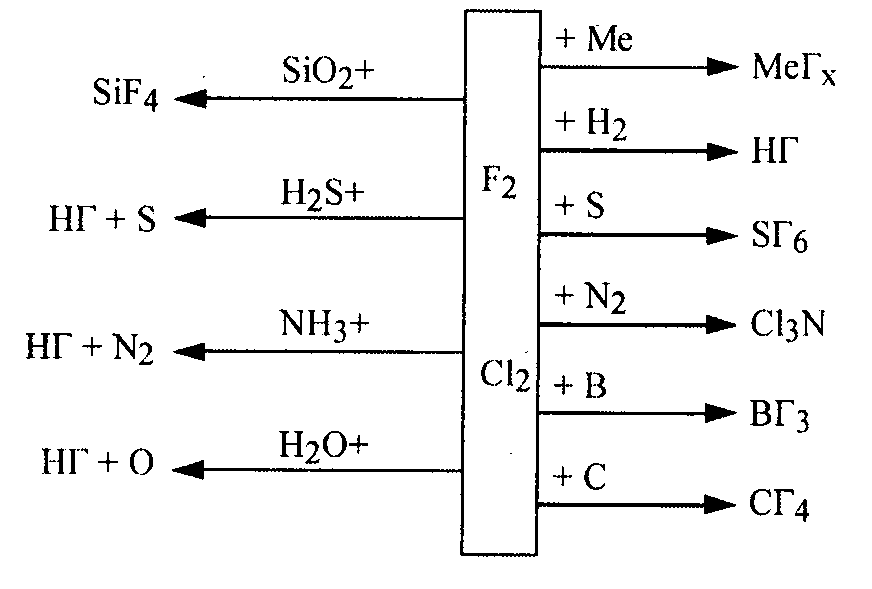
Галогены - хорошие окислители. Уменьшение окислительной способности от фтора к иоду видно из окислительных потенциалов:

Значением окислительных потенциалов и различным сродством к электрону объясняется вытеснение одних галогенов другими из их соединений:
|
F2 |
вытесняет |
Cl- |
Br- |
I- |
|
Cl2 |
вытесняет |
- |
Br- |
I- |
|
Br2 |
вытесняет |
- |
- |
I- |
|
I2 |
вытесняет |
- |
- |
- |
Например,
Cl2 + 2KI = I2 + 2КСl, но I2 + КСl ≠ (реакция не идет).
Для быстрого связывания галогенов применяют тиосульфат натрия Na2S2O3:
Na2S2O3 + Cl2 + Н2О = Na2SO4 + S+ 2НСl,
с йодом образуется тетратионат натрия Na2S4O6:
2 Na2S2O3 + I2 = Na2S4O6 + 2NaI.
Галогеноводороды НГ хорошо растворяются в воде, водные растворы - сильные кислоты (кроме HF). Степень диссоциации а для 0,1 н. растворов составляет:
|
НГ |
HF |
HCl |
HBr |
HI |
|
α, % |
8 |
92,6 |
93,5 |
95 |
Плавиковая кислота относится к кислотам средней силы, так как в водном растворе ионы водорода частично связаны в ионы HF2-, Но HF- прекрасный комплексообразующий реагент, он входит в состав многих травителей для металлов и полупроводников, стекла, кремния и др. Ион F не бывает восстановителем; ион СГ может быть восстановителем лишь в концентрированных растворах соляной кислоты (NaCl не является восстановителем), а от Br к Г восстановительная способность возрастает; KI - один из наиболее распространенных восстановителей.
В кислородных соединениях все галогены проявляют положительные степени окисления, кроме фтора. Так, хлор может проявлять положительные степени окисления +1, +3, +5, +7 (табл.l. 1).
Таблица 1.1
Кислородные соединения хлора
|
Степень окисления
|
Кислоты |
Соли |
|
+1 |
НСlO хлорноватистая |
Гипохлориты |
|
+3 |
НСlO2 хлористая |
Хлориты |
|
+5 |
НСlO3 хлорноватая |
Хлораты |
|
+7 |
НСlO4 хлорная |
Перхлораты |
Для брома и йода степень окисления +7 не характерна, для них наиболее устойчива степень окисления +5:
3I2+ 10HNO3 = 6НIO3 + 10NO+ 2Н2О
I2 + 5Сl2 + 6Н2О = 2НIO3 + 10НСl.
Многие соли кислородных кислот хлора обладают окислительно-восстановительной двойственностью, являются составными компонентами многих травителей полупроводников. Наибольшее применение находят гипохлориты и хлораты.
Гипохлориты получают взаимодействием хлора с холодными щелочами:

Двойственную природу гипохлоритов (С+1) можно представить схемой:
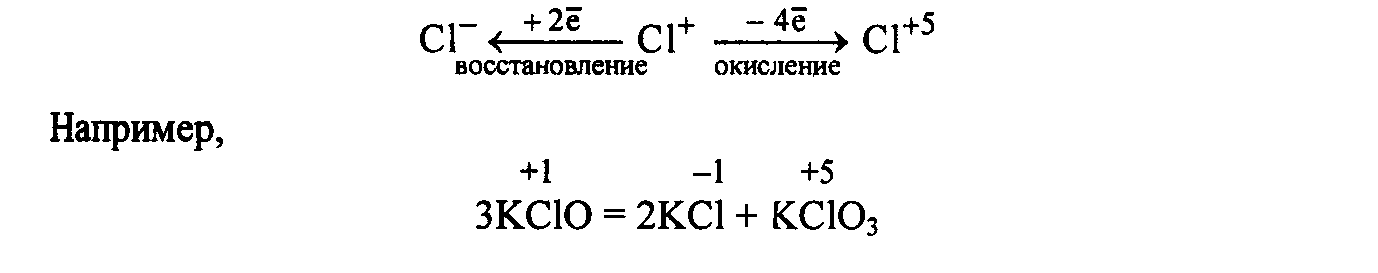
NaClO+ MnSO4+ Н2О = NaCl + МnО2 + Н2SO4
окислитель
3KClO + 4KMnO4+ 2Н2О = 3KClO3 + 4МnО2 + 4КОН
восстановитель
Хлораты получают пропусканием газообразного хлора в нагретые до 60 - 70ºС растворы щелочей:
ЗCl2 + 6KOH = КСIО3 + 5КСl + 3Н2О
Х лораты
менее сильные окислители, чем гипохлориты,
и тоже проявляют двойственность:
лораты
менее сильные окислители, чем гипохлориты,
и тоже проявляют двойственность:
Для них, как и для гипохлоритов, характерна реакция диспропорциони-рования:
4КСlО3 = 3КСlO4 + KCI
Реакция протекает при умеренном нагревании. При сильном нагревании образующийся перхлорат разлагается с выделением кислорода:
КСlO4
![]() КСl
+ 2O2
КСl
+ 2O2
Из кислородных соединений брома и йода наибольшее применение в качестве окислителей находят бромат и йодат калия. Они обладают меньшей окислительной способностью, чем хлораты:
КIО3+ 5КI+ 3Н2SO4 = 3I2+ 3К2SO4 + ЗН2О
Галогены и их соединения находят самое разнообразное применение.
Из фтора получают фторопроизводные углеводородов с уникальными свойствами, например, тефлон, обладающий исключительной стойкостью к различным химическим реагентам, фреоны - охлаждающие жидкости. Жидкий фтор используется как один из самых эффективных окислителей в ракетном топливе. Для этих же целей применяются перхлораты аммония и калия (NH4ClO4, КСlO4).
В микроэлектронике свободные галогены и их соединения находят широкое применение в качестве компонентов травителей полупроводников, в процессах фотолитографии (Сl2, Вг2, HF, НСl, HBr, HIO3, HClO, НСlO4 и др.).
Легколетучие соединения (PCl3, РСl5, ВСl3 и др.) используются в качестве диффузантов для получения полупроводников простого и сложного составов заданного типа проводимости.
