- •Введение Физика как наука. Содержание и структура физики
- •I Механика
- •1.1 Кинематика материальной точки
- •1.1.1 Понятие материальной точки. Система отсчета. Траектория, путь, перемещение Единицы измерения
- •1.1.2 Скорость и ускорение произвольно движущейся точки
- •1.1.3 Кинематика прямолинейного движения
- •1.1.4 Движение точки по окружности. Связь между линейными и угловыми кинематическими параметрами
- •1.1.5 Колебательное движение. Виды гармонических колебаний
- •1.1.6 Сложение гармонических колебаний
- •1.2 Динамика материальной точки
- •1.2.1 Законы Ньютона. Масса, сила. Закон сохранения импульса, реактивное движение
- •1.2.2 Силы в механике
- •1.2.3 Работа сил в механике, энергия. Закон сохранения энергии в механике
- •1.3 Динамика вращательного движения твердых тел
- •1.3.1 Момент силы, момент импульса. Закон сохранения момента импульса
- •1.3.2 Кинетическая энергия вращательного движения. Момент инерции
- •II Раздел молекулярная физика и термодинамика
- •2.1 Основные положения молекулярно-кинетической теории газов
- •2.1.1 Агрегатные состояния вещества и их признаки. Методы описания физических свойств вещества
- •2.1.2 Идеальный газ. Давление и температура газа. Шкала температур
- •2.1.3 Законы идеального газа
- •2.2 Распределение Максвелла и Больцмана
- •2.2.1 Скорости газовых молекул
- •2.3. Первое начало термодинамики
- •2.3.1 Работа и энергия в тепловых процессах. Первое начало термодинамики
- •2.3.2 Теплоемкость газа. Применение первого начала термодинамики к изопроцессам
- •2.4. Второе начало термодинамики
- •2.4.1. Работа тепловых машин. Цикл Карно
- •2.4.2 Второе начало термодинамики. Энтропия
- •2.5 Реальные газы
- •2.5.1 Уравнение Ван-дер-Ваальса. Изотермы реального газа
- •2.5.2 Внутренняя энергия реального газа. Эффект Джоуля—Томсона
- •III Электричество и магнетизм
- •3.1 Электростатика
- •3.1.1 Электрические заряды. Закон Кулона
- •3.1.2 Напряженность электрического поля. Поток линий вектора напряженности
- •3.1.3 Теорема Остроградского — Гаусса и его применение для расчета полей
- •3.1.4 Потенциал электростатического поля. Работа и энергия заряда в электрическом поле
- •3.2 Электрическое поле в диэлектриках
- •3.2.1 Электроемкость проводников, конденсаторы
- •3.2.2 Диэлектрики. Свободные и связанные заряды, поляризация
- •3.2.3 Вектор электростатической индукции. Сегнетоэлектрики
- •3.3 Энергия электростатического поля
- •3.3.1 Электрический ток. Законы Ома для постоянного тока
- •3.3.2 Разветвленные цепи. Правила Кирхгофа. Работа и мощность постоянного тока
- •3.4 Магнитное поле
- •3.4.1 Магнитное поле. Закон Ампера. Взаимодействие параллельных токов
- •3.4.2 Циркуляция вектора индукции магнитного поля. Закон полного тока.
- •3.4.3 Закон Био—Савара—Лапласа. Магнитное поле прямого тока
- •3.4.4 Сила Лоренца Движение заряженных частиц в электрических и магнитных полях
- •3.4.5 Определение удельного заряда электрона. Ускорители заряженных частиц
- •3.5 Магнитные свойства вещества
- •3.5.1 Магнетики. Магнитные свойства веществ
- •3.5.2 Постоянные магниты
- •3.6 Электромагнитная индукция
- •3.6.1 Явления электромагнитной индукции. Закон Фарадея. Токи Фуко
- •3.6.2 Ток смещения. Вихревое электрическое поле Уравнения Максвелла
- •3.6.3 Энергия магнитного поля токов
- •IV Оптика и основы ядерной физики
- •4.1. Фотометрия
- •4.1.1 Основные фотометрические понятия. Единицы измерений световых величин
- •4.1.2 Функция видности. Связь между светотехническими и энергетическими величинами
- •4.1.3 Методы измерения световых величин
- •4.2 Интерференция света
- •4.2.1 Способы наблюдения интерференции света
- •4.2.2 Интерференция света в тонких пленках
- •4.2.3 Интерференционные приборы, геометрические измерения
- •4.3 Дифракция света
- •4.3.1 Принцип Гюйгенса—Френеля. Метод зон Френеля. Зонная пластинка
- •4.3.2 Графическое вычисление результирующей амплитуды. Применение метода Френеля к простейшим дифракционным явлениям
- •4.3.3 Дифракция в параллельных лучах
- •4.3.4 Фазовые решетки
- •4.3.5 Дифракция рентгеновских лучей. Экспериментальные методы наблюдения дифракции рентгеновских лучей. Определение длины волны рентгеновских лучей
- •4.4 Основы кристаллооптики
- •4.4.1 Описание основных экспериментов. Двойное лучепреломление
- •4.4.2 Поляризация света. Закон Малюса
- •4.4.3 Оптические свойства одноосных кристаллов. Интерференция поляризованных лучей
- •4.5 Виды излучения
- •4.5.1 Основные законы теплового излучения. Абсолютно черное тело. Пирометрия
- •4.5.2 Источники света
- •4.6 Действие света
- •4.6.1 Фотоэлектрический эффект. Законы внешнего фотоэффекта
- •4.6.2 Эффект Комптона
- •4.6.3 Давление света. Опыты Лебедева
- •4.6.4 Фотохимическое действие света. Основные фотохимические законы. Основы фотографии
- •4.7 Развитие квантовых представлений об атоме
- •4.7.1 Опыты Резерфорда по рассеянию альфа-частиц. Планетарно-ядерная модель атома
- •4.7.2 Спектр атомов водорода. Постулаты Бора
- •4.7.3 Корпускулярно-волновой дуализм. Волны де Бройля
- •4.7.4 Волновая функция. Соотношение неопределенности Гейзенберга
- •4.8 Физика атомного ядра
- •4.8.1 Строение ядра. Энергия связи атомного ядра. Ядерные силы
- •4.8.2 Радиоактивность. Закон радиоактивного распада
- •4.8.3 Радиоактивные излучения
- •4.8.4 Правила смещения и радиоактивные ряды
- •4.8.5 Экспериментальные методы ядерной физики. Методы регистрации частиц
- •4.8.6 Физика элементарных частиц
- •4.8.7 Космические лучи. Мезоны и гипероны. Классификация элементарных частиц
- •Содержание
II Раздел молекулярная физика и термодинамика
2.1 Основные положения молекулярно-кинетической теории газов
2.1.1 Агрегатные состояния вещества и их признаки. Методы описания физических свойств вещества
Молекулярная физика — раздел физики, изучающий строение и свойства веществ, исходя из молекулярно-кинетических представлений, основывающихся на том, что все тела состоят из молекул, находящихся в непрерывном хаотическом движении. Вещество может находиться в твердом, жидком и газообразном состоянии. Эти физические состояния обычно называют агрегатными. Различие между ними проявляется внешне следующим образом. Газ занимает любой предоставленный ему объем. Жидкость сохраняет свой объем, но она весьма подвижна и всегда принимает форму сосуда, в котором находится. Твердое тело способно сохранять не только объем, но и форму. Вещество в твердом состоянии встречается преимущественно в виде кристаллов, которые замечательны своей геометрически правильной внешней формой. Но наиболее отличительным признаком кристаллов является их анизотропия, т. е. зависимость свойств от направления. Жидкости и газы, наоборот, изотропны, их свойства не зависят от направления в пространстве. При изменении температуры наряду с обычным плавным изменением характеристик вещества (плотности, удельного объема и т. п.) наблюдается их резкое, скачкообразное изменение при переходе вещества из одного агрегатного состояния в другое. Агрегатные превращения протекают при определенных значениях температуры и давления, определяющих точку превращения вещества. В справочниках она указывается обычно для нормального давления. Опыт показывает, что на превращение вещества затрачивается значительная энергия, называемая обычно скрытой теплотой превращения.
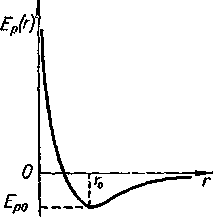
С молекулярной точки зрения вещества они различаются друг от друга той ролью, которую в них играют взаимодействие молекул и интенсивность их теплового движения. Силы взаимодействия между молекулами имеют электромагнитное происхождение. Зависимость потенциальной энергии взаимодействия двух молекул от расстояния между ними приведена на рисунке 2.1. Кривая потенциальной энергии взаимодействия для пары молекул имеет характерный вид: сначала идет, круто вниз в области действия сил отталкивания, затем загибается, образуя характерную яму, и медленно приближается к горизонтальной оси в области сил притяжения.
Потенциальная энергия взаимодействия молекул вместе с их кинетической энергией определяет внутреннюю энергию системы. Именно относительной ролью двух составляющих внутренней энергии системы — средней кинетической и средней потенциальной энергии взаимодействия молекул — определяется то или иное фазовое состояние или превращение вещества.
|
|
|
Рисунок - 2.1 |
Газообразное состояние вещества является примером существующего в природе полного, совершенного беспорядка во взаимном расположении молекул: каждая молекула находится в хаотическом движении, причем действие других молекул проявляется только при столкновениях. Силы притяжения между парами молекул очень быстро убывают с ростом расстояния между ними. Потенциальная энергия взаимодействия также быстро уменьшается по абсолютной величине до нуля. Поэтому притяжение молекул в газе не способно противодействовать тепловому движению молекул: кинетической энергии с избытком хватает, чтобы выйти за пределы действия сил притяжения. Таким образом, в газе средняя кинетическая энергия молекул больше абсолютного значения средней потенциальной энергии взаимодействия молекул. И чем сильнее выполняется это неравенство, тем лучше реальный газ моделирует свойства идеального газа.
Жидкость по своему строению существенно отличается от газа. Из-за большой тесноты молекулы в жидкости не могут перемещаться так свободно, как в газе. Они могут лишь очень медленно вместе со своими соседями перемещаться по объему, занятому жидкостью. Она характеризуется, по сути дела, порядком в малой области, охватывающей лишь самых ближайших соседей. Этот порядок, называемый обычно ближним, из-за теплового движения беспрерывно нарушается и снова из-за притяжения молекул восстанавливается. Таким образом, в жидкостях силы притяжения удерживают молекулы в ограниченной области, но они не в состоянии противостоять разупорядочивающему действию их теплового движения. В жидкостях средняя кинетическая энергия молекул меньше абсолютного значения средней потенциальной энергии и внутренняя энергия в целом отрицательна, хотя ее значение незначительно отличается от нуля.
В твердом веществе средняя кинетическая энергия оказывается во много раз меньше абсолютного значения потенциальной энергии взаимодействия. Поэтому внутренняя энергия твердых тел определяется практически взаимодействием молекул и зависит от их расположения. Молекулы находятся на своих местах, перемещение их по объему кристалла исключено: они совершают лишь непрерывные колебания около положений равновесия. Внутренняя энергия вещества в твердой фазе для температуры, при которой могут существовать одновременно и другие фазы, имеет наименьшее значение, а в газообразной фазе — наибольшее значение.
В газах, жидкостях и твердых телах различаются и характер движения молекул. В разреженных газах молекулы удалены друг от друга настолько, что силы взаимодействия между ними практически отсутствуют. Молекулы газов движутся от столкновения до столкновения со стенками сосуда или между собой равномерно и прямолинейно. Это движение хаотично, т. е., в среднем, в каждом направлении в любой момент времени движется одинаковое число молекул. В твердых кристаллических телах силы взаимодействия между частицами очень велики и поэтому молекулы не могут удалиться друг от друга на очень большие расстояния. В результате совместного влияния сил притяжения и отталкивания частицы твердых тел (молекулы, атомы или ионы) совершают колебания около некоторых средних положений, называемых узлами кристаллической решетки.
Наиболее сложно молекулярное движение в жидкостях. В нем наблюдаются черты, присущие тепловому движению частиц, как в газах, так и твердых телах. Каждая молекула в течение некоторого промежутка времени колеблется около определенного положения равновесия, которое само время от времени смещается на расстояние, соизмеримое с размерами молекул. В результате молекулы внутри жидкости колеблются и медленно перемещаются.
Молекулярная физика и термодинамика — разделы физики, в которых изучаются макроскопические процессы в телах, связанные с огромным числом содержащихся в телах атомов и молекул. Для исследования этих процессов применяют два качественно различных и взаимно дополняющих друг друга метода: статистический (молекулярно-кинетический) и термодинамический. Первый лежит в основе молекулярной физики, второй — термодинамики.
Статистический метод основан на законах теории вероятностей и математической статистики. Дело в том, что в совокупном движении огромного числа частиц, координаты и скорости которых в любой момент времени случайны, проявляются определенные (статистические) закономерности.
Термодинамический метод состоит в изучении физических свойств макроскопических систем путем анализа условий и количественных соотношений для процессов превращения энергии в рассматриваемых системах. Термодинамика базируется на двух экспериментально установленных законах — первом и втором законах (началах) термодинамики, а также на принципе Нернста или третьем законе (начале) термодинамики, применение которого необходимо для решения сравнительно ограниченного числа задач. С помощью законов термодинамики можно получить многие сведения о физических свойствах тел в различных условиях, не пользуясь при этом какими-либо конкретными представлениями о внутреннем строении исследуемых тел и характере движения образующих их частиц. Рассматриваемую макроскопическую систему в термодинамике называют термодинамической системой. В общем случае тела, образующие систему, могут обмениваться энергией, как между собой, так и с внешними телами (внешней средой).
Область применения термодинамики значительно шире, чем молекулярно-кинетической теории, ибо нет таких областей физики и химии, в которых нельзя было бы пользоваться термодинамическим методом. Однако, с другой стороны, термодинамический метод несколько ограничен: термодинамика ничего не говорит о микроскопическом строении вещества, о механизме явлений, а лишь устанавливает связи между макроскопическими свойствами вещества. Молекулярно-кинетическая теория и термодинамика взаимно дополняют друг друга, образуя единое целое, но отличаясь различными методами исследования.
Термодинамика имеет дело с термодинамической системой — совокупностью макроскопических тел, которые взаимодействуют и обмениваются энергией, как между собой, так и с другими телами (внешней средой). Задача термодинамического метода — определение состояния термодинамической системы. Состояние системы задается термодинамическими параметрами (параметрами состояния) — совокупностью физических величин, характеризующих свойства термодинамической системы. Обычно в качестве параметров состояния выбирают температуру, давление и удельный объем.
Параметры состояния системы могут изменяться. Любое изменение в термодинамической системе, связанное с изменением хотя бы одного из ее термодинамических параметров, называется термодинамическим процессом. Макроскопическая система находится в термодинамическом равновесии, если ее состояние с течением времени не меняется.
Молекулярная физика изучает физические свойства макроскопических систем. Примером таких систем могут служить газы, жидкости, твердые тела, плазма. Все эти столь разнородные по своим физическим свойствам объекты обладают одним общим признаком, позволяющим изучать их с единой точки зрения — они содержат огромное число (≈1026 м-3) микроскопических объектов: молекул, атомов или электронов. Благодаря взаимодействию между частицами вещества энергия беспорядочного движения может передаваться от одного тела к другому. Для описания такого процесса передачи энергии — теплопередачи — вводится величина, имеющая большое значение в термодинамике,— температура. Понятие температуры основано на обобщении множества наблюдений и экспериментов, связанных с тепловыми свойствами тел.
Статистический и термодинамический метод взаимно дополняют друг друга при изучений физических явлений. Статистический метод опирается на конкретную модель внутреннего строения вещества и ставит своей задачей вывести свойства сложных систем, исходя из этой модели. Если термодинамический метод обладает большей общностью, формальной простотой, то статистический метод позволяет вскрыть причины явлений, обосновать законы термодинамики, рассчитать некоторые коэффициенты и ответить на такие вопросы, даже постановка которых в рамках термодинамики не имеет смысла. Проникновение статистических представлений в термодинамику привело к развитию статистической термодинамики, наиболее полно описывающей свойства макросистем, таких, как идеальный и реальный газы, жидкости, твердые тела.
Связи и отношения в молекулярной физике и термодинамике удается выразить с помощью следующих основных понятий.
Размеры и масса молекул. Размер молекулы является величиной условной. В настоящее время существует много методов определения размеров и масс молекул. С их помощью установлено, что за исключением молекул органических веществ, содержащих очень; большое число атомов, большинство молекул по порядку величины имеют диаметр 1•10-10 м и массу 1•10-26 кг.
Относительная молекулярная масса. Поскольку массы атомов и молекул чрезвычайно малы, при расчетах обычно используют не абсолютные, а относительные значения масс, получаемые путем сравнения масс атомов и молекул с атомной единицей массы, в качестве которой выбрана 1/12 часть массы атома углерода:
|
М = тм/ l/12 тс |
(2.1). |
Относительная молекулярная (атомная) масса является величиной, не имеющей размерности.
Относительная атомная масса каждого химического элемента указана в таблице Менделеева. Значения этих масс отличаются от целых чисел. Например, у водорода относительная атомная масса равна 1,00797, у гелия — 4,0026 и т.д. Объясняется это; существованием изотопов химических элементов. Значения относительных атомных масс, приведенных в таблице Менделеева, при расчетах округляют до ближайшего целого числа, т. е. считают, что, например, относительная атомная масса водорода равна 1, гелия — 4 и т. д.
Количество вещества, его единица. Количество вещества, содержащегося в теле, определяется числом молекул в этом теле (или числом атомов). Поскольку число молекул в макроскопических телах очень велико, для определения количества вещества в теле сравнивают число молекул в этом теле с числом атомов в 0,012 кг углерода. Иными словами, количеством вещества ν называют величину, равную отношению числа молекул (или атомов) N в данном теле к числу атомов NA в 0,012 кг углерода, т. е.
|
ν =N/NA |
(2.2). |
Количество вещества, содержащее число граммов, равное его молекулярному весу, называется грамм-молекулой или молем. Количество вещества выражают в молях. Моль равен количеству вещества системы, содержащей столько же структурных элементов (атомов, молекул, ионов), сколько содержится атомов в углероде-12 массой 0,012 кг.
Постоянная Авогадро. Молярная масса. Согласно определению понятия моль, в 1 моль любого вещества содержится одинаковое число молекул или атомов. Это число NA, равное числу атомов в 0,012 кг (т. е. в 1 моль) углерода, называют постоянной Авогадро.
Молярной массой μ какого-либо вещества называют массу 1 моль этого вещества. Очевидно, что
|
μ = mм/ NA. |
(2.3). |
Молярную массу вещества выражают в кг/моль.
Выше отмечалось, что атомная единица массы (а.е.м.) равна 1/12 массы атома углерода, т. е. 1 а.е.м = 1/12 mc. Отсюда находим, что 1 а.е.м. — 1,66-10-27 кг. Найдем связь между молярной массой μ и относительной молекулярной массой μг.. Следовательно, μ = 1*10-3 μг. Зная химическую формулу вещества, можно с помощью таблицы Менделеева установить его относительную молекулярную массу, а затем по формуле найти молярную массу этого вещества. Если тело состоит из N молекул массой mм каждая, то масса этого тела
|
m = mм N |
(2.4). |
Почленно разделив полученное соотношение на μ = mм/ NA. , получим
|
m/μ = N/NA |
(2.5), |
|
ν = m/μ |
(2.6). |
С учетом всех полученных соотношений имеем для расчетов формулу:
|
N = m/μ NA |
(2.7). |
Эта формула определяет число молекул N, содержащуюся в массе m вещества с молярной массой μ. Моль любого газа при данных давлении и температуре занимает одинаковый объем. Число молекул, содержащихся в 1м3 при нормальных условиях (Т =273,15 К, давлении p0 =105 Па), называется числом Лошмидта: Nl = p0/ kT = 2,68*10 25 м -3.
Рассмотрим некоторые явления, экспериментально подтверждающие основные положения и выводы молекулярно-кинетической теории.
Броуновское движение. Шотландский ботаник Р. Броун (1773—1858), наблюдая под микроскопом взвесь цветочной пыльцы в воде, обнаружил, что частицы пыльцы оживленно и беспорядочно двигались, то вращаясь, то перемещаясь с места на место, подобно пылинкам в солнечном луче. Впоследствии оказалось, что подобное сложное зигзагообразное движение характерно для любых частиц малых размеров (≈1мкм), взвешенных в газе или жидкости. Интенсивность этого движения, называемого броуновским, повышается с ростом температуры среды, с уменьшением вязкости и размеров частиц (независимо от их химической природы). Причина броуновского движения долго оставалась неясной. Лишь через 80 лет после обнаружения этого эффекта ему было дано объяснение: броуновское движение взвешенных частиц вызывается ударами молекул среды, в которой частицы взвешены. Так как молекулы движутся хаотически, то броуновские частицы получают толчки с разных сторон, поэтому и совершают движение столь причудливой формы. Таким образом, броуновское движение является подтверждением выводов молекулярно-кинетической теории о хаотическом тепловом движении атомов и молекул.
Опыт Штерна. Первое экспериментальное определение скоростей молекул выполнено немецким физиком О. Штерном (1888—1970). Его опыты позволили также оценить распределение молекул по скоростям. Схема установки Штерна представлена на рисунке - 2.3. Вдоль оси внутреннего цилиндра с щелью натянута платиновая проволока, покрытая слоем серебра, которая нагревается током при откачанном воздухе. При нагревании серебро испаряется. Атомы серебра, вылетая через щель, попадают на внутреннюю поверхность второго цилиндра, давая изображение щели О. Если прибор привести во вращение вокруг общей оси цилиндров, то атомы серебра осядут не против щели, а сместятся от точки О на некоторое расстояние s. Изображение щели получается размытым. Исследуя толщину осажденного слоя, можно оценить распределение молекул по скоростям, которое соответствует максвелловскому распределению.
Зная радиусы цилиндров, их угловую скорость вращения, а также измеряя s, можно вычислить скорость движения атомов серебра при данной температуре проволоки. Результаты опыта показали, что средняя скорость атомов серебра близка к той, которая следует из максвелловского распределения молекул по скоростям.
Опыт Ламмерта. Этот опыт позволяет более точно определить закон распределения молекул по скоростям. Схема вакуумной установки приведена на рисунке - 2.3. Молекулярный пучок, сформированный источником, проходя через щель, попадает в приемник. Между источником и приемником помещают два диска с прорезями, закрепленных на общей оси. При неподвижных дисках молекулы достигают приемника, проходя через прорези в обоих дисках. Если ось привести во вращение, то приемника достигнут только те прошедшие прорезь в первом диске молекулы, которые затрачивают для пробега между дисками время, равное или кратное времени оборота диска. Другие же молекулы задерживаются вторым диском. Меняя угловую скорость вращения дисков и измеряя число молекул, попадающих в приемник, можно выявить закон распределения скоростей молекул. Этот опыт также подтвердил справедливость максвелловского распределения молекул по скоростям.
|
|
|
|
Рисунок - 2.2 |
Рисунок - 2.3 |
Опытное определение постоянной Авогадро. Воспользовавшись идеей распределения молекул по высоте, французский ученый Ж. Перрен (1870—1942) экспериментально определил постоянную Авогадро. Исследуя под микроскопом броуновское движение, он убедился, что броуновские частицы распределяются по высоте подобно молекулам газа в поле тяготения. Применив к ним больцмановское распределение, можно записать n = n0e – (m-m1)gh/kT, где т — масса частицы, т1 — масса вытесненной ею жидкости: m = 4/з πr3ρ, m1 = 4/з πr3ρ1, (r—радиус частицы, ρ — плотность частицы, ρ1— плотность жидкости). Если n1 и п2 — концентрации частиц на уровнях h1 и h2, a k = R/NA, то NA = [3RT*ln(n1/ п2)]/[4πr3(ρ-ρ1)g(h2-h1)]. Значение NA, получаемое из работ Ж. Перрена, соответствовало значениям, полученным в других опытах, что подтвердило применимость к броуновским частицам распределения Больцмана.