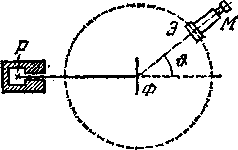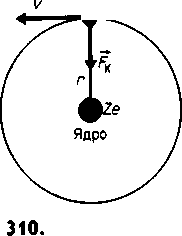- •Введение Физика как наука. Содержание и структура физики
- •I Механика
- •1.1 Кинематика материальной точки
- •1.1.1 Понятие материальной точки. Система отсчета. Траектория, путь, перемещение Единицы измерения
- •1.1.2 Скорость и ускорение произвольно движущейся точки
- •1.1.3 Кинематика прямолинейного движения
- •1.1.4 Движение точки по окружности. Связь между линейными и угловыми кинематическими параметрами
- •1.1.5 Колебательное движение. Виды гармонических колебаний
- •1.1.6 Сложение гармонических колебаний
- •1.2 Динамика материальной точки
- •1.2.1 Законы Ньютона. Масса, сила. Закон сохранения импульса, реактивное движение
- •1.2.2 Силы в механике
- •1.2.3 Работа сил в механике, энергия. Закон сохранения энергии в механике
- •1.3 Динамика вращательного движения твердых тел
- •1.3.1 Момент силы, момент импульса. Закон сохранения момента импульса
- •1.3.2 Кинетическая энергия вращательного движения. Момент инерции
- •II Раздел молекулярная физика и термодинамика
- •2.1 Основные положения молекулярно-кинетической теории газов
- •2.1.1 Агрегатные состояния вещества и их признаки. Методы описания физических свойств вещества
- •2.1.2 Идеальный газ. Давление и температура газа. Шкала температур
- •2.1.3 Законы идеального газа
- •2.2 Распределение Максвелла и Больцмана
- •2.2.1 Скорости газовых молекул
- •2.3. Первое начало термодинамики
- •2.3.1 Работа и энергия в тепловых процессах. Первое начало термодинамики
- •2.3.2 Теплоемкость газа. Применение первого начала термодинамики к изопроцессам
- •2.4. Второе начало термодинамики
- •2.4.1. Работа тепловых машин. Цикл Карно
- •2.4.2 Второе начало термодинамики. Энтропия
- •2.5 Реальные газы
- •2.5.1 Уравнение Ван-дер-Ваальса. Изотермы реального газа
- •2.5.2 Внутренняя энергия реального газа. Эффект Джоуля—Томсона
- •III Электричество и магнетизм
- •3.1 Электростатика
- •3.1.1 Электрические заряды. Закон Кулона
- •3.1.2 Напряженность электрического поля. Поток линий вектора напряженности
- •3.1.3 Теорема Остроградского — Гаусса и его применение для расчета полей
- •3.1.4 Потенциал электростатического поля. Работа и энергия заряда в электрическом поле
- •3.2 Электрическое поле в диэлектриках
- •3.2.1 Электроемкость проводников, конденсаторы
- •3.2.2 Диэлектрики. Свободные и связанные заряды, поляризация
- •3.2.3 Вектор электростатической индукции. Сегнетоэлектрики
- •3.3 Энергия электростатического поля
- •3.3.1 Электрический ток. Законы Ома для постоянного тока
- •3.3.2 Разветвленные цепи. Правила Кирхгофа. Работа и мощность постоянного тока
- •3.4 Магнитное поле
- •3.4.1 Магнитное поле. Закон Ампера. Взаимодействие параллельных токов
- •3.4.2 Циркуляция вектора индукции магнитного поля. Закон полного тока.
- •3.4.3 Закон Био—Савара—Лапласа. Магнитное поле прямого тока
- •3.4.4 Сила Лоренца Движение заряженных частиц в электрических и магнитных полях
- •3.4.5 Определение удельного заряда электрона. Ускорители заряженных частиц
- •3.5 Магнитные свойства вещества
- •3.5.1 Магнетики. Магнитные свойства веществ
- •3.5.2 Постоянные магниты
- •3.6 Электромагнитная индукция
- •3.6.1 Явления электромагнитной индукции. Закон Фарадея. Токи Фуко
- •3.6.2 Ток смещения. Вихревое электрическое поле Уравнения Максвелла
- •3.6.3 Энергия магнитного поля токов
- •IV Оптика и основы ядерной физики
- •4.1. Фотометрия
- •4.1.1 Основные фотометрические понятия. Единицы измерений световых величин
- •4.1.2 Функция видности. Связь между светотехническими и энергетическими величинами
- •4.1.3 Методы измерения световых величин
- •4.2 Интерференция света
- •4.2.1 Способы наблюдения интерференции света
- •4.2.2 Интерференция света в тонких пленках
- •4.2.3 Интерференционные приборы, геометрические измерения
- •4.3 Дифракция света
- •4.3.1 Принцип Гюйгенса—Френеля. Метод зон Френеля. Зонная пластинка
- •4.3.2 Графическое вычисление результирующей амплитуды. Применение метода Френеля к простейшим дифракционным явлениям
- •4.3.3 Дифракция в параллельных лучах
- •4.3.4 Фазовые решетки
- •4.3.5 Дифракция рентгеновских лучей. Экспериментальные методы наблюдения дифракции рентгеновских лучей. Определение длины волны рентгеновских лучей
- •4.4 Основы кристаллооптики
- •4.4.1 Описание основных экспериментов. Двойное лучепреломление
- •4.4.2 Поляризация света. Закон Малюса
- •4.4.3 Оптические свойства одноосных кристаллов. Интерференция поляризованных лучей
- •4.5 Виды излучения
- •4.5.1 Основные законы теплового излучения. Абсолютно черное тело. Пирометрия
- •4.5.2 Источники света
- •4.6 Действие света
- •4.6.1 Фотоэлектрический эффект. Законы внешнего фотоэффекта
- •4.6.2 Эффект Комптона
- •4.6.3 Давление света. Опыты Лебедева
- •4.6.4 Фотохимическое действие света. Основные фотохимические законы. Основы фотографии
- •4.7 Развитие квантовых представлений об атоме
- •4.7.1 Опыты Резерфорда по рассеянию альфа-частиц. Планетарно-ядерная модель атома
- •4.7.2 Спектр атомов водорода. Постулаты Бора
- •4.7.3 Корпускулярно-волновой дуализм. Волны де Бройля
- •4.7.4 Волновая функция. Соотношение неопределенности Гейзенберга
- •4.8 Физика атомного ядра
- •4.8.1 Строение ядра. Энергия связи атомного ядра. Ядерные силы
- •4.8.2 Радиоактивность. Закон радиоактивного распада
- •4.8.3 Радиоактивные излучения
- •4.8.4 Правила смещения и радиоактивные ряды
- •4.8.5 Экспериментальные методы ядерной физики. Методы регистрации частиц
- •4.8.6 Физика элементарных частиц
- •4.8.7 Космические лучи. Мезоны и гипероны. Классификация элементарных частиц
- •Содержание
4.7 Развитие квантовых представлений об атоме
4.7.1 Опыты Резерфорда по рассеянию альфа-частиц. Планетарно-ядерная модель атома
В первой четверти 20-го века было установлено, что атом состоит из положительно заряженного ядра и окружающей его электронной оболочки. Линейные размеры ядра порядка 10-13— 10-12 см. Размеры самого атома, определяемые электронной оболочкой, примерно в 105 раз больше. Однако почти вся масса атома (не менее 99,95 %) сосредоточена в ядре. Это связано с тем, что ядро состоит из «тяжелых» протонов и нейтронов, а электронная оболочка — из одних только «легких» электронов (mp = 1836,15me, mn = 1838,68me). Число электронов в оболочке нейтрального атома равно заряду ядра, если за единицу принять элементарный заряд (т. е. заряд электрона по абсолютной величине). Но электронная оболочка может терять или приобретать электроны. Тогда атом становится электрически заряженным, т. е. превращается в ион.
Химические свойства атома определяются электронной оболочкой, точнее, её наружными электронами. Они сравнительно слабо связаны с атомом и более подвержены любым воздействиям. Напротив, протоны и нейтроны прочно связаны внутри ядра. Чтобы воздействовать на ядро, нужны силы, в миллионы раз превосходящие те силы, которые достаточны для отрыва наружных электронов атома. Экспериментальное доказательство этой модели атома было дано Резерфордом в 1911 г. Под руководством Резерфорда опыт осуществлялся следующим образом (рисунок - 4.66).
Выделяемый отверстием узкий пучок α-частиц, испускаемых радиоактивным веществом Р, падал на тонкую металлическую фольгу Ф. При прохождении через фольгу α -частицы отклонялись от первоначального направления движения на различные углы θ. Микроскоп М и экран Э можно было вращать вокруг оси, проходящей через центр рассеивающей фольги, и устанавливать таким образом под любым углом θ. Весь прибор помещался в откачанный кожух, чтобы устранить рассеяние α-частиц за счет столкновений с молекулами воздуха. При ударе о флуоресцирующий экран из сернистого цинка α-частица оставляла на нем вспышку (сцинтилляцию). И экспериментаторы производили подсчет таких сцинтилляций. В эксперименте подавляющее число α-частиц рассеивалось на небольшие углы порядка 1—3°. Однако наблюдались также отдельные α-частицы, отклоняющиеся на очень большие углы,
|
|
|
Рисунок - 4.66 |
доходившие до 150°. Относительное число таких частиц было ничтожно мало. Например, при прохождении через платиновую фольгу пучка α-частиц от RaC из 8000 падающих частиц в среднем только одна частица отклонялась на угол, превышавший 90°. Но и этого было бы слишком много, если бы большие отклонения возникали в результате накопления множества случайных отклонений.
Резерфорд сделал вывод, что каждое большое отклонение появляется в результате единичного акта взаимодействия какого-то, практически точечного, силового центра с близко пролетающей положительно заряженной α-частицей. Таким силовым центром и является положительно заряженное ядро атома. Резерфорд предположил, что электроны в атоме движутся вокруг ядра по круговым и эллиптическим орбитам, как планеты округ Солнца, т.е. предложил планетарно-ядерную модель строения тома. Схема этой модели (на примере атома водорода) изображена на рисунке - 4.67. Электрон удерживается на орбите кулоновской силой FK притяжения к ядру, которая обеспечивает центростремительное ускорение. Согласно такой планетарной (ядерной) модели, весь положительный заряд атома и почти вся его масса сосредоточены в атомном ядре. Вокруг ядра с большой скоростью движутся электроны, образуя электронную оболочку атома.
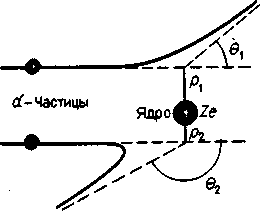
Поскольку α-частицы взаимодействуют с атомным ядром кулоновской силой, угол θ - рассеяния α-частиц зависит и от заряда ядро Ze, и от расстояния р (взятого по перпендикуляру) от ядра до первоначальной траектории α-частицы (рисунок - 4.68). Это
|
|
|
|
Рисунок - 4.67 |
Рисунок - 4.68 |
расстояние Резерфорд назвал прицельным. Исходя из того, что прицельное расстояние может принимать любые значения, Резерфорд, используя методы математической статистики (теории вероятности), вывел формулу, описывающую распределение частиц по углу рассеяния θ (формула Резерфорда):
|
Nθ = N0nd(Ze2/mαvα2)2 1/ sin4(θ/2) |
(4.78), |
где Nθ — число α-частиц, рассеянных на угол θ в пределах единичного телесного угла; N0 — число α-частиц, падающих на поверхность единичной площади, перпендикулярную первоначальному
направлению их движения; n — концентрация атомов вещества фольги; d — толщина фольги; mа и va — масса и скорость частицы.
В 1913 г. сотрудники Резерфорда произвели проверку этой формулы путем подсчета сцинтилляций, наблюдавшихся под разными углами θ за одинаковые промежутки времени и доказали ее совпадаемость с теоретическими данными.
В основе теории периодичности свойств атомов элементов лежат два принципа:
1) принцип Паули, который гласит: в атоме (или в какой-либо другой квантовой системе) не может быть двух электронов, обладающих одинаковой совокупностью квантовых чисел. Иными словами, в одном и том же состоянии не могут находиться одновременно два электрона, они должны отличаться хотя бы по одному из четырех показателей, описывающих его состояние. Принцип Паули дает объяснение периодической повторяемости свойств атомов;
2) принцип минимума энергии: при данном числе электронов в атоме осуществляется состояние с минимальной энергией.
Принцип минимума энергии является естественным требованием с точки зрения устойчивости атома: если данное состояние не является состоянием минимальной энергии, то атом может под влиянием лишь внутренних причин перейти в состояние с меньшей энергией и в конце концов должно осуществиться состояние с минимальной энергией. Принцип Паули учитывает квантовые свойства возможных состояний атома.
Все количество электронов в атоме закономерно распределяется в соответствии с ядерно-планетарной моделью атомов по оболочкам, с учетом выделенных принципов. Схема заполнения строится по принципу, когда, каждый вновь присоединяющийся электрон связывается в состояния в пределах, допускающих принципом Паули значениями. Когда заполнение оболочки закончено, образуется устойчивая электронная конфигурация, соответствующая электронной конфигурации данного элемента. После этого начинает заполняться следующая оболочка, атома следующего элемента. Процесс происходит следующим образом.
Состояние электрона в кулоновском поле ядра характеризуется четырьмя квантовыми числами:
1) главным квантовым числом: n=1, 2, 3, ;
2) орбитальным квантовым числом: l = 0, 1, 2, n-1;
3) магнитным квантовым числом: ml = -l, -l+1, l-1, l (всего 2l +1 значений);
4) спином: ms =+½,-½.
Совокупность электронов, обладающих одним и тем же главным квантовым числом (n), образует оболочку атома (таблица - 4.2). Различные оболочки атома обозначаются большими буквами К, L, М, N, О и т. д. по схеме указанной в таблице- 4.2.
Таблица - 4.2 Схема распределения электронов по оболочкам атома
|
Главное квантовое число, n |
1 |
2 |
3 |
4 |
5 |
|
Обозначение оболочки |
К |
L |
М |
N |
О |
Состояния орбитального движения электронов характеризуются буквами s, p, d, f и т. д. по схеме, указанной в таблице – 4.3.
Совокупность электронов с одним и тем же значением l образуют подоболочку.
Таблица – 4.3 Схема распределения электронов по подоболочкам атома
|
Орбитальное квантовое число, l |
0 |
1 |
2 |
3 |
4 |
|
Обозначение орбитального состояния |
s |
р |
d |
/ |
g |
Число электронов, которое может находиться на той или иной оболочке с учетом принципа Паули при данных п и l равно 2 (2l + 1). Главное квантовое число п определяет энергию электронов в атоме , которая увеличивается с увеличением п. Минимальной энергией обладают электроны на К-оболочке (п =1), затем на L-оболочке (п = 2) и т. д. Это означает, что оболочки К, L, М, должны заполняться последовательно, начиная с К. Однако, необходимо выяснить в какой последовательности заполняются состояния s, p, d, f . и т. д. в пределах каждой оболочки. Учет того факта, что при взаимодействии между электронами их энергия увеличивается с увеличением I (при данном п), при построении идеальной схемы принимается, что заполнение оболочки начинается с lmin = 0 и заканчивается lmах = п - 1. При данном l, ml принимает (2l +1) значений, а при каждом ml величина ms принимает два значения. При данном значении п величина l принимает п значений от 0 до п -1. Таким образом, максимальное число электронов, которые могут находиться в состоянии, соответствующее главному квантовому числу п,, можно рассчитать по формуле
|
|
(4.79), |
т. е. на данной оболочке может находиться не больше 2n2 электронов.
Химические и физические свойства элементов определяются внешними (валентными) электронами. Поскольку при заполнении очередной оболочки повторяется порядок заполнения предыдущей оболочки, это означает, что химические свойства элементов от оболочки к оболочке меняются периодически: заполнение каждой оболочки начинается со щелочного металла и заканчивается благородным газом. Поэтому можно сказать, что элементы, образующиеся при заполнении оболочки, составляют период системы Менделеева. Число элементов в последовательных периодах идеальной схемы заполнения оболочек должно быть по расчету 2, 8, 18, 32, 50. В действительности, в реальной периодической системе Менделеева число элементов в последовательных периодах равно 2, 8, 8, 18, 18, 32. Таким образом, построение периодической системы элементов существенно отличается от идеальной схемы заполнения оболочек. Причина различия между реальной и идеальной схемами заполнения оболочек состоит в том, что предпосылки, при которых была построена идеальная схема, для большинства элементов не соблюдаются. Взаимодействием электронов между собой и отклонением законов ядерного взаимодействия от кулоновского типа пренебрегать нельзя. Более полный учет взаимодействия электронов позволяет полностью объяснить периодическую повторяемость свойств атомов.