- •Введение Физика как наука. Содержание и структура физики
- •I Механика
- •1.1 Кинематика материальной точки
- •1.1.1 Понятие материальной точки. Система отсчета. Траектория, путь, перемещение Единицы измерения
- •1.1.2 Скорость и ускорение произвольно движущейся точки
- •1.1.3 Кинематика прямолинейного движения
- •1.1.4 Движение точки по окружности. Связь между линейными и угловыми кинематическими параметрами
- •1.1.5 Колебательное движение. Виды гармонических колебаний
- •1.1.6 Сложение гармонических колебаний
- •1.2 Динамика материальной точки
- •1.2.1 Законы Ньютона. Масса, сила. Закон сохранения импульса, реактивное движение
- •1.2.2 Силы в механике
- •1.2.3 Работа сил в механике, энергия. Закон сохранения энергии в механике
- •1.3 Динамика вращательного движения твердых тел
- •1.3.1 Момент силы, момент импульса. Закон сохранения момента импульса
- •1.3.2 Кинетическая энергия вращательного движения. Момент инерции
- •II Раздел молекулярная физика и термодинамика
- •2.1 Основные положения молекулярно-кинетической теории газов
- •2.1.1 Агрегатные состояния вещества и их признаки. Методы описания физических свойств вещества
- •2.1.2 Идеальный газ. Давление и температура газа. Шкала температур
- •2.1.3 Законы идеального газа
- •2.2 Распределение Максвелла и Больцмана
- •2.2.1 Скорости газовых молекул
- •2.3. Первое начало термодинамики
- •2.3.1 Работа и энергия в тепловых процессах. Первое начало термодинамики
- •2.3.2 Теплоемкость газа. Применение первого начала термодинамики к изопроцессам
- •2.4. Второе начало термодинамики
- •2.4.1. Работа тепловых машин. Цикл Карно
- •2.4.2 Второе начало термодинамики. Энтропия
- •2.5 Реальные газы
- •2.5.1 Уравнение Ван-дер-Ваальса. Изотермы реального газа
- •2.5.2 Внутренняя энергия реального газа. Эффект Джоуля—Томсона
- •III Электричество и магнетизм
- •3.1 Электростатика
- •3.1.1 Электрические заряды. Закон Кулона
- •3.1.2 Напряженность электрического поля. Поток линий вектора напряженности
- •3.1.3 Теорема Остроградского — Гаусса и его применение для расчета полей
- •3.1.4 Потенциал электростатического поля. Работа и энергия заряда в электрическом поле
- •3.2 Электрическое поле в диэлектриках
- •3.2.1 Электроемкость проводников, конденсаторы
- •3.2.2 Диэлектрики. Свободные и связанные заряды, поляризация
- •3.2.3 Вектор электростатической индукции. Сегнетоэлектрики
- •3.3 Энергия электростатического поля
- •3.3.1 Электрический ток. Законы Ома для постоянного тока
- •3.3.2 Разветвленные цепи. Правила Кирхгофа. Работа и мощность постоянного тока
- •3.4 Магнитное поле
- •3.4.1 Магнитное поле. Закон Ампера. Взаимодействие параллельных токов
- •3.4.2 Циркуляция вектора индукции магнитного поля. Закон полного тока.
- •3.4.3 Закон Био—Савара—Лапласа. Магнитное поле прямого тока
- •3.4.4 Сила Лоренца Движение заряженных частиц в электрических и магнитных полях
- •3.4.5 Определение удельного заряда электрона. Ускорители заряженных частиц
- •3.5 Магнитные свойства вещества
- •3.5.1 Магнетики. Магнитные свойства веществ
- •3.5.2 Постоянные магниты
- •3.6 Электромагнитная индукция
- •3.6.1 Явления электромагнитной индукции. Закон Фарадея. Токи Фуко
- •3.6.2 Ток смещения. Вихревое электрическое поле Уравнения Максвелла
- •3.6.3 Энергия магнитного поля токов
- •IV Оптика и основы ядерной физики
- •4.1. Фотометрия
- •4.1.1 Основные фотометрические понятия. Единицы измерений световых величин
- •4.1.2 Функция видности. Связь между светотехническими и энергетическими величинами
- •4.1.3 Методы измерения световых величин
- •4.2 Интерференция света
- •4.2.1 Способы наблюдения интерференции света
- •4.2.2 Интерференция света в тонких пленках
- •4.2.3 Интерференционные приборы, геометрические измерения
- •4.3 Дифракция света
- •4.3.1 Принцип Гюйгенса—Френеля. Метод зон Френеля. Зонная пластинка
- •4.3.2 Графическое вычисление результирующей амплитуды. Применение метода Френеля к простейшим дифракционным явлениям
- •4.3.3 Дифракция в параллельных лучах
- •4.3.4 Фазовые решетки
- •4.3.5 Дифракция рентгеновских лучей. Экспериментальные методы наблюдения дифракции рентгеновских лучей. Определение длины волны рентгеновских лучей
- •4.4 Основы кристаллооптики
- •4.4.1 Описание основных экспериментов. Двойное лучепреломление
- •4.4.2 Поляризация света. Закон Малюса
- •4.4.3 Оптические свойства одноосных кристаллов. Интерференция поляризованных лучей
- •4.5 Виды излучения
- •4.5.1 Основные законы теплового излучения. Абсолютно черное тело. Пирометрия
- •4.5.2 Источники света
- •4.6 Действие света
- •4.6.1 Фотоэлектрический эффект. Законы внешнего фотоэффекта
- •4.6.2 Эффект Комптона
- •4.6.3 Давление света. Опыты Лебедева
- •4.6.4 Фотохимическое действие света. Основные фотохимические законы. Основы фотографии
- •4.7 Развитие квантовых представлений об атоме
- •4.7.1 Опыты Резерфорда по рассеянию альфа-частиц. Планетарно-ядерная модель атома
- •4.7.2 Спектр атомов водорода. Постулаты Бора
- •4.7.3 Корпускулярно-волновой дуализм. Волны де Бройля
- •4.7.4 Волновая функция. Соотношение неопределенности Гейзенберга
- •4.8 Физика атомного ядра
- •4.8.1 Строение ядра. Энергия связи атомного ядра. Ядерные силы
- •4.8.2 Радиоактивность. Закон радиоактивного распада
- •4.8.3 Радиоактивные излучения
- •4.8.4 Правила смещения и радиоактивные ряды
- •4.8.5 Экспериментальные методы ядерной физики. Методы регистрации частиц
- •4.8.6 Физика элементарных частиц
- •4.8.7 Космические лучи. Мезоны и гипероны. Классификация элементарных частиц
- •Содержание
2.3.2 Теплоемкость газа. Применение первого начала термодинамики к изопроцессам
Во многих процессах внешним результатом сообщения телу теплоты является нагревание и поэтому, не разделяя полученную теплоту на части соответственно изменению свойств тела, вводят общее понятие теплоемкости, которая представляет собой количество теплоты, необходимой для изменения температуры тела на один градус.
|
C= ∆Q/∆Т |
(2.40), |
где ∆Q — количество тепла, полученное в процессе повышения температуры тела от Т1 до Т2. В пределе, когда ∆T стремится к нулю, мы получаем истинную теплоемкость тела при данной температуре:
|
С = lim ∆Q/∆Т = dQ/dТ |
(2.41). |
Различают удельную теплоемкость, когда необходимая теплота отнесена к 1 кг массы
|
с = C/m, |
(2.42), |
и молярную теплоемкость, когда теплота отнесена к одному молю
|
С = c М |
(2.43). |
Наибольшее практическое значение имеют теплоемкости в изохорическом (CV) и изобарическом (Ср) процессах. В изохорическом процессе теплоемкость равна CV
|
СV = dQV/dТ = (∂U/∂T)V , т. е. dUv = CvdT. |
(2.44). |
В изобарическом процессе теплоемкость Ср может быть представлена выражением, если ввести энтальпию:
|
Сp. = dQp/dТ = (∂H/∂T)p -) , т. е. dHp = CpdT |
(2.45). |
В изотермическом процессе теплоемкость равна бесконечности: Сi = ∞, так как здесь при передаче системе теплоты ∆Q повышения температуры не происходит: ∆Т =0. В адиабатическом процессе теплоемкость равна 0, так как затраченная теплота dQ = 0 при наличии конечного изменения температуры.
Опыт показывает, что теплоемкость вообще зависит от температуры. Однако при обычных температурах эта зависимость выражена сравнительно слабо, благодаря чему иногда изменениями пренебрегают, рассматривая, например, небольшие интервалы температур, далеких от абсолютного нуля. При очень низких температурах теплоемкость сильно изменяется с температурой. Так, в области нескольких десятков градусов от абсолютного нуля она возрастает пропорционально кубу абсолютной температуры. Объяснение этой закономерности дает квантовая статистика. Молярная теплоемкость СV при обычных температурах для атомарных газов постоянна и. равна Сv = (3/2)R. Если молекула газа состоит из нескольких атомов, то расчет теплоемкости производиться с учетом степеней свободы по следующей формуле:
|
Сv = dU/dT= i/2*RdT |
(2.46). |
Если газ нагревается при постоянном давлении, то
|
Cp = dU/dT + pdV/dT |
(2.47). |
Учитывая, что dU/dT -— не зависит от вида процесса (внутренняя энергия идеального газа не зависит ни от р, ни от V, а определяется лишь температурой T) и всегда равна CV; продифференцировав уравнение Клапейрона — Менделеева pVm = RT по T (p = const), получим
|
Cp = Cv + R. |
(2.48). |
Это выражение называется уравнением Майера. Оно показывает, что Ср всегда больше Cv .Это объясняется тем, что при нагревании газа при постоянном давлении требуется еще дополнительное количество теплоты на совершение работы расширения газа, так как постоянство давления обеспечивается увеличением объема газа. Для моля любого газа эта разность составляет одну и ту же величину R. = 8,31 Дж/мольК , которая одинакова для всех идеальных газов и называется универсальной газовой постоянной. Cp и Cv можно выразить через степень свободы:
|
Cp = (i+2)/2*R |
(2.49) |
и
|
Cv = i/2*R |
(2.50).. |
При рассмотрении термодинамических процессов важно знать характерное для каждого газа отношение Ср к Cv:
|
γ = Cp/Cv = (i + 2)/i. |
(2.51) |
Отсюда следует, что теплоемкости определяются лишь числом степеней свободы и не зависят от температуры. Это утверждение справедливо в довольно широком интервале температур лишь для одноатомных газов. Уже у двухатомных газов число степеней свободы, проявляющееся в теплоемкости, зависит от температуры.
По закону равномерного распределения энергии по степеням свободы, для комнатных температур Cv = = 7/2R. Из качественной экспериментальной зависимости молярной теплоемкости Cv водорода (рисунок - 2.21) следует, что СV зависит от температуры: при низкой температуре (≈50 К) Cy=3/2R, при комнатной CV = 5/2R (вместо расчетных значений - 7/2R) и очень высокой — CV =7/2R.
|
|
|
Рисунок - 2.21 |
Расхождение теории и эксперимента нетрудно объяснить. Дело в том, что при вычислении теплоемкости надо учитывать квантование энергии вращения и колебаний молекул. Если энергия теплового движения недостаточна, например, для возбуждения колебаний, то эти колебания не вносят своего вклада в теплоемкость (соответствующая степень свободы «замораживается» — к ней неприменим закон равнораспределения энергии). Этим объясняется, что теплоемкость моля двухатомного газа — водорода — при комнатной температуре равна 5/2R вместо 7/2R. Аналогично, можно объяснить уменьшение теплоемкости при низкой температуре («замораживаются» вращательные степени свободы) и увеличение при высокой («возбуждаются» колебательные степени свободы).
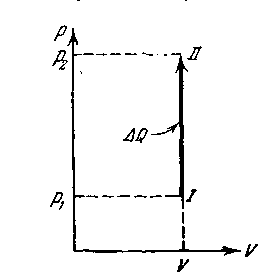
Применим первое начало термодинамики к ряду процессов в идеальном газе, при которых один из термодинамических параметров, характеризующих состояние газа, остается постоянной. Такие процессы носят название изопроцессов. Процесс, который происходит с сохранением объема (V=const), называется изохорическим. Газ не совершает никакой внешней работы. Вся полученная теплота идет на увеличение кинетической энергии молекул, соответственно чему возрастает внутренняя энергия газа. На диаграмме (р, V) изохорический процесс изображается изохорой, имеющей вид прямой, параллельной оси давлений (рисунок 44).
|
dQ = dU |
(2.52). |
Процесс при котором остается неизменным давление называется изобарическим процессом (р = const). С молекулярно-кинетической точки зрения, при изобарическом расширении идеального газа, часть тепла идет на увеличение скорости движения молекул, а, следовательно, на изменение внутренней энергии идеального газа, и некоторая часть — на внешнюю работу молекул по преодолению внешнего давления. Следовательно, первое начало термодинамики для 1 моля идеального газа при изобарическом процессе выглядит следующим образом:
|
dQ = dU+dA |
(2.53). |
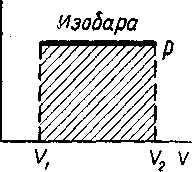
Изменение состояния изображается изобарой (рисунок - 2.23). Работа на этом графике равна площади прямоугольника высотой р и с основанием (V2—V1).
Процесс, протекающий при неизменной температуре (Т=const), называется изотермическом процессом. Из-за постоянства температуры внутренняя энергия газа в этом процессе также остается неизменной, a dU=0. В изотермическом процессе вся теплота, подведенная к системе, полностью идет на совершение работы. Следовательно, как первое начало термодинамики для изотермического процесса, имеем:
|
dQ = dА = pdV |
(2.54). |
Применяя уравнение Клапейрона, и интегрируем полученное выражение в пределах от V1 до V2. Тогда
|
Q = A= RT lnV2/V1 |
(2.55). |
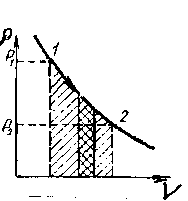
Мы видим, что работа газа при изотермическом процессе пропорциональна абсолютной температуре и логарифму отношения V2/V1. На диаграмме (р, V) изотермический процесс изображается кривой, называемой изотермой, представляющей собой равностороннюю гиперболу (рисунок 6.4.), уравнение которой pV = const. Графически работа при изотермическом процессе определяется площадью заштрихованной на рисунке - 2.23 фигуры.
|
|
|
|
Рисунок - 2.22 |
Рисунок - 2.23 |
Процесс, который совершается без теплообмена с окружающей средой, называется адиабатным процесс ((dQ=0).). Практически такие процессы осуществляются либо при наличии у системы теплоизолирующей оболочки, либо если они происходят столь быстро, что система не успевает обмениваться теплотой с окружающей средой. Первое начало термодинамики для адиабатного процесса дает:
|
dU+dA=0, |
(2.56) |
или
|
—dU=dA, |
(2.57), |
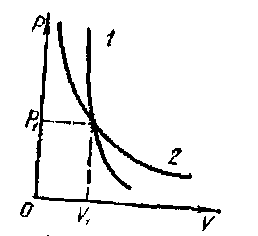
т. е. работа совершается за счет убыли внутренней энергии. При адиабатном процессе изменяются сразу все три параметра состояния. Связь между давлением и объемом установил Пуассон pVγ=const, где γ = Cp/Cv называется показателем адиабаты. Уравнение адиабаты графически изображено на рисунке - 2.24. Адиабата 1 проходит круче, чем пересекающаяся с ней изотерма 2, что вполне понятно: при адиабатном сжатии газ нагревается, в изотермическом процессе его температура не изменяется (рисунок - 2.25).
|
|
|
|
Рисунок - 2.24 |
Рисунок - 2.25 |
Используя уравнение Пуассона для адиабатного процесса и уравнение состояния идеального газа можно определить выражение работы для адиабатного процесса:
|
A = RT1/(γ-1)[1-(V1/V2)γ-1] |
(2.58). |
Процессы, протекающие в системах с постоянной теплоемкостью, называют политропическим. Применяя первое начало термодинамики к политропным процессам, можно получить его уравнение. Действительно, для 1 моля идеального газа имеем: СdT=CvdT+pdV. Продифференцировав уравнение состояния, найдем: pdV+Vdp=RdT. Исключая из этих соотношений температуру, получим: pdV(Cp—C)= Vdp {С—Cv). Введя для краткости обозначение n = (C - Cp)/( С—Cv) последнее уравнение приведем к виду: dp/p + ndV/V = 0 После интегрирования получается уравнение политропы:
|
pVn — const. |
(2.59). |
Нетрудно убедиться в том, что любой изопроцесс является частным случаем политропного процесса. Например, п=1 соответствует изотермическому процессу, n=γ — адиабатическому и т. д.