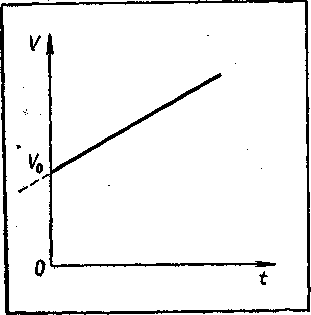- •Введение Физика как наука. Содержание и структура физики
- •I Механика
- •1.1 Кинематика материальной точки
- •1.1.1 Понятие материальной точки. Система отсчета. Траектория, путь, перемещение Единицы измерения
- •1.1.2 Скорость и ускорение произвольно движущейся точки
- •1.1.3 Кинематика прямолинейного движения
- •1.1.4 Движение точки по окружности. Связь между линейными и угловыми кинематическими параметрами
- •1.1.5 Колебательное движение. Виды гармонических колебаний
- •1.1.6 Сложение гармонических колебаний
- •1.2 Динамика материальной точки
- •1.2.1 Законы Ньютона. Масса, сила. Закон сохранения импульса, реактивное движение
- •1.2.2 Силы в механике
- •1.2.3 Работа сил в механике, энергия. Закон сохранения энергии в механике
- •1.3 Динамика вращательного движения твердых тел
- •1.3.1 Момент силы, момент импульса. Закон сохранения момента импульса
- •1.3.2 Кинетическая энергия вращательного движения. Момент инерции
- •II Раздел молекулярная физика и термодинамика
- •2.1 Основные положения молекулярно-кинетической теории газов
- •2.1.1 Агрегатные состояния вещества и их признаки. Методы описания физических свойств вещества
- •2.1.2 Идеальный газ. Давление и температура газа. Шкала температур
- •2.1.3 Законы идеального газа
- •2.2 Распределение Максвелла и Больцмана
- •2.2.1 Скорости газовых молекул
- •2.3. Первое начало термодинамики
- •2.3.1 Работа и энергия в тепловых процессах. Первое начало термодинамики
- •2.3.2 Теплоемкость газа. Применение первого начала термодинамики к изопроцессам
- •2.4. Второе начало термодинамики
- •2.4.1. Работа тепловых машин. Цикл Карно
- •2.4.2 Второе начало термодинамики. Энтропия
- •2.5 Реальные газы
- •2.5.1 Уравнение Ван-дер-Ваальса. Изотермы реального газа
- •2.5.2 Внутренняя энергия реального газа. Эффект Джоуля—Томсона
- •III Электричество и магнетизм
- •3.1 Электростатика
- •3.1.1 Электрические заряды. Закон Кулона
- •3.1.2 Напряженность электрического поля. Поток линий вектора напряженности
- •3.1.3 Теорема Остроградского — Гаусса и его применение для расчета полей
- •3.1.4 Потенциал электростатического поля. Работа и энергия заряда в электрическом поле
- •3.2 Электрическое поле в диэлектриках
- •3.2.1 Электроемкость проводников, конденсаторы
- •3.2.2 Диэлектрики. Свободные и связанные заряды, поляризация
- •3.2.3 Вектор электростатической индукции. Сегнетоэлектрики
- •3.3 Энергия электростатического поля
- •3.3.1 Электрический ток. Законы Ома для постоянного тока
- •3.3.2 Разветвленные цепи. Правила Кирхгофа. Работа и мощность постоянного тока
- •3.4 Магнитное поле
- •3.4.1 Магнитное поле. Закон Ампера. Взаимодействие параллельных токов
- •3.4.2 Циркуляция вектора индукции магнитного поля. Закон полного тока.
- •3.4.3 Закон Био—Савара—Лапласа. Магнитное поле прямого тока
- •3.4.4 Сила Лоренца Движение заряженных частиц в электрических и магнитных полях
- •3.4.5 Определение удельного заряда электрона. Ускорители заряженных частиц
- •3.5 Магнитные свойства вещества
- •3.5.1 Магнетики. Магнитные свойства веществ
- •3.5.2 Постоянные магниты
- •3.6 Электромагнитная индукция
- •3.6.1 Явления электромагнитной индукции. Закон Фарадея. Токи Фуко
- •3.6.2 Ток смещения. Вихревое электрическое поле Уравнения Максвелла
- •3.6.3 Энергия магнитного поля токов
- •IV Оптика и основы ядерной физики
- •4.1. Фотометрия
- •4.1.1 Основные фотометрические понятия. Единицы измерений световых величин
- •4.1.2 Функция видности. Связь между светотехническими и энергетическими величинами
- •4.1.3 Методы измерения световых величин
- •4.2 Интерференция света
- •4.2.1 Способы наблюдения интерференции света
- •4.2.2 Интерференция света в тонких пленках
- •4.2.3 Интерференционные приборы, геометрические измерения
- •4.3 Дифракция света
- •4.3.1 Принцип Гюйгенса—Френеля. Метод зон Френеля. Зонная пластинка
- •4.3.2 Графическое вычисление результирующей амплитуды. Применение метода Френеля к простейшим дифракционным явлениям
- •4.3.3 Дифракция в параллельных лучах
- •4.3.4 Фазовые решетки
- •4.3.5 Дифракция рентгеновских лучей. Экспериментальные методы наблюдения дифракции рентгеновских лучей. Определение длины волны рентгеновских лучей
- •4.4 Основы кристаллооптики
- •4.4.1 Описание основных экспериментов. Двойное лучепреломление
- •4.4.2 Поляризация света. Закон Малюса
- •4.4.3 Оптические свойства одноосных кристаллов. Интерференция поляризованных лучей
- •4.5 Виды излучения
- •4.5.1 Основные законы теплового излучения. Абсолютно черное тело. Пирометрия
- •4.5.2 Источники света
- •4.6 Действие света
- •4.6.1 Фотоэлектрический эффект. Законы внешнего фотоэффекта
- •4.6.2 Эффект Комптона
- •4.6.3 Давление света. Опыты Лебедева
- •4.6.4 Фотохимическое действие света. Основные фотохимические законы. Основы фотографии
- •4.7 Развитие квантовых представлений об атоме
- •4.7.1 Опыты Резерфорда по рассеянию альфа-частиц. Планетарно-ядерная модель атома
- •4.7.2 Спектр атомов водорода. Постулаты Бора
- •4.7.3 Корпускулярно-волновой дуализм. Волны де Бройля
- •4.7.4 Волновая функция. Соотношение неопределенности Гейзенберга
- •4.8 Физика атомного ядра
- •4.8.1 Строение ядра. Энергия связи атомного ядра. Ядерные силы
- •4.8.2 Радиоактивность. Закон радиоактивного распада
- •4.8.3 Радиоактивные излучения
- •4.8.4 Правила смещения и радиоактивные ряды
- •4.8.5 Экспериментальные методы ядерной физики. Методы регистрации частиц
- •4.8.6 Физика элементарных частиц
- •4.8.7 Космические лучи. Мезоны и гипероны. Классификация элементарных частиц
- •Содержание
2.1.3 Законы идеального газа
Законы, управляющие поведением газов, были в свое время открыты опытным путем.
Закон Бойля— Мариотта. Рассмотрим газ, когда его температура поддерживается постоянной. Такие условия называются изотермическими. Если изменение состояния происходит при Т = const, то остальные два параметра (P и V) ведут себя таким образом, что их произведение остается величиной постоянной:
|
PV = const. |
(2.13). |
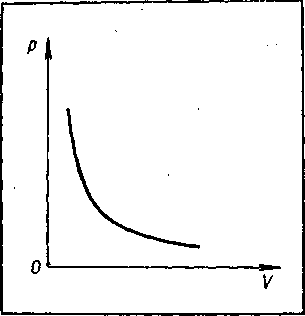
Эта формулу называют уравнением изотермы, и выражает закон Бойля – Мариотта. Графически зависимость р от V изображен на рисунке - 2.8. Эти кривые, называемые изотермами, они представляют собой гиперболы.
Закон Гей-Люссака. Поместим газ в цилиндр под поршень (рисунок - 2.9.). Пусть на поршень сверху действует атмосферное давление р0. Это давление по закону Паскаля будет передаваться во все точки газа под поршнем. Если поршень имеет массу т и сечение S, то давление рвнеш внешних сил газ займет такой объем, при котором давление внутри газа станет равным внешнему давлению: р0. == рвнеш
При квазистатическом нагревании газа под поршнем при постоянном внешнем давлении, как показывает опыт, объем всех без исключения газов увеличивается, а при охлаждении уменьшается. Так же как и для твердых тел, можно ввести коэффициент объемного расширения газов по формуле
|
α = (1/V0)*(V- V0)/(t-t0) = (1/V0)*(∆V/∆t), |
(2.14), |
где ∆V = V - V0 — изменение объема газа при изменении температуры на ∆t = t — t0,, V и V0 — объемы при температурах t и t0. Исследуя на опыте тепловое расширение газов, французский ученый Гей-Люссак открыл, что коэффициент объемного расширения при постоянном давлении у всех газов одинаков и равен 1/273,15 °С -1. Из этого закона следует, что объем газа V при температуре t можно найти, зная
|
|
|
|
Рисунок - 2.8 |
Рисунок - 2.9 |
начальный объем газа V0, при температуре t0:
|
V = V0[1+ α (t — t0)] |
(2.15). |
Обычно в качестве начальной температуры берут 0° С, в этом случае V = V0(l+αt). Как видно из этого уравнения, совокупность состояний, отвечающих одному и тому же давлению, изобразится на графике в координатах V и t прямой линией, отсекающей на оси V отрезок V0 и имеющей тангенс угла наклона, равный αV0 (рисунок - 2.10). Такую зависимость поэтому обычно называют линейной. В координатах р и t график изобарического процесса представляет собой прямую линию, параллельную оси t (рисунок - 2.10), называемую изобарой. Закон Гей-Люссака отражает связь между объемом и температурой идеального газа в изобарическом процессе изменения его состояния.
|
|
|
Рисунок - 2.10 |
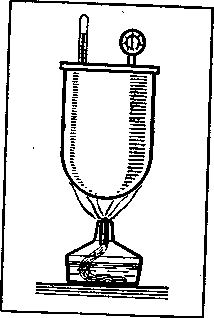
Закон Шарля. Рассмотрим теперь процесс нагревания газа при постоянном объеме, или, как говорят, процесс изохорического нагревания газа. Поместим для этого газ в герметичный сосуд, например в металлический котел с плотно завинчивающейся крышкой (рисунок - 2.11). Будем нагревать газ в котле, измеряя его температуру и давление. Как показывает опыт, давление газа внутри котла увеличивается с ростом температуры. Величину γ, характеризующую изменение давления газа при изменении температуры и называют термическим коэффициентом давления:
|
γ = 1/p0 *(p-p0)/(t-t0) = 1/p0 * ∆p/∆t |
(2.16), |
где ∆р = p-p0 — изменение давления газа при изменении его температуры на ∆t = t-t0, р и р0 — давления газа соответственно при температурах t и t0. Измеряя давление различных газов при нагревании при постоянном объеме, французский ученый Шарль установил, что термический коэффициент давления для всех газов одинаков и равен 1/273,15 °С -1 Зная начальное давление р0 и начальную температуру t0, из закона, установленного Шарлем, легко найти давление р при температуре t:
|
р = р0[1+γ(t-t0)] |
(2.17). |
Если за начальную температуру принять 0° С, то р = р0(t-γt). График изохорического процесса в координатах p и t представляет собой прямую линию, отсекающую на оси р отрезок р0 и имеющую тангенс угла наклона, равный ур0 (рисунок - 2.12).
Законы Гей-Люссака и Шарля выглядят гораздо проще, если вместо шкалы Цельсия для температуры ввести шкалу, предложенную английским физиком Кельвином. Связь между температурой Т по шкале Кельвина и температурой t по шкале Цельсия дается формулой
|
Т= t + 1/α =t + 273,15°. |
(2.18). |
Шкалу Кельвина называют абсолютной шкалой температур. Законы Гей-Люссака и Шарля при этом примут вид:
|
V = αV0T, p = αpQT, |
(2.19), |
где V0 и р0 — объем и давление газа при температуре T0=- = 273,15 К.
Равенство коэффициента теплового расширения газа при постоянном
|
|
|
|
Рисунок - 2.11 |
Рисунок - 2. 12 |
давлении термическому коэффициенту давлению при постоянном объеме является свойством, присущим только газам. Оно позволяет найти уравнение состояния газов.
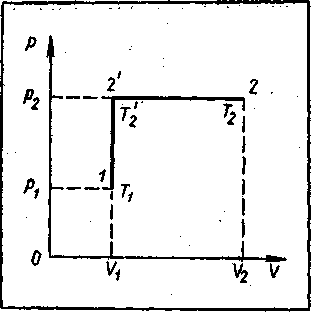
Совершим для этого над газом тепловой процесс, нагревая его сначала при постоянном объеме, а затем при постоянном давлении. График процесса изохорического нагревания в координатах р и V изобразится прямой /, 2', параллельной оси ординат р. Процесс изобарического нагревания изобразится на этом графике прямой 2', 2, параллельной оси абсцисс V (рисунок - 2.13). Обозначим:
- давление, объем и температуру газа в начале теплового процесса через р1, Vl ,T1 (точка 1)
- в конце процесса изохорического нагревания через р2, V1 T '2 (точка 2')
- и в конце изобарического процесса через р2, V2, T2 (точка 2).
Из закона Шарля следует, что отношение давления к абсолютной температуре есть величина постоянная (р/Т0 = αр0). Поэтому давление и температура газа в точке 2 связаны с давлением и температурой газа в точке1 соотношением р2/Т '2 = р1/Т1 из которого находим температуру Т '2 в конце изохорического нагревания:
Т '2 = ( р2/р1 )Т1. Температура Т'2 и объем газа V1 в точке 2' в процессе изобарического нагревания связаны с температурой Т2 и объемом газа V2 в точке 2 соотношением
|
V1/ Т '2 = V2/ Т'2 |
|
Подставляя в это уравнение температуру Т'2 = (р2Т1)/р1 , получаем: V1 р1/ р2 Т1 = V2/ Т'2. Откуда следует:
|
V1р1/Т1= V2р2/Т2 |
|
Начальное и конечное состояния газа (точки 1 и 2 в данном опыте) были выбраны совершенно произвольно. Можно было бы взять в
|
|
|
Рисунок - 2. 13 |
качестве начального и конечного состояний другие точки. Процесс перевода газа из состояния 1 в состояние 2 также можно было бы совершить по-иному, нагревая, например, газ сначала изобарически, а затем изохорически. Однако в любом случае можно показать, что начальное (1) и конечное (2) состояния газа всегда связаны между собой соотношением: V1р1/Т1= V2р2/Т2 или, по-другому, что в состоянии теплового равновесия для данной массы газа справедливо соотношение рV/Т = const.
Неизвестную постоянную удалось вычислить после того, как итальянским физиком Авогадро был экспериментально установлен закон, что один моль любого газа при давлении в 1 атм и температуре 0° С занимает объем 22,4 л. Подставляя эти данные в найденное соотношение, получили постоянную
|
рV/Т≈8,3 Дж/моль К |
(2.20). |
Эту величину обозначают буквой R и называют универсальной газовой постоянной.
Для произвольной массы газа m постоянную легко найти, учитывая, что в состоянии теплового равновесия масса газа распределена равномерно по объему. Если моль газа массой μ занимает объем Vμ., то тот же газ массой m занимает при тех же условиях V = mVμ/ μ, где Vμ/ μ – объем, занимаемый 1 г вещества. Из уравнения рVμ/Т = R находим: рμVμ/ m Т = R, или
|
pV= (m/μ)RT. |
(2.21). |
Это уравнение и называют уравнением состояния идеального газа.
Уравнение состояния в форме рV/Т = const было впервые получено Клапейроном, а для произвольной массы газа уравнение состояния в форме pV= (m/μ)RT было записано Менделеевым. Поэтому часто уравнение газового состояния идеального газа называют уравнением Менделеева — Клапейрона.
Следует отметить, что в реальных условиях ни один из газов не подчиняется строго уравнению Менделеева — Клапейрона. Правда, отклонения от закона Менделеева — Клапейрона фактически исчезают для достаточно разреженных газов. Однако при низких температурах и больших плотностях начинаются заметные отклонения от этого закона. То же самое происходит и при достаточно высоких температурах (порядка тысячи и нескольких тысяч градусов) для газов из многоатомных молекул. При этих температурах начинается распад молекул газа на атомы. При еще более высоких температурах начинается распад атомов на электроны и ионы и любой газ перестает подчиняться уравнению Менделеева — Клапейрона, даже при сколь угодно малых плотностях.
Закон Дальтона. В обычных условиях чаще приходится иметь дело не с чистым газом (кислородом, азотом и т. д.), а со смесью нескольких газов. Так, например, воздух состоит из смеси азота, кислорода, углекислого и других газов.
Каждый из газов в смеси вносит свой вклад в давление, создаваемое смесью. Давление, оказываемое какой-либо компонентой смеси на стенки сосуда, когда все другие компоненты газа удалены из объема, называют парциальным давлением. Английский физик Дальтон экспериментально установил, что давление газовой смеси равно сумме парциальных давлений:
|
р = р1 + р2 + . : |
(2.22), |
а парциальное давление каждой из компонент смеси подчиняется при этом уравнению Клапейрона — Менделеева: рlV = m1/μ1 RT, p2V = m2/μ2 RT и т.д., где V —объем смеси, Т — ее температура, m — масса, a μi — молярная масса i-й компоненты смеси.
Уравнение состояния газовой смеси легко найти из закона Дальтона. Для этого нужно подставить в уравнение р =p1 + p2 + парциальные давления, найденные из уравнения состояния каждой компоненты p1 = m1/μ1 RT/V, и умножить правую и левую части полученного равенства на объем, т. е.
|
pV = (m1/μ1 + m2/μ2 + .)RT |
(2.23). |