- •Введение Физика как наука. Содержание и структура физики
- •I Механика
- •1.1 Кинематика материальной точки
- •1.1.1 Понятие материальной точки. Система отсчета. Траектория, путь, перемещение Единицы измерения
- •1.1.2 Скорость и ускорение произвольно движущейся точки
- •1.1.3 Кинематика прямолинейного движения
- •1.1.4 Движение точки по окружности. Связь между линейными и угловыми кинематическими параметрами
- •1.1.5 Колебательное движение. Виды гармонических колебаний
- •1.1.6 Сложение гармонических колебаний
- •1.2 Динамика материальной точки
- •1.2.1 Законы Ньютона. Масса, сила. Закон сохранения импульса, реактивное движение
- •1.2.2 Силы в механике
- •1.2.3 Работа сил в механике, энергия. Закон сохранения энергии в механике
- •1.3 Динамика вращательного движения твердых тел
- •1.3.1 Момент силы, момент импульса. Закон сохранения момента импульса
- •1.3.2 Кинетическая энергия вращательного движения. Момент инерции
- •II Раздел молекулярная физика и термодинамика
- •2.1 Основные положения молекулярно-кинетической теории газов
- •2.1.1 Агрегатные состояния вещества и их признаки. Методы описания физических свойств вещества
- •2.1.2 Идеальный газ. Давление и температура газа. Шкала температур
- •2.1.3 Законы идеального газа
- •2.2 Распределение Максвелла и Больцмана
- •2.2.1 Скорости газовых молекул
- •2.3. Первое начало термодинамики
- •2.3.1 Работа и энергия в тепловых процессах. Первое начало термодинамики
- •2.3.2 Теплоемкость газа. Применение первого начала термодинамики к изопроцессам
- •2.4. Второе начало термодинамики
- •2.4.1. Работа тепловых машин. Цикл Карно
- •2.4.2 Второе начало термодинамики. Энтропия
- •2.5 Реальные газы
- •2.5.1 Уравнение Ван-дер-Ваальса. Изотермы реального газа
- •2.5.2 Внутренняя энергия реального газа. Эффект Джоуля—Томсона
- •III Электричество и магнетизм
- •3.1 Электростатика
- •3.1.1 Электрические заряды. Закон Кулона
- •3.1.2 Напряженность электрического поля. Поток линий вектора напряженности
- •3.1.3 Теорема Остроградского — Гаусса и его применение для расчета полей
- •3.1.4 Потенциал электростатического поля. Работа и энергия заряда в электрическом поле
- •3.2 Электрическое поле в диэлектриках
- •3.2.1 Электроемкость проводников, конденсаторы
- •3.2.2 Диэлектрики. Свободные и связанные заряды, поляризация
- •3.2.3 Вектор электростатической индукции. Сегнетоэлектрики
- •3.3 Энергия электростатического поля
- •3.3.1 Электрический ток. Законы Ома для постоянного тока
- •3.3.2 Разветвленные цепи. Правила Кирхгофа. Работа и мощность постоянного тока
- •3.4 Магнитное поле
- •3.4.1 Магнитное поле. Закон Ампера. Взаимодействие параллельных токов
- •3.4.2 Циркуляция вектора индукции магнитного поля. Закон полного тока.
- •3.4.3 Закон Био—Савара—Лапласа. Магнитное поле прямого тока
- •3.4.4 Сила Лоренца Движение заряженных частиц в электрических и магнитных полях
- •3.4.5 Определение удельного заряда электрона. Ускорители заряженных частиц
- •3.5 Магнитные свойства вещества
- •3.5.1 Магнетики. Магнитные свойства веществ
- •3.5.2 Постоянные магниты
- •3.6 Электромагнитная индукция
- •3.6.1 Явления электромагнитной индукции. Закон Фарадея. Токи Фуко
- •3.6.2 Ток смещения. Вихревое электрическое поле Уравнения Максвелла
- •3.6.3 Энергия магнитного поля токов
- •IV Оптика и основы ядерной физики
- •4.1. Фотометрия
- •4.1.1 Основные фотометрические понятия. Единицы измерений световых величин
- •4.1.2 Функция видности. Связь между светотехническими и энергетическими величинами
- •4.1.3 Методы измерения световых величин
- •4.2 Интерференция света
- •4.2.1 Способы наблюдения интерференции света
- •4.2.2 Интерференция света в тонких пленках
- •4.2.3 Интерференционные приборы, геометрические измерения
- •4.3 Дифракция света
- •4.3.1 Принцип Гюйгенса—Френеля. Метод зон Френеля. Зонная пластинка
- •4.3.2 Графическое вычисление результирующей амплитуды. Применение метода Френеля к простейшим дифракционным явлениям
- •4.3.3 Дифракция в параллельных лучах
- •4.3.4 Фазовые решетки
- •4.3.5 Дифракция рентгеновских лучей. Экспериментальные методы наблюдения дифракции рентгеновских лучей. Определение длины волны рентгеновских лучей
- •4.4 Основы кристаллооптики
- •4.4.1 Описание основных экспериментов. Двойное лучепреломление
- •4.4.2 Поляризация света. Закон Малюса
- •4.4.3 Оптические свойства одноосных кристаллов. Интерференция поляризованных лучей
- •4.5 Виды излучения
- •4.5.1 Основные законы теплового излучения. Абсолютно черное тело. Пирометрия
- •4.5.2 Источники света
- •4.6 Действие света
- •4.6.1 Фотоэлектрический эффект. Законы внешнего фотоэффекта
- •4.6.2 Эффект Комптона
- •4.6.3 Давление света. Опыты Лебедева
- •4.6.4 Фотохимическое действие света. Основные фотохимические законы. Основы фотографии
- •4.7 Развитие квантовых представлений об атоме
- •4.7.1 Опыты Резерфорда по рассеянию альфа-частиц. Планетарно-ядерная модель атома
- •4.7.2 Спектр атомов водорода. Постулаты Бора
- •4.7.3 Корпускулярно-волновой дуализм. Волны де Бройля
- •4.7.4 Волновая функция. Соотношение неопределенности Гейзенберга
- •4.8 Физика атомного ядра
- •4.8.1 Строение ядра. Энергия связи атомного ядра. Ядерные силы
- •4.8.2 Радиоактивность. Закон радиоактивного распада
- •4.8.3 Радиоактивные излучения
- •4.8.4 Правила смещения и радиоактивные ряды
- •4.8.5 Экспериментальные методы ядерной физики. Методы регистрации частиц
- •4.8.6 Физика элементарных частиц
- •4.8.7 Космические лучи. Мезоны и гипероны. Классификация элементарных частиц
- •Содержание
2.5 Реальные газы
2.5.1 Уравнение Ван-дер-Ваальса. Изотермы реального газа
При увеличении давления и понижении температуры средние расстояния между молекулами уменьшаются. Средняя кинетическая энергия молекул становится сравнимой с потенциальной энергией взаимодействия, и поведение газа все больше отличается от идеального. Отклонение от идеальности может быть установлено экспериментально, путем проверки справедливости уравнения Клапейрона — Менделеева для некоторого газа при различных давлениях. В таблице 2.1 приведены значения объема V, занимаемого одним молем азота N2 при различных давлениях р и температуре 273 К, а также значения произведения pV. Видно, что при уменьшении объема одного моля газа до размеров порядка 10-4м3 отступления от идеальности становятся значительными.
Объем одной молекулы азота по порядку величины равен: V0 = 4/3πr0 ≈ 4*10-28 м3. Так как в моле находится 6,02*1023 молекул, то их объем V≈10-4 м3. Как только молекулы газа попадут в условия, при которых среднее расстояние между ними становится, сравнимым с размерами самих молекул, свойства газа начинают отличаться от идеального.
Таблица 2.1 - Значения объема V, занимаемого одним молем азота при различных Р и Т
|
Р*105, Па |
V*10*, м8 |
pV*109, м3Па |
P*105, Па |
V*104, м3 |
pV*109, м3Па |
|
1 |
224 |
224 |
700 |
0,532 |
372 |
|
100 |
2,4 |
240 |
900 |
0,483 |
435 |
|
300 |
0,85 |
255 |
- |
- |
- |
|
500 |
0,625 |
322 |
1000 |
0,460 |
460 |
Описание свойств реального газа можно осуществить различными способами. В частности, написав уравнение состояния, связывающее между собой макропараметры р, V и Т , можно ввести соответствующие изменения, с учетом реальных сил взаимодействия между молекулами. При этом следует, во-первых, принять во внимание существование сил отталкивания между молекулами, что приведет к уменьшению свободного объема, предоставленного молекулам, на некоторую величину b. Как показывает более детальное рассмотрение, эта величина равна приблизительно учетверенному объему молекул газа: b≈4V0. Поправка b для каждого газа имеет свое значение. Во-вторых, необходимо учесть силы притяжения между молекулами газа, которые вызывают уменьшение давления молекул газа на стенки сосуда на величину pi. Эта поправка определяется тем, что молекулы, находящиеся в поверхностном слое газа (их число п обратно пропорционально объему газа), притягиваются ближайшими молекулами внутри газа (их число также обратно пропорционально объему газа). Поэтому pi пропорционально п2 или обратно пропорционально квадрату объема: pi.= a/V2, где а — постоянная, зависящая от природы газа. С учетом обеих поправок, получаем уравнение состояния реального газа, носящее имя Ван-дер-Ваальса:
|
p = RT/(V-b) - a/V2. |
|
При достаточно малых Т и V это давление оказывается меньше давления идеального газа: Р<РиД = RT/V. Из этого уравнения следует, что давление реального газа может обратиться в нуль. Это значит, что при достаточном охлаждении и сжатии газ должен превратиться в жидкость, а затем и затвердеть, приобретая вполне определенный объем. Это важное следствие из уравнения Ван-дер-Ваальса полностью подтверждено опытом: все известные газообразные вещества могут быть переведены в жидкое, а затем, при их дальнейшем охлаждении, и в твердое состояние. Вид последнего уравнения ясно выявляет его физическую сущность. Для математического анализа это уравнение удобнее переписать в виде:
|
(p+ a/V2)(V-b)=RT. |
(2.78). |
Эти уравнения получены для 1 моль. Для произвольного числа молей υ уравнение Ван-дер-Ваальса имеет вид:
|
p+ aν2/V2)(V-bν)=νRT |
(2.79). |
Уравнение Ван-дер-Ваальса, несмотря на очевидную упрощенность рассуждений при его обосновании, в основном правильно описывает свойства реальных газов в.достаточно большом интервале температур и давлений, введенные поправки имеют ясный физический смысл и могут быть измерены экспериментально.
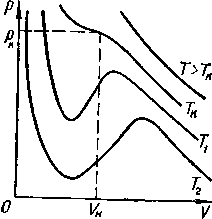
Уравнение Ван-дер-Ваальса позволяет построить теоретические изотермы реального газа и сравнить их с изотермами идеального газа и экспериментальными изотермами реального газа. Семейство теоретических изотерм для реального газа оксида углерода (IV) представлено на рисунке - 2.28. В отличие от монотонно изменяющихся изотерм идеального газа, изотермы реального газа, при низких температурах, изображаются сложными кривыми. Совпадение изотерм идеального и реального газа наблюдается при малых давлениях и больших объемах, что понятно, так как при этих условиях газ можно считать идеальным. Для семейства изотерм Ван-дер-Ваальса характерно наличие так называемой критической изотермы (при температуре ТК), имеющей точку перегиба при некотором давлении рк и объеме Vк; при Т>ТК все изотермы идут монотонно, при Т<.ТК все изотермы изгибаются и имеют минимум и максимум.
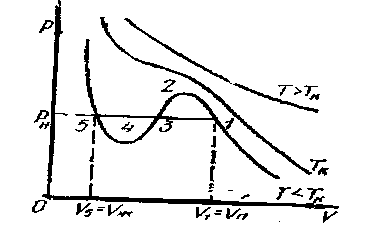
Для выяснения физического смысла состояний, описываемых изотермами Ван-дер-Ваальса, сравним их с экспериментальными изотермами реального газа. Для оксида углерода (IV) критическая температура равна 305 К. Изотермы, снятые экспериментально (рисунок - 2.29), при температурах выше критической, отражают монотонное увеличение давления газа при уменьшении его объема. При температурах, меньших критической, эксперимент показывает, что изотермы на участке 1,5 имеют «полочку», причем, начиная с объема V1, в цилиндре под поршнем находится и жидкость и газ (точнее, насыщенный пар). При объеме V5 пар полностью конденсируется, переходя в жидкость, заполняющую весь объем, и при дальнейшем уменьшении объема изотермы описывают уже свойства реальной жидкости.
|
|
|
|
Рисунок - 2.28 |
Рисунок - 2.29 |
Состояния, соответствующие участку изотермы Ван-дер-Ваальса 2, 3, 4, не наблюдаются экспериментально, так как они неустойчивые; состояния 4,5 и 1,2 могут быть реализованы при особых условиях. Участок 4,5 соответствует так называемой растянутой жидкости. Это состояние можно получить, например, если осторожно вытягивать из сосуда со ртутью вертикальную трубку, заполненную ртутью и закрытую сверху. В этом случае удается получить столб, высота которого превосходит высоту, отвечающую атмосферному давлению, существующему в условиях опыта: жидкость в трубке занимает больший объем, чем ей положено. Но при малейшем сотрясении столб падает до нормальной высоты. Участок 1,2 можно реализовать, если достаточно медленно изотермически сжимать очень чистое вещество: конденсация может наступить при повышенном давлении. Такой пар называют пересыщенным. Состояния, соответствующие участкам /, 2 и 4, 5, называют метастабильными состояниями.
Таким образом, уравнение Ван-дер-Ваальса описывает не только свойства газов и паров, но и жидкостей. Анализ изотерм реального газа показывает, что превращение реального газа в жидкость возможно только при температурах, меньших критической, и при соответствующих давлениях.
Как видно из графиков реальных изотерм и изотерм Ван-дер-Ваальса, при критической температуре изотерма реального газа имеет точку перегиба. Обозначим критические значения соответствующих параметров Тк, рк и Vк. Для их нахождения проще всего воспользоваться известным свойством точки перегиба: в ней первая и вторая производные давления по объему обращаются в нуль:
|
dp/dV = - RT/(V-b)2 + 2a/V3 = 0; d2p/dV2 = 2RT/ (V-b)3 -6a/V4 = 0 |
|
Из этих соотношений сразу получается:
|
Vк = 3b; Тк = 8а/27bR |
(2.80). |
Подставив эти величины в уравнения Ван-дер-Ваальса, находим критическое давление:
|
рк = а/27b2 |
(2.81). |
Отношение (рк Vк)/RT = 3/8 ≠ 1. Оно не зависит от природы газа и резко отличается от единицы; следовательно, вблизи критической точки (и тем более при температурах ниже критической) нельзя пользоваться уравнением Клапейрона—Менделеева. При критической температуре и V>VK, вещество находится в парообразном состоянии. При V<VK вещество находится в жидком состоянии, а при V=VK парообразное и жидкое состояние существуют одновременно и неразличимы. Такие состояния, когда при одинаковых внешних условиях вещество может находиться в различных состояниях: жидком и парообразном, или, как говорят, в различных фазах. Фазой мы будем называть часть системы, ограниченную поверхностью раздела, с одинаковыми физическими свойствами во всех своих точках. Если две или несколько фаз вещества при некоторых физических условиях существуют одновременно и при этом масса одной из фаз не увеличивается за счет другой фазы, то говорят о фазовом равновесии. Равновесие между жидкостью и ее насыщенным паром, имеет место при давлениях и температуре ниже критической. Изменение одной из этих величин, например температуры, вызывает изменение и того давления, при котором возможно фазовое равновесие, т.е. изменение упругости насыщенного пара.
На рисунке 2.31 представлена зависимость упругости насыщенного пара от температуры для воды. Для всех других веществ эта зависимость имеет такой же характер. Любая точка слева от приведенной кривой соответствует жидкому состоянию, а точки, расположенные справа от нее, соответствуют газообразной фазе. Это значит, что пар, состояние которого характеризуется какой-либо точкой справа от кривой, сконденсируется, если, сохраняя неизменным давление, понизить его температуру. Точно так же жидкость, состояние которой задано координатами любой точки, расположенной слева от кривой, перейдет в пар, если повысить ее температуру. И только точки, лежащие на самой кривой, соответствуют фазовому равновесию, т. е. одновременному существованию жидкости и пара над ней.
Кривая рисунка - 2.30, точки которой соответствуют равновесию фаз, называется фазовой диаграммой, или кривой равновесия фаз (в данном случае жидкости и пара). Она разделяет области, точки которых соответствуют однофазным состояниям вещества, и является, одной из важных характеристик вещества. Такие диаграммы иногда называют также диаграммами состояния.
Характерной особенностью кривой рис. 82 является то, что она имеет конец, так как она не может быть продолжена выше критической температуры. Ведь выше этой температуры нет двух фаз, поэтому не может быть и их равновесия. Как мы увидим ниже, кривая равновесия «жидкость - пар» имеет и начало.
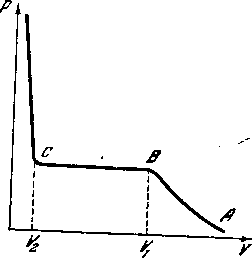
График рисунка - 2.31 иллюстрирует сказанное выше. При сравнительно больших удельных объемах (малой плотности) газа уменьшение объема сопровождается увеличением давления (участок АВ кривой). Так продолжается до тех пор, пока объем не уменьшится до значения V1. Дальнейшее уменьшение объема до значения V2 не вызывает изменения давления. Начиная с V2,уменьшение объема требует уже резкого повышения давления. В точке В, соответствующей объему V1, начинается процесс конденсации, и к тому моменту, когда объем достигнет значения V2, весь газ переходит в жидкое состояние.
|
|
|
|
Рисунок - 2.30 |
Рисунок - 2.31 |
Наконец, резкое увеличение давления при уменьшении объема ниже V2 свидетельствует о том, что происходит уже сжатие самой жидкости. При давлениях и объемах, соответствующих участку ВС, часть объема сосуда занята жидкостью, другая часть — газом, который; в этом случае называется насыщенным паром (рисунок - 2.32). Ордината, cooтветствующая участку ВС, определяет давление насыщенного пара, и как обычно говорят, упругость насыщенного пара при данной температуре. При этой температуре, следовательно, стирается разница между жидкостью и ее насыщенным паром.
При температурах выше 647,3 К вода ведет себя как обычный газ, т. е. при повышении давления ее объем уменьшается. Вместо двух одновременно существующих состояний, жидкого и газообразного, теперь остается только одно состояние — газообразное, хотя при достаточно высоком давлении плотность такого газа может стать равной плотности жидкости и превзойти ее
Все это относится, разумеется, не только к воде, но и к любому другому веществу. Для каждого вещества существует своя некоторая температура, при которой исчезает различие между паром и жидкостью и выше которой вещество может быть только однородным при любом сжатии. Эта температура называется критической температурой. Разные вещества имеют различные значения критических температур. Самой низкой в природе критической температурой обладает редкий изотоп гелия Не3 —гелий с атомным весом 3. Она равна 3,35К, или - 269,80°С.
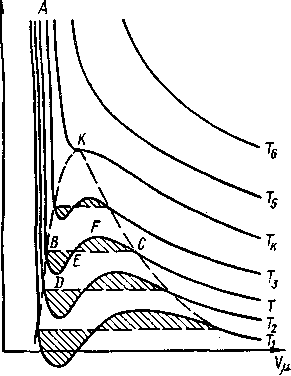
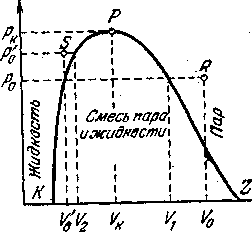
Если на изотермах, соответствующих фазовому переходу жидкость—пар, соединить точки перехода пара в жидкость и жидкости в пар, то получится плавная кривая с максимумом, изображенная пунктиром и воспроизведенная отдельно на рисунке - 2.33. Любая точка R с координатами р0 и V0, находящаяся справа ветви кривой PZ, соответствует, очевидно, газообразному состоянию, потому что удельный объем V0 больше того объема, при котором начинается переход в жидкое состояние при том же давлении. Точно так же точка S с координатами р'0 и V'0 как и любая друг точка, расположенная слева от ветви РК, соответствует жидкому состоянию — удельный объем V'a меньше удельного объема, при котором заканчивается процесс конденсации. Все же точки, лежащие внутри кривой KPZ, соответствуют двухфазным состояниям, таким состояниям, при которых одновременно существуют жидкость и насыщенный пар над ней. Точка же Р соответствует критическому состоянию. Ее координаты на кривой рисунке - 2.33 —рк и VK —-критические давление и объем.
|
|
|
|
Рисунок - 2.32 |
Рисунок - 2.33 |
Как мы уже знаем, перевести вещество из газообразного в жидкое состояние можно, повышая его давление при данной температуре, если эта последняя ниже критической. Если температура выше Т', необходимо предварительное охлаждение. При таком превращении вещество должно пройти через промежуточную область двухфазного состояния, когда пар и жидкость сосуществуют и граничат друг с другом.
Можно, однако, осуществить этот переход и минуя эту область двухфазных состояний. Другими словами, можно превратить газ в жидкость (или наоборот) без того, чтобы в какой-то момент существовали обе фазы. Например, для того, чтобы газ, характеризуемый объемом Vo, давлением р0 и температурой Т0 превратить в жидкость при той же температуре и давлении, но, конечно, с другим объемом V'0, можно поступить следующим образом. Нужно нагреть газ до температуры выше критической, после чего сжать так, чтобы его объем стал равным V0. Наконец, сохраняя постоянным объем, нужно охладить газ до температуры Т0. Давление его при этом станет равным р0. Таким образом, мы можем превратить газ в жидкость «в обход» области двухфазных состояний, так что не будет такого промежуточного состояния, при котором появится граница между жидкостью и паром (мениск).