
- •1 Вопрос
- •2 Вопрос
- •3 Вопрос
- •4 Вопрос
- •5 Вопрос
- •6 Вопрос
- •7 Вопрос
- •8 Вопрос
- •9 Вопрос
- •10 Вопрос
- •11 Вопрос
- •12 Вопрос
- •13 Вопрос
- •14 Вопрос
- •15 Вопрос
- •16 Вопрос
- •17 Вопрос
- •18 Вопрос
- •19 Вопрос
- •20 Вопрос
- •1. Последовательность реакций цитратного цикла
- •21 Вопрос
- •28 Вопрос
- •31 Вопрос
- •32 Вопрос
- •33 Вопрос
- •36 Вопрос
- •1. Теория оперона
- •37 Вопрос
- •38 Вопрос
- •39 Вопрос
- •40 Вопрос
- •41 Вопрос
- •3. Биологическое значение трансаминирования
- •42 Вопрос
- •43 Вопрос
- •1. Реакции синтеза мочевины
- •3. Биологическая роль орнитинового цикла Кребса-Гензелейта
- •44 Вопрос
- •45 Вопрос
- •46 Вопрос
- •1. Пути метаболизма серина и глицина
- •3. Образование и использование одноуглеродных фрагментов
- •47 Вопрос
- •48 Вопрос
- •49 Вопрос
- •51 Вопрос
- •52 Вопрос
- •53 Вопрос
- •54 Вопрос
- •55 Вопрос
- •56 Вопрос
- •57 Вопрос
- •58 Вопрос
- •59 Вопрос
- •60 Вопрос
- •61 Вопрос
- •62 Вопрос
- •63 Вопрос
- •64 Вопрос
- •1. Подтип iIa:
- •2. Подтип iIb:
- •1. Ан‑α‑липопротеинемия (танжерская болезнь).
- •2. А‑β‑липопротеинемия.
- •65 Вопрос
- •67 Вопрос
- •68 Вопрос
- •69 Вопрос
- •70 Вопрос
- •71 Вопрос
- •72 Вопрос
- •73 Вопрос
- •74 Вопрос
- •75 Вопрос
- •76 Вопрос
- •77 Вопрос
- •78 Вопрос
- •79 Вопрос
- •80 Вопрос
- •81 Вопрос
- •82 Вопрос
- •83 Вопрос
- •84 Вопрос
- •85 Вопрос
- •86 Вопрос
- •1. Синтез и секреция катехоламинов
- •2. Механизм действия и биологические функции катехоламинов
- •3. Патология мозгового вещества надпочечников
- •2. Биологические функции инсулина
- •1. Инсулинзависимый сахарный диабет
- •91 Вопрос
- •92 Вопрос
- •1. Синтез и секреция антидиуретического гормона
- •2. Механизм действия
- •3. Несахарный диабет
- •1. Механизм действия альдостерона
- •98 Вопрос
- •99 Вопрос
- •101 Вопрос
- •102 Вопрос
- •103 Вопрос
- •106 Вопрос
- •107 Вопрос
- •112 Вопрос
- •113 Вопрос
- •114 Вопрос
- •1. Основные ферменты микросомальных электронтранспортных цепей
- •1. Участие трансферам в реакциях конъюгации
- •115 Вопрос
- •116 Вопрос
- •Анаэробные пути ресинтеза атф
- •117 Вопрос
- •118 Вопрос
- •122 Вопрос
- •123 Вопрос
- •124 Вопрос
9 Вопрос
Ферменты, специфичность действия. Классификация и номенклатура ферментов. Структурно-функциональная организация ферментных белков. Активный и аллостерический центры ферментов. Механизм действия ферментов.
Ферменты, или энзимы, представляют собой высокоспециализированный класс веществ белковой природы, используемый живыми организмами для осуществления с высокой скоростью многих тысяч взаимосвязанных химических реакций, включая синтез, распад и взаимопревращение огромного множества разнообразных химических соединений.
По специфичности действия ферменты делят на 2 группы: обладающие абсолютной специфичностью и относительной специфичностью.
Относительная (групповая) специфичность наблюдается, когда фермент катализирует реакции одного типа с более чем одним структуроподобным субстратом. Например, пепсин расщепляет белки животного происхождения, хотя они могут различаться друг от друга как по химическому строению, так и по свойствам. Однако он не расщепляет углеводы, так как местом действия пепсина является пептидная связь. Действие этих ферментов распространяется на большое число субстратов, что позволяет организму обойтись небольшим числом пищеварительных ферментов - иначе их потребовалось бы намного больше.
Абсолютная специфичность проявляется тогда, когда фермент действует лишь на одно – единственное вещество и катализирует лишь определенное превращение данного вещества. Например: фермент уреаза катализирует гидролиз мочевины; сахараза - катализирует превращение только сахарозы.
Стереоспецифичность - фермент катализирует превращение только одного из возможных стереоизомеров субстрата.
1. Оксидоредуктазы
Катализируют окислительно-восстановительные реакции. В реакцию вступают 2 вещества и 2 образуются, одно окисляется, другое восстанавливается: Sвост + S’окисл ↔ S’вост + Sокисл
Оксидоредуктазы делятся на: дегидрогеназы (отщепляют Н от субстратов), оксидазы (пе-реносят Н с субстрата на кислород), оксигеназы (включают кислород в молекулу субстра-та), гидроксипероксидазы (разрушают перекиси водорода и органические перекиси).
Систематическое название включает в себя название донора е и Н+ через двоеточие назва-ние акцептора через тире – название класса: донор: акцептор ( косубстрат) оксидоре-дуктаза
Систематическое название: Алкоголь: НАД+ оксидоредуктаза
Тривиальное название: алкогольдегидрогеназа
2. Трансферазы
Ферменты этого класса принимают участие в переносе атомных групп, молекулярных остатков от одного соединения к другому. В реакцию вступают 2 вещества и 2 образуют-ся: S-G + S’ ↔ S + S’-G.
В зависимости от переносимых групп трансферазы делятся на: 1). фосфотрансферазы (ки-назы); 2). аминотрансферазы; 3). гликозилтрансферазы; 4). метилтрансферазы; 5). аци-лтрансферазы.
Систематическое название: откуда: куда в какое положение–что–трансфераза
или донор: акцептор–транспортируемая группа– трансфераза
Систематическое название: АТФ: D-гексоза-6-фосфотрансфераза
Тривиальное название: гексокиназа
3. Гидролазы. Расщепляют ковалентную связь с присоединением молекулы воды.
В реакцию вступают 2 вещества и 2 образуются: S-G + Н2О ↔ S-ОН + G-Н.
В зависимости от характера гидролизуемой связи, различают подклассы: 1). гликозидазы – гидролиз гликозидов (лактоза – лактаза, мальтоза – мальтаза, сахароза – сахараза); 2). пеп-тидазы – гидролиз пептидных связей; 3). эстеразы – разрыв связи в сложных эфирах.
Систематическое название субстрат–что отщепляется–гидролаза
или субстрат–гидролаза
Систематическое название: Ацетилхолин-ацилгидролаза (Ацетилхолин-гидролаза)
Тривиальное название: Ацетилхолинэстераза
4. Лиазы
Отщепление групп от субстратов по негидролитическому механизму с образованием двойных связей (или наоборот, присоединение по двойной связи). Реакции обратимы, за исключением отщепления СО2.
В реакцию вступает 1 вещество и 2 образуются (или наоборот): -SХ-SY- ↔ XY + -S=S-
Систематическое название субстрат: что отщепляется–лиаза
Систематическое название: L-малат: гидро–лиаза
Тривиальное название: фумараза
5. Изомеразы
Взаимопревращения оптических, геометрических, позиционных изомеров. В реакцию вступает 1 вещество и 1 образуется. Исходя из типа катализируемой реакции изомериза-ции выделяется несколько подклассов: 1) рацемазы; 2) эпимеразы; 3) таутамеразы; 4) цис,- трансизомеразы; 5) мутазы (при внутримолекулярном переносе группы); 6) цикло-, оксо-изомеразы.
Систематическое название субстрат–вид изомеризации–изомераза или субстрат–продукт–изомераза
Систематическое название: фумарат–цис,транс–изомераза
6. Лигазы (синтетазы)
Соединение 2 молекул с использованием энергии макроэргических соединений (АТФ и др). В реакцию вступают 3 вещества, образуется 3 вещества.
Систематическое название субстрат: субстрат–лигаза (источник энергии)
Систематическое название: L-глутамат: аммиак–лигаза (АТФ → АДФ + Фн)
Тривиальное название: глутаминсинтетаза
Как и другие функциональные белки, ферменты делятся на простые и сложные. Простые ферменты — это простые белки, они построены из аминокислот и при гидролизе распадаются только на аминокислоты. Сложные ферменты — это сложные белки, они состоят из простого белка и небелкового компонента. При их гидролизе, помимо свободных аминокислот, освобождается небелковая часть или продукты её распада.
Белковая часть сложного фермента получила название апофермент, небелковая часть — кофактор. Кофакторы могут иметь разную химическую природу и отличаться по прочности связи с апоферментом. В роли кофактора могут выступать ионы различных металлов, а также другие неорганические ионы.
Органические вещества неаминокислотной природы, используемые в роли кофакторов, называются коферментами. Кофермент вместе с апоферментом образуют холофермент.
Кофермент + Апофермент ↔ Холофермент
В некоторых случаях в условиях живой клетки равновесие в этой реакции сильно сдвинуто вправо и кофермент прочно связан со своей белковой частью, они не разделяются при выделении и очистке. Такой кофермент называется простетической группой.
Следует отметить одну отличительную особенность сложных ферментов, заключающуюся в том, что ни кофактор (в том числе кофермент), ни сам по себе апофермент каталитической активностью не обладают и только их объединение в единое целое обеспечивает быстрое протекание химической реакции.
Коферменты относятся к сложным органическим веществам, их молекулы значительно меньше по размеру, чем молекулы ферментов. Коферменты могут проникать через биологические мембраны, нагревание обычно не вызывает изменения их структуры.
Ферменты отличаются от небиологических катализаторов следующими свойствами: 1.Высокой эффективностью действия, скорость ферментативной реакции в 109 – 1012 раз выше. 2.Высокой специфичностью действия, способность выбирать определенноеS и катализировать специфическую реакцию. Благодаря действию ферментов реакции в клетке не беспорядочны, не перепутываются, а образуют строго определенные метаболические пути. 3.Мягкими условиями протекания ферментативной реакции. t=37, нормальное атмосферное давление, pH близкое к нейтральному. 4. Способностью к регуляции.
Участвующие в ферментативных реакциях молекулы субстратов часто имеют небольшие размеры по сравнению с молекулами ферментов, поэтому было высказано предположение, что при образовании фермент-субстратных комплексов в непосредственный контакт с молекулой субстрата, очевидно, вступает ограниченная часть аминокислот пептидной цепи. Отсюда возникло представление об активном центре фермента. Под активным центром подразумевают уникальную комбинацию аминокислотных остатков в молекуле фермента, обеспечивающую непосредственное связывание ее с молекулой субстрата и прямое участие в акте катализа. Установлено, что у сложных ферментов в состав активного центра входят также просте-тические группы.
В активном центре условно различают так называемый каталитический центр, непосредственно вступающий в химическое взаимодействие с субстратом, и связывающий центр, или контактную («якорную») площадку, которая обеспечивает специфическое сродство к субстрату и формирование его комплекса с ферментом. В свою очередь молекула субстрата также содержит функционально различные участки: например, субстраты эстераз или протеиназ – одну специфическую связь (или группу атомов), подвергающуюся атаке со стороны фермента, и один или несколько участков, избирательно связываемых ферментом.
аллостерический центр (или центры), представляющий собой участок молекулы фермента, с которым связываются определенные, обычно низкомолекулярные, вещества (эффекторы, или модификаторы), молекулы которых отличаются по структуре от субстратов. Присоединение эффектора к аллостерическому центру изменяет третичную и часто также четвертичную структуру молекулы фермента и соответственно конфигурацию активного центра, вызывая снижение или повышение энзиматической активности. Ферменты, активность каталитического центра которых подвергается изменению под влиянием аллостерических эффекторов, связывающихся с аллостерическим центром, получили название аллостерических ферментов.
Механизм действия:
После установления химической природы ферментов подтвердилось представление, выдвинутое более 80 лет назад В. Анри, Л. Михаэлисом и М. Ментен, о том, что при энзиматическом катализе фермент Е соединяется (в принципе обратимо) со своим субстратом S, образуя нестойкий промежуточный фермент-субстратный комплекс ES, который в конце реакции распадается с освобождением фермента и продуктов реакции Р. Благодаря высокому сродству связывания и образованию ES-комплекса резко возрастает число молекул субстрата, вступающих в реакции. Эти представления легли в основу теории «ключа-замка» Э. Фишера, которую иногда называют теорией «жесткой матрицы». Таким образом, жесткая структура активного центра оказывается комплементарной молекулярной структуре субстрата, обеспечивая тем самым высокую специфичность фермента. Л. Михаэлис не только постулировал образование промежуточного фермент-субстратного ES-комплекса, но и рассчитал влияние концентрации субстрата на скорость реакции. В процессе реакции различают несколько стадий: присоединение молекулы субстрата к ферменту, преобразование первичного промежуточного соединения в один или несколько последовательных (переходных) комплексов и протекающее в одну или несколько стадий отделение конечных продуктов реакции от фермента.
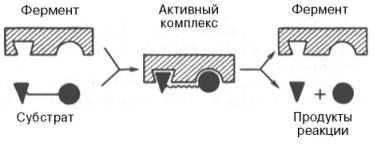
В образовании фермент-субстратных комплексов участвуют водородные связи, электростатические и гидрофобные взаимодействия, а в ряде случаев также ковалентные, координационные связи. Для каталитической активности фермента существенное значение имеет пространственная структура, в которой жесткие участки α-спиралей чередуются с гибкими, эластичными линейными отрезками, обеспечивающими динамические изменения белковой молекулы фермента. Ферменты, с термодинамической точки зрения, ускоряют химические реакции за счет снижения энергии активации . Энергией активации называется энергия, необходимая для перевода всех молекул моля вещества в активированное состояние при данной температуре. Другими словами, это энергия, необходимая для запуска химической реакции, без которой реакция не начинается несмотря на ее термодинамическую вероятность. Фермент снижает энергию активации путем увеличения числа активированных молекул, которые становятся реакционноспособными на более низком энергетическом уровне
