
- •1 Вопрос
- •2 Вопрос
- •3 Вопрос
- •4 Вопрос
- •5 Вопрос
- •6 Вопрос
- •7 Вопрос
- •8 Вопрос
- •9 Вопрос
- •10 Вопрос
- •11 Вопрос
- •12 Вопрос
- •13 Вопрос
- •14 Вопрос
- •15 Вопрос
- •16 Вопрос
- •17 Вопрос
- •18 Вопрос
- •19 Вопрос
- •20 Вопрос
- •1. Последовательность реакций цитратного цикла
- •21 Вопрос
- •28 Вопрос
- •31 Вопрос
- •32 Вопрос
- •33 Вопрос
- •36 Вопрос
- •1. Теория оперона
- •37 Вопрос
- •38 Вопрос
- •39 Вопрос
- •40 Вопрос
- •41 Вопрос
- •3. Биологическое значение трансаминирования
- •42 Вопрос
- •43 Вопрос
- •1. Реакции синтеза мочевины
- •3. Биологическая роль орнитинового цикла Кребса-Гензелейта
- •44 Вопрос
- •45 Вопрос
- •46 Вопрос
- •1. Пути метаболизма серина и глицина
- •3. Образование и использование одноуглеродных фрагментов
- •47 Вопрос
- •48 Вопрос
- •49 Вопрос
- •51 Вопрос
- •52 Вопрос
- •53 Вопрос
- •54 Вопрос
- •55 Вопрос
- •56 Вопрос
- •57 Вопрос
- •58 Вопрос
- •59 Вопрос
- •60 Вопрос
- •61 Вопрос
- •62 Вопрос
- •63 Вопрос
- •64 Вопрос
- •1. Подтип iIa:
- •2. Подтип iIb:
- •1. Ан‑α‑липопротеинемия (танжерская болезнь).
- •2. А‑β‑липопротеинемия.
- •65 Вопрос
- •67 Вопрос
- •68 Вопрос
- •69 Вопрос
- •70 Вопрос
- •71 Вопрос
- •72 Вопрос
- •73 Вопрос
- •74 Вопрос
- •75 Вопрос
- •76 Вопрос
- •77 Вопрос
- •78 Вопрос
- •79 Вопрос
- •80 Вопрос
- •81 Вопрос
- •82 Вопрос
- •83 Вопрос
- •84 Вопрос
- •85 Вопрос
- •86 Вопрос
- •1. Синтез и секреция катехоламинов
- •2. Механизм действия и биологические функции катехоламинов
- •3. Патология мозгового вещества надпочечников
- •2. Биологические функции инсулина
- •1. Инсулинзависимый сахарный диабет
- •91 Вопрос
- •92 Вопрос
- •1. Синтез и секреция антидиуретического гормона
- •2. Механизм действия
- •3. Несахарный диабет
- •1. Механизм действия альдостерона
- •98 Вопрос
- •99 Вопрос
- •101 Вопрос
- •102 Вопрос
- •103 Вопрос
- •106 Вопрос
- •107 Вопрос
- •112 Вопрос
- •113 Вопрос
- •114 Вопрос
- •1. Основные ферменты микросомальных электронтранспортных цепей
- •1. Участие трансферам в реакциях конъюгации
- •115 Вопрос
- •116 Вопрос
- •Анаэробные пути ресинтеза атф
- •117 Вопрос
- •118 Вопрос
- •122 Вопрос
- •123 Вопрос
- •124 Вопрос
36 Вопрос
Биохимические основы биологической эволюции, наследственности и изменчивости. Теория оперона. Схема Жакоба и Мано. Особенности регуляции генов у про- и эукариотов, характеристика процессов индукции и репрессии. Роль энхансеров (усилителей) и селенсеров (тушителей), амплификации (увеличение копий) и перестройки генов, процессинга, транспорта из ядра в цитоплазму и изменение стабильности мРНК в регуляции синтеза белков у эукариотов-основа онтогенеза и специализации органов и тканей организма.
Организмы адаптируются к меняющимся условиям окружающей среды путём изменения экспрессии (скорости транскрипции) генов. Этот процесс, в деталях изученный на бактериях и вирусах, включает взаимодействие специфических белков с участками ДНК в непосредственной близости от стартового участка транскрипции. При этом может происходить включение или выключение транскрипции. Эукариотические клетки используют тот же самый принцип, хотя в регуляции реализуются и некоторые другие более сложные механизмы.
Регуляция активности генов у прокариотов. Теория оперона
Исследования на клетках Е. coli позволили установить, что у бактерий существуют ферменты 3 типов:
конститутивные, присутствующие в клетках в постоянных количествах независимо от метаболического состояния организма (например, ферменты гликолиза);
индуцируемые, их концентрация в обычных условиях мала, но может возрастать в 100Q раз и более, если, например, в среду культивирования клеток добавить субстрат такого фермента;
репрессируемые, т.е. ферменты метаболических путей, синтез которых прекращается при добавлении в среду выращивания конечного продукта этих путей.
1. Теория оперона
На основании
генетических исследований индукции
β-галактозидазы, участвующей в клетках Е.
coli, в
гидролитическом расщеплении лактозы(рис),
Франсуа Жакоб и Жак Моно в 1961 г.
сформулировали гипотезу оперона, которая
объясняла механизм контроля синтеза
белков у прокариотов.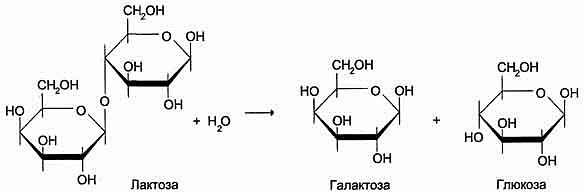
В экспериментах гипотеза оперона получила полное подтверждение, а предложенный в ней тип регуляции стали называть контролем синтеза белка на уровне транскрипции, так как в этом случае изменение скорости синтеза белков осуществляется за счёт изменения скорости транскрипции генов, т.е. на стадии образования мРНК.
Согласно теории Ф. Жакоба и Ж. Моно, в биосинтезе белка у бактерий участвуют по крайней мере 3 типа генов:структурные гены, ген-регулятор и ген-оператор. Структурные гены определяют первичную структуру синтезируемого белка. Именно эти гены в цепи ДНК являются основой для биосинтеза мРНК, которая затем поступает в рибосому и, как было указано, служит матрицей для биосинтеза белка.
Синтез мРНК на структурных генах молекулы ДНК непосредственно контролируется определенным участком, называемым геном-оператором. Он служит как бы пусковым механизмом для функционирования структурных генов. Ген-оператор локализован на крайнем отрезке структурного гена или структурных генов, регулируемых им. «Считывание» генетического кода, т.е. формирование мРНК, начинается с промотора – участка ДНК, расположенного рядом с геном-оператором и являющегося точкой инициации для синтеза мРНК, и распространяется последовательно вдоль оператора и структурных генов. Синтезированную молекулу мРНК, кодирующую синтез нескольких разных белков, принято называть полигенным (полицистронным) транскриптом. Координированный одним оператором одиночный ген или группа структурных генов образует оперон.
В свою очередь деятельность оперона находится под контролирующим влиянием другого участка цепи ДНК, получившего названиегена-регулятора. Структурные гены и ген-регулятор расположены в разных участках цепи ДНК, поэтому связь между ними, как предполагают Ф. Жакоб и Ж. Моно, осуществляется при помощи вещества-посредника, оказавшегося белком и названного репрессором. Образование репрессора происходит в рибосомах ядра на матрице специфической мРНК, синтезированной на гене-регуляторе.Репрессор имеет сродство к гену-оператору и обратимо соединяется с ним в комплекс. Образование такого комплекса приводит к блокированию синтеза мРНК и, следовательно, синтеза белка, т.е. функция гена-регулятора состоит в том, чтобы через белок-репрессор прекращать (запрещать) деятельность структурных генов, синтезирующих мРНК. Репрессор, кроме того, обладает способностью строго специфически связываться с определенными низкомолекулярными веществами, называемыми индукторами, или эффекторами. Если такой индуктор соединяется с репрессором, то последний теряет способность связываться с геном-оператором, который, таким образом, выходит из-под контроля гена-регулятора, и начинается синтез мРНК. Это типичный пример отрицательной формы контроля, когда индуктор, соединяясь с белком-репрессором, вызывает изменения его третичной структуры настолько, что репрессор теряет способность связываться с геном-оператором. Процесс этот аналогичен взаимоотношениям аллостерического центра фермента с эффектором, под влиянием которого изменяется третичная структура фермента и он теряет способность связываться со своим субстратом.
Таким образом, биосинтез мРНК, контролирующий синтез белка в рибосомах, зависит от функционального состояниярепрессора. Если он находится в активном состоянии, т.е. не связан с индуктором, то блокирует ген-оператор и синтеза мРНК не происходит. При поступлении метаболита – индуктора – в клетку его молекулы связывают репрессор, превращая его в неактивную форму (или, возможно, снижают его сродство к гену-оператору). Структурные гены выходят из-под запрещающего контроля и начинают синтезировать нужную мРНК.
Регуляция экспрессии активности генов у эукариот осуществляется значительно более сложным путем, поскольку процессы транскрипции и трансляции разделены не только пространственно ядерной биомембраной, но и во времени. Эта регуляция базируется как минимум на 6 уровнях сложных биологических процессов, определяющих скорость синтеза и распада генетического продукта.
Для большинства эукариотических клеток, как и клетокпрокариот, стадия инициации транскрипцииявляется основной, главной регуляторной точкой экспрессии активностигенов. Тем не менее имеются существенные различия: во-первых, место процессов транскрипции (в ядре) и трансляции(в цитоплазме); во-вторых, активирование транскрипции у эукариот связано с множеством сложных изменений структуры хроматинав транскрибируемой области; в-третьих, в эукариотических клеткахпревалируют положительные регуляторные механизмы над отрицательными.
Положительная или отрицательная регуляция определяется типом белков, вовлеченных в механизм регуляции. Получены доказательства существования минимум 3 типов белков, участвующих в регуляции процесса инициациитранскрипции, опосредованного черезРНК-полимеразу: специфические факторы, репрессоры(сайленсеры)и активаторы(энхансеры). Первые вызывают изменениеспецифичностиРНК-полимеразык данному промотору или группе промоторов; репрессоры связываются спромотором, блокируя тем самым доступРНК-полимеразыкпромотору;активаторы, напротив, связываются вблизи промоторного участка, повышая связываниепромотораи РНК-полимеразы.
Амплификация (или увеличение числа) генов используется организмом в том случае, когда возникает необходимость увеличить синтез определённого генного продукта. Многие гены, кодирующие белки или РНК, необходимые организму в больших количествах (например, гистоны, рРНК, тРНК), постоянно присутствуют в амплифицированном состоянии.
Перестройка генов
У высших организмов, так же как и у прокариотов, отмечают процесс обмена, перемещения генов между хромосомами или внутри хромосомы, объединение генов с образованием изменённой хромосомы, которая после таких структурных изменений способна к репликации и транскрипции. Этот процесс получил название "генетическая рекомбинация".
У эукариотов рекомбинации наблюдают:
при половом слиянии яйцеклетки и сперматозоида;
при перемещении подвижных генетических элементов - транспозонов, в состав которых входят отдельные гены или группа генов, с исходной позиции в какое-либо другое место той же или другой хромосомы;
при формировании в лимфоцитах "библиотеки" генов, кодирующих антитела или иммуноглобулины.
В организме животных существенное значение в обеспечении разнообразия белков играет посттранскрипционный процессинг РНК. Основные способы такой регуляции - альтернативный сплайсинг и изменение стабильности РНК.
Альтернативный сплайсинг. Установлено, что многие эукариотические гены, будучи транскрибированы, образуют несколько вариантов зрелой мРНК в ходе процессинга (или созревания) первичного транскрипта, имеющего полиэкзонное строение.
Наиболее часто промотор сохраняется на одном из концов транскрипта, а в ходе сплайсинга происходит "вырезание" одного или нескольких экзонов. В других случаях в зрелой мРНК сохраняется часть интрона и включается в состав экзона с 5' или 3'-конца. Сплайсинг может влиять на выбор промотора или участка полиаденилирования.
С помощью альтернативного сплайсинга в процессе синтеза антител образуются мембраносвязанные и секреторные формы антител
"Редактирование" РНК. Описан ряд случаев, когда первичная структура мРНК изменяется ("редактируется") после транскрипции. Последовательность нуклеотидов в таких генах одинакова, а транскрибируемая в разных тканях мРНК различается в результате появления в молекуле замен, вставок или выпадений нуклеотидов. Пример "редактирования" РНК - образование апопротеина В (апо-В) в клетках печени и тонкого кишечника.
Изменение стабильности мРНК. Для того, чтобы участвовать в синтезе белка, мРНК должна выйти из ядра в цитоплазму через ядерные поры. Установлено, что в ядре клеток обычно синтезируется больший набор гетерогенных РНК, чем тот, что выходит в цитоплазму. Многие продукты транскрипции подвергаются расщеплению нуклеазами, а те мРНК, что, транспортируются из ядра в цитоплазму, защищаются от гидролитического разрушения, образуя комплексы с белками.
Время жизни эукариотических мРНК значительно больше (t1/2 составляет от нескольких часов до нескольких дней), чем t1/2 мРНК прокариотов, равное нескольким минутам. Очевидно, что стабильность молекул мРНК - фактор, изменение которого влияет на уровень трансляции. Стабилизация мРНК при фиксированной скорости транскрипции приводит к накоплению и увеличению количества образующегося белкового продукта.
Описано много примеров регуляции количества синтезирующихся белков за счёт изменения продолжительности функционирования мРНК. Так, стабильность мРНК-матриц для синтеза молекул гистонов сильно зависит от фазы клеточного цикла. В S-фазе гистоны постоянно синтезируются и используются для укладки вновь образованной ДНК в нуклеосомы. Гистоновая мРНК в этот период стабильна в течение нескольких часов. После S-периода, когда ДНК уже не синтезируется, в клетках образуется небольшое количество гистонов, так как они не требуются для формирования нуклеосом. В этот период t1/2 для гистоновой мРНК составляет 10-15 мин.
