
- •1 Вопрос
- •2 Вопрос
- •3 Вопрос
- •4 Вопрос
- •5 Вопрос
- •6 Вопрос
- •7 Вопрос
- •8 Вопрос
- •9 Вопрос
- •10 Вопрос
- •11 Вопрос
- •12 Вопрос
- •13 Вопрос
- •14 Вопрос
- •15 Вопрос
- •16 Вопрос
- •17 Вопрос
- •18 Вопрос
- •19 Вопрос
- •20 Вопрос
- •1. Последовательность реакций цитратного цикла
- •21 Вопрос
- •28 Вопрос
- •31 Вопрос
- •32 Вопрос
- •33 Вопрос
- •36 Вопрос
- •1. Теория оперона
- •37 Вопрос
- •38 Вопрос
- •39 Вопрос
- •40 Вопрос
- •41 Вопрос
- •3. Биологическое значение трансаминирования
- •42 Вопрос
- •43 Вопрос
- •1. Реакции синтеза мочевины
- •3. Биологическая роль орнитинового цикла Кребса-Гензелейта
- •44 Вопрос
- •45 Вопрос
- •46 Вопрос
- •1. Пути метаболизма серина и глицина
- •3. Образование и использование одноуглеродных фрагментов
- •47 Вопрос
- •48 Вопрос
- •49 Вопрос
- •51 Вопрос
- •52 Вопрос
- •53 Вопрос
- •54 Вопрос
- •55 Вопрос
- •56 Вопрос
- •57 Вопрос
- •58 Вопрос
- •59 Вопрос
- •60 Вопрос
- •61 Вопрос
- •62 Вопрос
- •63 Вопрос
- •64 Вопрос
- •1. Подтип iIa:
- •2. Подтип iIb:
- •1. Ан‑α‑липопротеинемия (танжерская болезнь).
- •2. А‑β‑липопротеинемия.
- •65 Вопрос
- •67 Вопрос
- •68 Вопрос
- •69 Вопрос
- •70 Вопрос
- •71 Вопрос
- •72 Вопрос
- •73 Вопрос
- •74 Вопрос
- •75 Вопрос
- •76 Вопрос
- •77 Вопрос
- •78 Вопрос
- •79 Вопрос
- •80 Вопрос
- •81 Вопрос
- •82 Вопрос
- •83 Вопрос
- •84 Вопрос
- •85 Вопрос
- •86 Вопрос
- •1. Синтез и секреция катехоламинов
- •2. Механизм действия и биологические функции катехоламинов
- •3. Патология мозгового вещества надпочечников
- •2. Биологические функции инсулина
- •1. Инсулинзависимый сахарный диабет
- •91 Вопрос
- •92 Вопрос
- •1. Синтез и секреция антидиуретического гормона
- •2. Механизм действия
- •3. Несахарный диабет
- •1. Механизм действия альдостерона
- •98 Вопрос
- •99 Вопрос
- •101 Вопрос
- •102 Вопрос
- •103 Вопрос
- •106 Вопрос
- •107 Вопрос
- •112 Вопрос
- •113 Вопрос
- •114 Вопрос
- •1. Основные ферменты микросомальных электронтранспортных цепей
- •1. Участие трансферам в реакциях конъюгации
- •115 Вопрос
- •116 Вопрос
- •Анаэробные пути ресинтеза атф
- •117 Вопрос
- •118 Вопрос
- •122 Вопрос
- •123 Вопрос
- •124 Вопрос
65 Вопрос
Синтез триацилглицеридов в печени и жировой ткани. Регуляция. Жировые депо организма. Ожирение, его виды.
Синтез жиров в жировой ткани и печени
Синтез жиров происходит в абсорбтивный период в печени и жировой ткани. Непосредственными субстратами в синтезе жиров являются ацил-КоА и глицерол-3-фосфат. Метаболический путь синтеза жиров в печени и жировой ткани одинаков, за исключением разных путей образования глицерол-3-фосфата.
Образование глицерол-3-фосфата
Синтез жиров в печени и жировой ткани идёт через образование промежуточного продукта - фосфатидной кислоты (рис. 8-21).
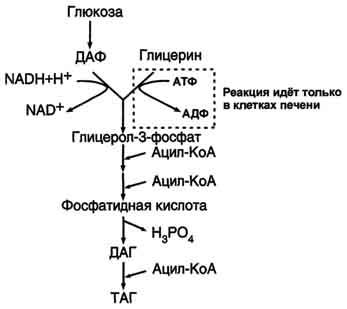
Предшественник фосфатидной кислоты - глицерол-3-фосфат, образующийся в печени двумя путями:
восстановлением дигидроксиацетонфосфата - промежуточного метаболита гликолиза;
фосфорилированием глицеролкиназой свободного глицерола, поступающего в печень из крови (продукт действия ЛП-липазы на жиры ХМ и ЛПОНП).
В жировой ткани глицеролкиназа отсутствует, и восстановление дигидроксиацетонфосфата - единственный путь образования глицерол-3-фосфата. Следовательно, синтез жиров в жировой ткани может происходить только в абсорбтивный период, когда глюкоза поступает в адипоциты с помощью белка-переносчика глюкозы ГЛЮТ-4, активного только в присутствии инсулина, и распадается по пути гликолиза.
Синтез жиров в жировой ткани
В жировой ткани для синтеза жиров используются в основном жирные кислоты, освободившиеся при гидролизе жиров ХМ и ЛПОНП (рис. 8-22). Жирные кислоты поступают в адипоциты, превращаются в производные КоА и взаимодействуют с глицерол-3-фосфатом, образуя сначала лизофосфатидную кислоту, а затем фосфатидную. Фосфатидная кислота после дефосфорилирования превращается в диацилглицерол, который ацилируется с образованием триацилглицерола.
Кроме жирных кислот, поступающих в адипоциты из крови, в этих клетках идёт и синтез жирных кислот из продуктов распада глюкозы. В адипоцитах для обеспечения реакций синтеза жира распад глюкозы идёт по двум путям: гликолиз, обеспечивающий образование глицерол-3-фосфата и ацетил-КоА, и пентозофосфатный путь, окислительные реакции которого обеспечивают образование NADPH, служащего донором водорода в реакциях синтеза жирных кислот.
Молекулы жиров в адипоцитах объединяются в крупные жировые капли, не содержащие воды, и поэтому являются наиболее компактной формой хранения топливных молекул. Подсчитано, что, если бы энергия, запасаемая в жирах, хранилась в форме сильно гидратированных молекул гликогена, то масса тела человека увеличилась бы на 14-15 кг.
Синтез ТАГ в печени. Образование ЛПОНП в печени и транспорт жиров в другие ткани
Печень - основной орган, где идёт синтез жирных кислот из продуктов гликолиза. В гладком ЭР гепатоцитов жирные кислоты активируются и сразу же используются для синтеза жиров, взаимодействуя с глицерол-3-фосфатом. Как и в жировой ткани, синтез жиров идёт через образование фосфатидной кислоты. Синтезированные в печени жиры упаковываются в ЛПОНП и сек-ретируются в кровь (рис. 8-23).
В состав ЛПОНП, кроме жиров, входят холестерол, фосфолипиды и белок - апоВ-100. Это очень "длинный" белок, содержащий 11 536 аминокислот. Одна молекула апоВ-100 покрывает поверхность всего липопротеина.
ЛПОНП из печени секретируются в кровь (рис. 8-23), где на них, как и на ХМ, действует ЛП-липаза. Жирные кислоты поступают в ткани, в частности в адипоциты, и используются для синтеза жиров. В процессе удаления жиров из ЛПОНП под действием ЛП-липазы ЛПОНП сначала превращаются в ЛГШП, а затем в ЛПНП. В ЛПНП основными липидными компонентами служат холестерол и его эфиры, поэтому ЛПНП являются липопротеинами, доставляющими холестерол в периферические ткани. Глицерол, освободившийся из липопротеинов, кровью транспортируется в печень, где опять может использоваться для синтеза жиров.
Скорость синтеза жирных кислот и жиров в печени существенно зависит от состава пищи. Если в пище содержится более 10% жиров, то скорость синтеза жиров в печени резко снижается.
Регуляция синтеза жиров. В абсорбтивный период при увеличении соотношения инсулин/глюкагон в печени активируется синтез жиров. В жировой ткани индуцируется синтез ЛП-липазы в адипоцитах и осуществляется её экспонирование на поверхность эндотелия; следовательно, в этот период увеличивается поступление жирных кислот в адипоциты. Одновременно инсулин активирует белки-переносчики глюкозы - ГЛЮТ-4. Поступление глюкозы в адипоциты и гликолиз также активируются. В результате образуются все необходимые компоненты для синтеза жиров: глицерол-3-фосфат и активные формы жирных кислот. В печени инсулин, действуя через различные механизмы, активирует ферменты путём дефосфорилирования и индуцирует их синтез. В результате увеличиваются активность и синтез ферментов, участвующих в превращении части глюкозы, поступающей с пищей, в жиры. Это - регуляторные ферменты гликолиза, пируватдегидрогеназный комплекс и ферменты, участвующие в синтезе жирных кислот из ацетил-КоА. Результат действия инсулина на обмен углеводов и жиров в печени - увеличение синтеза жиров и секреция их в кровь в составе ЛПОНП. ЛПОНП доставляют жиры в капилляры жировой ткани, где действие ЛП-липазы обеспечивает быстрое поступление жирных кислот в адипоциты, где они депонируются в составе триацилглицеринов.
Запасание жиров в жировой ткани - основная форма депонирования источников энергии в организме человека (табл. 8-6). Запасы жиров в организме человека массой 70 кг составляют 10 кг, но у многих людей количество жиров может быть значительно больше.
Жиры образуют в адипоцитах жировые вакуоли. Жировые вакуоли иногда заполняют значительную часть цитоплазмы. Скорость синтеза и мобилизации подкожного жира происходит неравномерно в разных частях организма, что связано с неодинаковым распределением рецепторов гормонов на адипоцитах.
Регуляция мобилизации жиров. Мобилизация депонированных жиров стимулируется глюкагоном и адреналином и, в меньшей степени, некоторыми другими гормонами (соматотроп-ным, кортизолом). В постабсорбтивный период и при голодании глюкагон, действуя на адипоциты через аденилатциклазную систему, активирует протеинкиназу А, которая фосфо-рилирует и, таким образом, активирует гормончувствительную липазу, что инициирует липо-лиз и выделение жирных кислот и глицерина в кровь. При физической активности увеличивается секреция адреналина, который действует через β-адренергические рецепторы адипоцитов, активирующие аденилатциклазную систему (рис. 8-24). В настоящее время обнаружено 3 типа β-рецепторов: β1, β2, β3, активация которых приводит к липолитическому действию. К наибольшему липолитическому действию приводит активация β3-рецепторов. Адреналин одновременно действует и на α2-рецепторы адипоцитов, связанные с ингибирующим G-белком, что инактивирует аденилатциклазную систему. Вероятно, действие адреналина двояко: при низких концентрациях в крови преобладает его антилиполитическое действие через α2-рецепторы, а при высокой - преобладает липолитическое действие через β-рецепторы.
Для мышц, сердца, почек, печени при голодании или физической работе жирные кислоты становятся важным источником энергии. Печень перерабатывает часть жирных кислот в кетоновые тела, используемые мозгом, нервной тканью и некоторыми другими тканями как источники энергии.
В результате мобилизации жиров концентрация жирных кислот в крови увеличивается приблизительно в 2 раза (рис. 8-25), однако абсолютная концентрация жирных кислот в крови невелика даже в этот период. Т1/2 жирных кислот в крови тоже очень мал (менее 5 мин), что означает существование быстрого потока жирных кислот из жировой ткани к другим органам. Когда постабсорбтивный период сменяется аборбтивным, инсулин активирует специфическую фосфатазу, которая дефосфорилирует гормончувствительную липазу, и распад жиров останавливается.
Нарушения жирового обмена. Oжирение
Жировая ткань составляет 20-25% от общей массы тела у женщин и 15-20% у мужчин. Однако избыточное накопление жира в адипоцитах (ожирение) широко распространено. Среди взрослого населения некоторых стран около 50% людей страдает ожирением. Ожирение - важнейший фактор риска развития инфаркта миокарда, инсульта, сахарного диабета, артериальной гипертензии и желчнокаменной болезни.
Ожирением считают состояние, когда масса тела превышает 20% от "идеальной" для данного индивидуума. Образование адипоцитов происходит ещё во внутриутробном состоянии, начиная с последнего триместра беременности, и заканчивается в препубертатный период. После этого жировые клетки могут увеличиваться в размерах при ожирении или уменьшаться при похудании, но их количество не изменяется в течение жизни.
Первичное ожирение
Первичное ожирение характеризуется множеством гормональных и метаболических особенностей у лиц, страдающих этим заболеванием. В самом общем виде можно сказать, что первичное ожирение развивается в результате алиментарного дисбаланса - избыточной калорийности питания по сравнению с расходами энергии. Суточные потребности организма в энергии складываются из:
основного обмена - энергии, необходимой для поддержания жизни; основной обмен измеряют по поглощению кислорода или выделению тепла человеком в состоянии покоя утром, после 12-часового перерыва в еде;
энергии, необходимой для физической активности.
Затраты энергии, необходимые для физической активности, разделяют на 3 уровня:
I - 30% энергии от основного обмена (у людей, ведущих сидячий образ жизни);
II - 60-70% от энергии основного обмена (у людей, которые 2 ч в день имеют умеренную физическую нагрузку);
III - 100% и более от энергии основного обмена (у людей, которые в течение нескольких часов в день занимаются тяжёлой физической работой).
В зависимости от интенсивности нагрузки и возраста суточная потребность в энергии колеблется у женщин от 2000 до 3000 ккал в день, а у мужчин - от 2300 до 4000 ккал.
Количество потребляемой пищи определяется многими факторами, в том числе и химическими регуляторами чувства голода и насыщения. Эти чувства определяются концентрацией в крови глюкозы и гормонов, которые инициируют чувство насыщения: холецистокинина, нейротензина, бомбезина, лептина. Причины первичного ожирения:
генетические нарушенвся (до 80% случаев ожирения - результат генетических нарушений);
состав и количество потребляемой пищи, метод питания в семье;
уровень физической активности;
психологические факторы.
Роль лептина в регуляции массы жировой ткани
У человека и животных имеется "ген ожирения" - obese gene (ob). Продуктом экспрессии этого гена служит белок лептин, состоящий из 167 аминокислот, который синтезируется и сек-ретируется адипоцитами и взаимодействует с рецепторами гипоталамуса. В результате его действия снижается секреция нейропептида Y. Нейропептид Y стимулирует пищевое поведение, поиск и потребление пищи у животных. Другие пептиды, участвующие в регуляции чувства сытости, например холецистокинин, также влияют на секрецию нейропептида Y. Таким опосредованным путём лептин выступает регулятором жировой массы, необходимой для роста и репродукции. Уровень лептина у больных ожирением может быть различным.
У 80% больных концентрация лептина в крови тучных людей больше в 4 раза, чем у людей с нормальной массой тела. В этих случаях имеется генетический дефект рецепторов лептина в гипоталамусе, поэтому, несмотря на продукцию лептина, центр голода в гипоталамусе продолжает секрецию нейропептида Y.
20% больных имеют изменения в первичной структуре лептина. К настоящему времени описаны 5 одиночных мутаций в гене лептина, которые приводят к развитию ожирения. У этих больных наблюдают повышение отложения жиров в жировой ткани, чрезмерное потребление пищи, низкую физическую активность и развитие сахарного диабета типа II. Патогенез ожирения при дефекте генаob может быть следующим: низкий уровень лептина в крови служит сигналом недостаточного количества запаса жиров в организме; этот сигнал включает механизмы, приводящие к увеличению аппетита и в результате к увеличению массы тела.
Следовательно, можно сделать вывод о том, что первичное ожирение - не просто следствие переедания, а результат действия многих факторов, т.е. ожирение - полигенное заболевание.
Вторичное ожирение - ожирение, развивающееся в результате какого-либо основного заболевания, чаще всего эндокринного. Например, к развитию ожирения приводят гипотиреоз, синдром Иценко-Кушинга, гипогонадизм и многие другие заболевания
66 вопрос
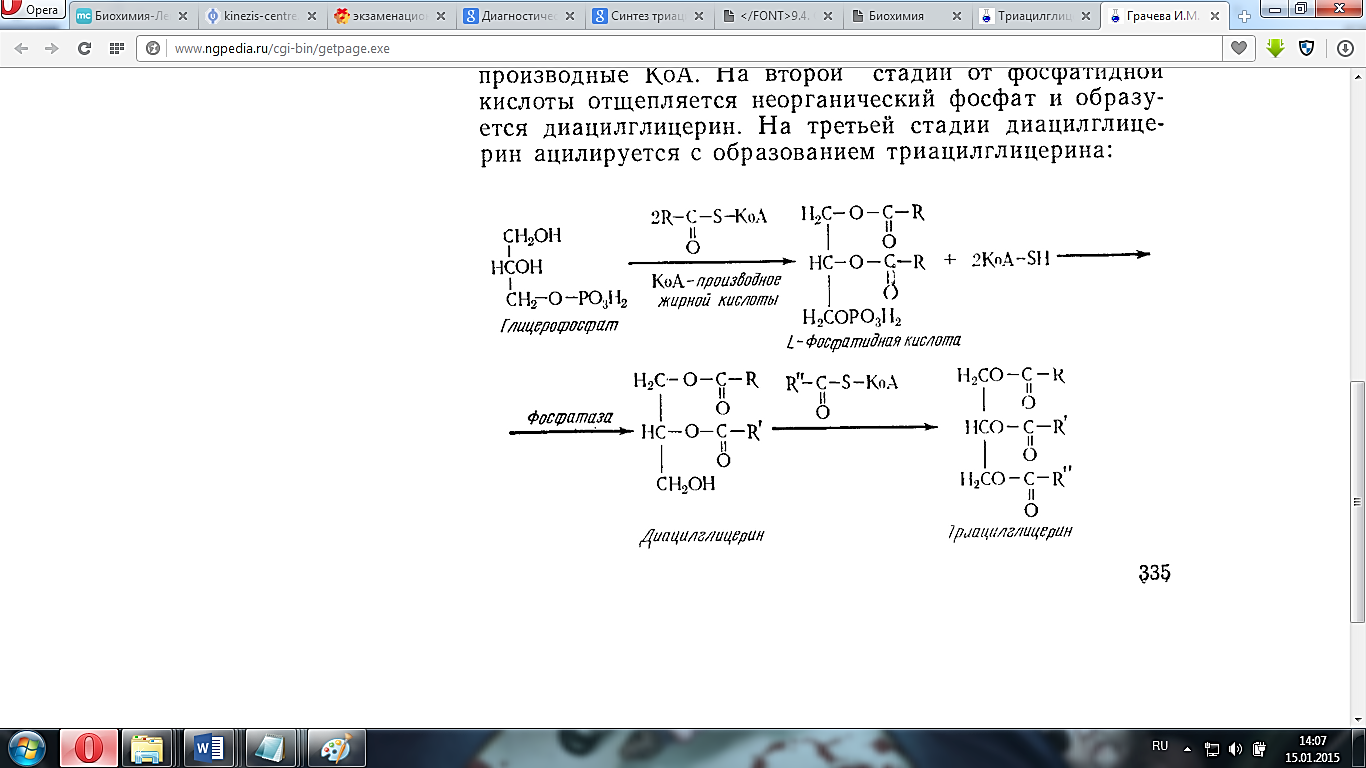
Биосинтез триацилглицеринов: ферменты,стадии процесса
Синтез
триглицеридов происходит из глицерина и жирных
кислот (главным
образом стеариновой, пальмитиновой и
олеиновой). Путь биосинтеза триглицеридов
в тканях протекает
через образование α-глице-рофосфата
(глицерол-3-фосфата) как промежуточного
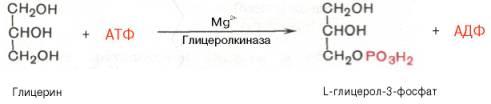
соединения. В почках, а также в стенке
кишечника, где активность
фермента глицеролкиназы
высока, глицеринфосфорилируется
за счет АТФ с
образованием глицерол-3-фосфата:
В жировой
ткани и
мышцах вследствие очень
низкой активности глицеролкиназы
образование глицерол-3-фосфата в основном
связано с процессами гликолиза и гликогенолиза.
Известно, что в процессе гликолитического
распадаглюкозы образуется
дигидроксиацетонфосфат (см. главу 10).
Последний в присутствии цитоплазматической
глицерол-3-фосфатдегидрогеназы способен
превращаться в глицерол-3-фосфат:

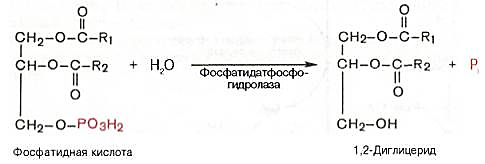
Далее
фосфатидная кислота гидролизуется
фосфатидат-фосфогидро-лазой до
1,2-диглицерида (1,2-диацилглицерола):
Затем
1,2-диглицерид ацилируется
третьей молекулой ацил-КоА
и превращается в триглицерид
(триацилглицерол). Эта реакция катализируется
диацилглицерол-ацилтрансферазой:

