
- •1 Вопрос
- •2 Вопрос
- •3 Вопрос
- •4 Вопрос
- •5 Вопрос
- •6 Вопрос
- •7 Вопрос
- •8 Вопрос
- •9 Вопрос
- •10 Вопрос
- •11 Вопрос
- •12 Вопрос
- •13 Вопрос
- •14 Вопрос
- •15 Вопрос
- •16 Вопрос
- •17 Вопрос
- •18 Вопрос
- •19 Вопрос
- •20 Вопрос
- •1. Последовательность реакций цитратного цикла
- •21 Вопрос
- •28 Вопрос
- •31 Вопрос
- •32 Вопрос
- •33 Вопрос
- •36 Вопрос
- •1. Теория оперона
- •37 Вопрос
- •38 Вопрос
- •39 Вопрос
- •40 Вопрос
- •41 Вопрос
- •3. Биологическое значение трансаминирования
- •42 Вопрос
- •43 Вопрос
- •1. Реакции синтеза мочевины
- •3. Биологическая роль орнитинового цикла Кребса-Гензелейта
- •44 Вопрос
- •45 Вопрос
- •46 Вопрос
- •1. Пути метаболизма серина и глицина
- •3. Образование и использование одноуглеродных фрагментов
- •47 Вопрос
- •48 Вопрос
- •49 Вопрос
- •51 Вопрос
- •52 Вопрос
- •53 Вопрос
- •54 Вопрос
- •55 Вопрос
- •56 Вопрос
- •57 Вопрос
- •58 Вопрос
- •59 Вопрос
- •60 Вопрос
- •61 Вопрос
- •62 Вопрос
- •63 Вопрос
- •64 Вопрос
- •1. Подтип iIa:
- •2. Подтип iIb:
- •1. Ан‑α‑липопротеинемия (танжерская болезнь).
- •2. А‑β‑липопротеинемия.
- •65 Вопрос
- •67 Вопрос
- •68 Вопрос
- •69 Вопрос
- •70 Вопрос
- •71 Вопрос
- •72 Вопрос
- •73 Вопрос
- •74 Вопрос
- •75 Вопрос
- •76 Вопрос
- •77 Вопрос
- •78 Вопрос
- •79 Вопрос
- •80 Вопрос
- •81 Вопрос
- •82 Вопрос
- •83 Вопрос
- •84 Вопрос
- •85 Вопрос
- •86 Вопрос
- •1. Синтез и секреция катехоламинов
- •2. Механизм действия и биологические функции катехоламинов
- •3. Патология мозгового вещества надпочечников
- •2. Биологические функции инсулина
- •1. Инсулинзависимый сахарный диабет
- •91 Вопрос
- •92 Вопрос
- •1. Синтез и секреция антидиуретического гормона
- •2. Механизм действия
- •3. Несахарный диабет
- •1. Механизм действия альдостерона
- •98 Вопрос
- •99 Вопрос
- •101 Вопрос
- •102 Вопрос
- •103 Вопрос
- •106 Вопрос
- •107 Вопрос
- •112 Вопрос
- •113 Вопрос
- •114 Вопрос
- •1. Основные ферменты микросомальных электронтранспортных цепей
- •1. Участие трансферам в реакциях конъюгации
- •115 Вопрос
- •116 Вопрос
- •Анаэробные пути ресинтеза атф
- •117 Вопрос
- •118 Вопрос
- •122 Вопрос
- •123 Вопрос
- •124 Вопрос
3. Биологическое значение трансаминирования
Реакции трансаминирования играют большую роль в обмене аминокислот. Поскольку этот процесс обратим, ферменты аминотрансферазы функционируют как в процессах катаболизма, так и биосинтеза аминокислот. Трансаминирование - заключительный этап синтеза заменимых аминокислот из соответствующих α-кетокислот, если они в данный момент необходимы клеткам. В результате происходит перераспределение аминного азота в тканях организма. Трансаминирование - первая стадия дезаминирования большинства аминокислот, т.е. начальный этап их катаболизма. Образующиеся при этом кетокислоты окисляются в ЦТК или используются для синтеза глюкозы и кетоновых тел. При трансаминировании общее количество аминокислот в клетке не меняется.
Диагностическое значение определения аминотрансфераз в клинической практике
В клинической практике широко используют определение активности ACT и АЛТ в сыворотке крови для диагностики некоторых заболеваний.
В норме в крови активность этих ферментов очень мала и составляет 5-40 Е/л. При повреждении клеток соответствующего органа ферменты выходят в кровь, где активность их резко повышается. Поскольку ACT и АЛТ наиболее активны в клетках печени, сердца и, в меньшей степени, скелетных мышц, их используют для диагностики болезней этих органов (см. раздел 2). В клетках сердечной мышцы количество ACT значительно превышает количество АЛТ, а в печени - наоборот. Поэтому особенно информативно одновременное измерение активности обоих ферментов в сыворотке крови. Соотношение активностей ACT/АЛТ называют "коэффициент де Ритиса". В норме этот коэффициент равен 1,33±0,42. При инфаркте миокарда активность ACT в крови увеличивается в 8-10 раз, а АЛТ - в 1,5-2,0 раза. Наиболее резко активность ACT увеличивается при некрозе ткани, так как выходит в кровь и цитоплазматическая и митохондриальная формы фермента. При инфаркте миокарда значение коэффициента де Ритиса резко возрастает.
При гепатитах активность АЛТ в сыворотке крови увеличивается в ∼8-10 раз по сравнению с нормой, a ACT - в 2-4 раза. Коэффициент де Ритиса снижается до 0,6. Однако при циррозе печени этот коэффициент увеличивается, что свидетельствует о некрозе клеток, при котором в кровь выходят обе формы ACT.
42 Вопрос
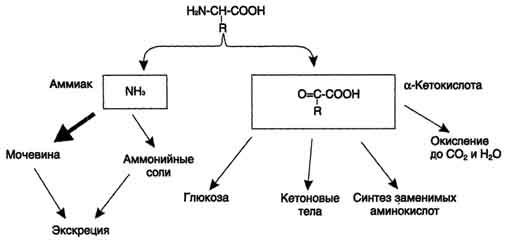
Прямое и непрямое окислительное дезаминирование аминокислот. Последовательность реакций, ферменты, биологическая роль.
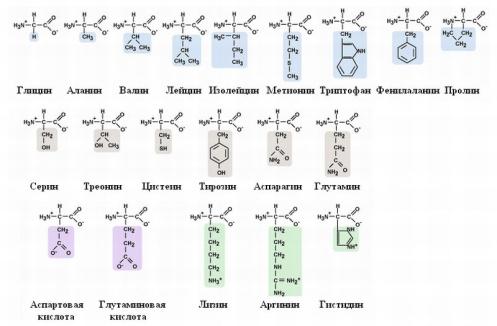
Поступление из крови, распад собственных внутриклеточных белков и синтез заменимых аминокислот.
Наибольшее количество свободных аминокислот поступает из мышц и кишечника, причем до 50% составляет глутамин и аланин. Основное кол-во глутамина поставляют в кровь мышцы и мозг. Из кровеносного русла его поглощают печень и почки, Где он подвергается действию глутаминазы. Почки – основной источник серина и частично аланина. Головной мозг способен поглощать и окислять большие кол-ва аминокислот с разветвленной боковой цепью(валин, лейцин, изолейцин).
Дезаминирование аминокислот – это реакция отщепления альфа-аминогруппы от аминокислоты, в результате чего образуется соответствующая альфа-кетокислота (безазотистый остаток) и выделяется молекула аммиака.
Существует несколько способов дезаминирования: окислительное, непрямое9трансдезаминирование), неокислительное, внутримолекулярное.
Окислительное дезаминирование наиболее активно идет на примере глутаминовой кислоты. Реакция идет в 2 этапа. В начале идет ферментативное дегидрирование глутамата образования альфа-эминоглутарата под действием глутаматдегидрогеназой (кофермент NAD), затем – неферментативное гидролитическое отщепление иминогруппы в виде аммиака, в результате чего образуется альфа-кетоглутарат.
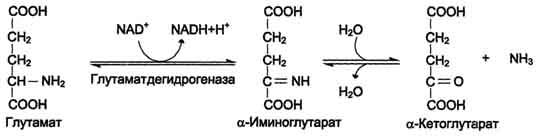
Окислительное дезаминирование глутамата – обратимая реакция и при повышении концентрации аммиака в клетке может протекать в обратном направлении, как восстановительное аминирование альфа-кетоглутарата. Глутаматдегидрогеназа – фермент, в печени и почках фермент L –аминокислота и D-аминокислота – способны к дезаминированию АК.
Непрямое дезаминирование (трансдезаминирование) – основной способ дезаминирования большинства аминокислот. В результате трансаминирования переносят аминогруппы АК на a-кетоглуторат с образованием глутаминовой кислоты, которая затем подвергается прямому окислению дезаминированию.
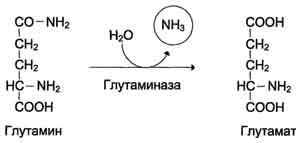
Обе стадии непрямого дезаминирования обратимы, что обеспечивает как катаболизм аминокислот, так и возможность образования практически любой аминокислоты из соответствующей альфа-кетакислоты.
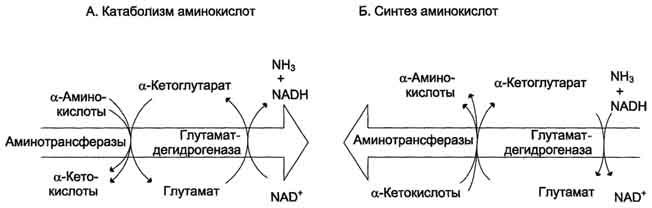
Реакции трансаминирования играют большую роль в обмене аминокислот. Поскольку этот процесс обратим, ферменты трансаминазы функционируют как в процессах катабализма, так и биосинтеза аминокислот. Трансаминирование – заключительный этап синтеза зменимых АК и первая стадия дезаминирования большинства АК. Трансаминазы классический пример ферментов, катализирующих реакции, протекающие по механизму типа пинг-понг В таких реакциях первый продукт должен уйти из активного центра фермента до того, как 2-ой субстрат сможет к нему присоединиться. В норме в крови активность трансаминаз очень мала. В клинической практике щироко используют определение активности АСТ и АЛТ для диагностики некоторых заболеваний. При повреждение клеток соответствующего органа ферменты приходят в кровь, где активность их резко повышается. Аспартатаминотрансфераза (АСТ) и аланинаминотрансфераза (АЛТ) наиболее активны в клетках печени, сердца и, в меньшей степени скелетных мышц, их используют для диагностики болезни этих органов. Соотношение активностей АСТ/АЛТ называют коэффициент де Ритиса (норм 1,33+-0,42).при инфаркте миокарда этот коэффициент резко возрастает, а при гепатитах снижается до 0,6, при циррозе увеличивается.
