
- •1 Вопрос
- •2 Вопрос
- •3 Вопрос
- •4 Вопрос
- •5 Вопрос
- •6 Вопрос
- •7 Вопрос
- •8 Вопрос
- •9 Вопрос
- •10 Вопрос
- •11 Вопрос
- •12 Вопрос
- •13 Вопрос
- •14 Вопрос
- •15 Вопрос
- •16 Вопрос
- •17 Вопрос
- •18 Вопрос
- •19 Вопрос
- •20 Вопрос
- •1. Последовательность реакций цитратного цикла
- •21 Вопрос
- •28 Вопрос
- •31 Вопрос
- •32 Вопрос
- •33 Вопрос
- •36 Вопрос
- •1. Теория оперона
- •37 Вопрос
- •38 Вопрос
- •39 Вопрос
- •40 Вопрос
- •41 Вопрос
- •3. Биологическое значение трансаминирования
- •42 Вопрос
- •43 Вопрос
- •1. Реакции синтеза мочевины
- •3. Биологическая роль орнитинового цикла Кребса-Гензелейта
- •44 Вопрос
- •45 Вопрос
- •46 Вопрос
- •1. Пути метаболизма серина и глицина
- •3. Образование и использование одноуглеродных фрагментов
- •47 Вопрос
- •48 Вопрос
- •49 Вопрос
- •51 Вопрос
- •52 Вопрос
- •53 Вопрос
- •54 Вопрос
- •55 Вопрос
- •56 Вопрос
- •57 Вопрос
- •58 Вопрос
- •59 Вопрос
- •60 Вопрос
- •61 Вопрос
- •62 Вопрос
- •63 Вопрос
- •64 Вопрос
- •1. Подтип iIa:
- •2. Подтип iIb:
- •1. Ан‑α‑липопротеинемия (танжерская болезнь).
- •2. А‑β‑липопротеинемия.
- •65 Вопрос
- •67 Вопрос
- •68 Вопрос
- •69 Вопрос
- •70 Вопрос
- •71 Вопрос
- •72 Вопрос
- •73 Вопрос
- •74 Вопрос
- •75 Вопрос
- •76 Вопрос
- •77 Вопрос
- •78 Вопрос
- •79 Вопрос
- •80 Вопрос
- •81 Вопрос
- •82 Вопрос
- •83 Вопрос
- •84 Вопрос
- •85 Вопрос
- •86 Вопрос
- •1. Синтез и секреция катехоламинов
- •2. Механизм действия и биологические функции катехоламинов
- •3. Патология мозгового вещества надпочечников
- •2. Биологические функции инсулина
- •1. Инсулинзависимый сахарный диабет
- •91 Вопрос
- •92 Вопрос
- •1. Синтез и секреция антидиуретического гормона
- •2. Механизм действия
- •3. Несахарный диабет
- •1. Механизм действия альдостерона
- •98 Вопрос
- •99 Вопрос
- •101 Вопрос
- •102 Вопрос
- •103 Вопрос
- •106 Вопрос
- •107 Вопрос
- •112 Вопрос
- •113 Вопрос
- •114 Вопрос
- •1. Основные ферменты микросомальных электронтранспортных цепей
- •1. Участие трансферам в реакциях конъюгации
- •115 Вопрос
- •116 Вопрос
- •Анаэробные пути ресинтеза атф
- •117 Вопрос
- •118 Вопрос
- •122 Вопрос
- •123 Вопрос
- •124 Вопрос
39 Вопрос
Гниение белков (аминокислот) в толстом кишечнике. Механизмы обезвреживания образующихся продуктов (фенол, крезол, индол, скатол) в печени.
Аминокислоты, невсосавшиеся в клетки кишечника, используются микрофлорой толстой кишки в качестве питательных веществ. Ферменты бактерий расщепляют аминокислоты и превращают их в амины, фенолы, индол, скатол, сероводород и другие ядовитые для организма соединения. Этот процесс иногда называют гниением белков в кишечнике. В основе гниения лежат реакции декарбоксилирования и дезаминирования аминокислот.
Образование
и обезвреживание n-крезола и фенола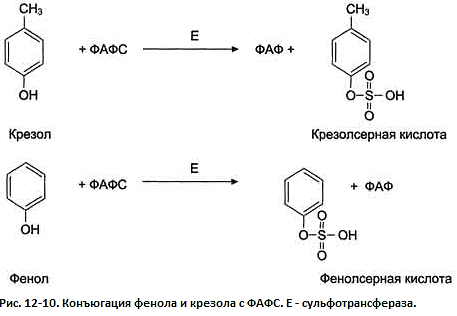
Под
действием ферментов бактерий из
аминокислоты тирозина могут образовываться
фенол и крезол путём разрушения боковых
цепей аминокислот микробами (рис. 12-9).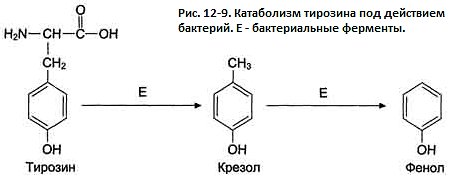
Всосавшиеся продукты по воротной вене поступают в печень, где обезвреживание фенола и крезола может происходить путём конъюгации с сернокислотным остатком (ФАФС=З-фосфоаденозин-5-фосфосульфат) или с глюкуроновой кислотой в составе УДФ-глюкуроната. Реакции конъюгации фенола и крезола с ФАФС катализирует фермент сульфотрансфераза (рис. 12-10).
Конъюгация
глюкуроновых кислот с фенолом и крезолом
происходит при участии фермента
УДФ-глюкуронилтрансферазы (рис. 12-11).
Продукты конъюгации хорошо растворимы
в воде и выводятся с мочой через почки.
Повышение количества конъюгатов
глюкуроновой кислоты с фенолом и крезолом
обнаруживают в моче при увеличении
продуктов гниения белков в кишечнике.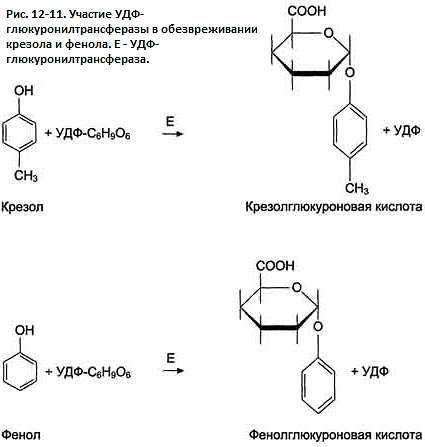
Образование и обезвреживание индола и скатола
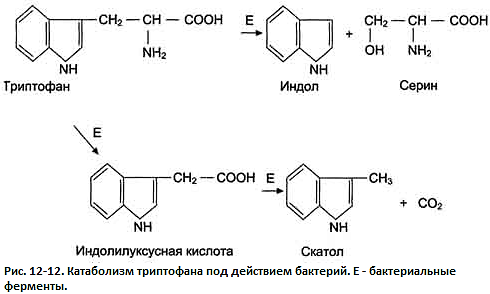
В кишечнике из аминокислоты триптофана микроорганизмы образуют индол и скатол. Бактерии разрушают боковую цепь триптофана, оставляя нетронутой кольцевую структуру.
Индол образуется в результате отщепления бактериями боковой цепи, возможно, в виде серина или аланина (рис. 12-12).
Скатол
и индол обезвреживаются в печени в 2
этапа. Сначала в результате микросомального
окисления они приобретают гидроксильную
группу. Так, индол переходит в индоксил,
а затем вступает в реакцию конъюгации
с ФАФС, образуя индоксилсерную кислоту,
калиевая соль которой получила название
животного индикана (рис. 12-13).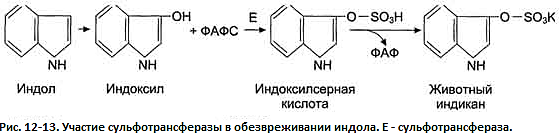
Обезвреживание
бензойной кислоты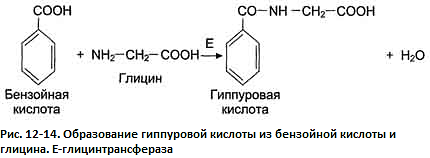
Синтез гиппуровой кислоты из бензойной кислоты и глицина протекает у человека и большинства животных преимущественно в печени (рис. 12-14). Скорость этой реакции отражает функциональное состояние печени.
В клинической практике используют определение скорости образования и выведения гиппуровой кислоты после введения в организм ксенобиотика бензойной кислоты (бензойнокислого натрия) - проба Квика.
40 Вопрос
Тканевой распад белков, маркеры «стареющих» белковых молекул. Ферменты, принимающие участие в деградации белков.
Основные причины распада тканевых белков заключаются в следующем.
1. Старение клеток или их повреждение внешними факторами (токсические вещества, излучения). Состарившиеся и поврежденные клетки разрушаются путем апоптоза или фагоцитируются; все их компоненты, включая белки, деполимеризуются в лизосомах.
2. Денатурация белков, которая происходит непрерывно с определенной скоростью. Денатурированные белки — более доступные субстраты для протеолитических ферментов.
3. Частичный протеолиз белков в ходе посттрансляционной достройки. При превращении проферментов и предшественников других белков в функционально активные белки отщепляемая часть пептидной цепи гидролизует-ся до аминокислот.
4. Переваривание белков пищеварительных соков. Со всеми пищеварительными секретами у человека за сутки выделяется в кишечник около 50 г белков, в основном ферментов. Все эти белки тоже перевариваются, а аминокислоты всасываются.
5. Регуляция концентрации белков путем индукции и репрессии. Этот механизм регуляции немыслим без его дополнения механизмом разрушения соответствующих белков (ферментов, гормонов и др.) в условиях, когда необходимость в них отпала.
Процессы распада, или диссимиляции, тканевых белков, а также их синтеза неизменно протекают при участии катепсинов, которые могут быть легко обнаружены почти во всех тканях нашего тела. Действие этих ферментов регулируется посредством тончайших коррелятивных механизмов организма, объединяемых центральной нервной системой. При нарушении нормальной жизнедеятельности тканей, например при недостаточном кровоснабжении органа, а также при нарушении питания тканей или при сохранении вырезанных из тела органов в асептических условиях в термостате белки тканей быстро расщепляются тканевыми протеолитическими ферментами и постепенно разрушаются. Этот процесс самопереваривания и растворения тканей называется автолизом. Убиквитин-зависимая система протеолиза проводит поиск потенциальной мишени для протеолитической деградации среди внутриклеточных белков. Белки несут специфические сигналы деградации по аналогии с сигнальными последовательностями, которые направляют вновь синтезируемые белки к определенным микрокомпартментам клетки. Сигналы протеолитической деградации более сложные и разнообразные, так как с их помощью не только маркируются белки, удаляемые с помощью протеолиза, но и определяется время удаления и скорость их протеолитического расщепления. Для распознавания и декодирования таких сигналов в клетках эукариот имеется убиквитин-конъюгирующая система .
Как в ядре, так и в цитоплазме эта система отделена пространственно и функционально от протеолитических ферментов, организованных в протеасомы .
Распознанные данной системой белки-субстраты маркируются путем ковалентного присоединения к ним молекул стабильного 76- звенного белка - убиквитина . Убиквитин соединяется C-концом с боковыми остатками лизина в субстрате. Наличие такой метки в белке является первичным сигналом сортировки, направляющей образовавшиеся конъюгаты к протеасомам. В большинстве случаев к субстрату присоединяется несколько молекул убиквитина, которые организованы в виде бусинок на нитке. Молекулы белков, содержащие убиквитин, по-видимому, являются для протеасом предпочтительными субстратами.
