
- •1 Вопрос
- •2 Вопрос
- •3 Вопрос
- •4 Вопрос
- •5 Вопрос
- •6 Вопрос
- •7 Вопрос
- •8 Вопрос
- •9 Вопрос
- •10 Вопрос
- •11 Вопрос
- •12 Вопрос
- •13 Вопрос
- •14 Вопрос
- •15 Вопрос
- •16 Вопрос
- •17 Вопрос
- •18 Вопрос
- •19 Вопрос
- •20 Вопрос
- •1. Последовательность реакций цитратного цикла
- •21 Вопрос
- •28 Вопрос
- •31 Вопрос
- •32 Вопрос
- •33 Вопрос
- •36 Вопрос
- •1. Теория оперона
- •37 Вопрос
- •38 Вопрос
- •39 Вопрос
- •40 Вопрос
- •41 Вопрос
- •3. Биологическое значение трансаминирования
- •42 Вопрос
- •43 Вопрос
- •1. Реакции синтеза мочевины
- •3. Биологическая роль орнитинового цикла Кребса-Гензелейта
- •44 Вопрос
- •45 Вопрос
- •46 Вопрос
- •1. Пути метаболизма серина и глицина
- •3. Образование и использование одноуглеродных фрагментов
- •47 Вопрос
- •48 Вопрос
- •49 Вопрос
- •51 Вопрос
- •52 Вопрос
- •53 Вопрос
- •54 Вопрос
- •55 Вопрос
- •56 Вопрос
- •57 Вопрос
- •58 Вопрос
- •59 Вопрос
- •60 Вопрос
- •61 Вопрос
- •62 Вопрос
- •63 Вопрос
- •64 Вопрос
- •1. Подтип iIa:
- •2. Подтип iIb:
- •1. Ан‑α‑липопротеинемия (танжерская болезнь).
- •2. А‑β‑липопротеинемия.
- •65 Вопрос
- •67 Вопрос
- •68 Вопрос
- •69 Вопрос
- •70 Вопрос
- •71 Вопрос
- •72 Вопрос
- •73 Вопрос
- •74 Вопрос
- •75 Вопрос
- •76 Вопрос
- •77 Вопрос
- •78 Вопрос
- •79 Вопрос
- •80 Вопрос
- •81 Вопрос
- •82 Вопрос
- •83 Вопрос
- •84 Вопрос
- •85 Вопрос
- •86 Вопрос
- •1. Синтез и секреция катехоламинов
- •2. Механизм действия и биологические функции катехоламинов
- •3. Патология мозгового вещества надпочечников
- •2. Биологические функции инсулина
- •1. Инсулинзависимый сахарный диабет
- •91 Вопрос
- •92 Вопрос
- •1. Синтез и секреция антидиуретического гормона
- •2. Механизм действия
- •3. Несахарный диабет
- •1. Механизм действия альдостерона
- •98 Вопрос
- •99 Вопрос
- •101 Вопрос
- •102 Вопрос
- •103 Вопрос
- •106 Вопрос
- •107 Вопрос
- •112 Вопрос
- •113 Вопрос
- •114 Вопрос
- •1. Основные ферменты микросомальных электронтранспортных цепей
- •1. Участие трансферам в реакциях конъюгации
- •115 Вопрос
- •116 Вопрос
- •Анаэробные пути ресинтеза атф
- •117 Вопрос
- •118 Вопрос
- •122 Вопрос
- •123 Вопрос
- •124 Вопрос
107 Вопрос
Противосвертывающая система и ингибиторы ферментов свертывания крови.
Противосвертывающая система крови
Физиологические ингибиторы свёртывания крови играют важную роль в поддержании гемостаза, так как они сохраняют кровь в жидком состоянии и препятствуют распространению тромба за пределы повреждённого участка сосуда. Тромбин, образующийся в результате реакций прокоагулянтного и контактного путей свёртывания крови, вымывается током крови из тромба. Он может инактивироваться при взаимодействии с ингибиторами ферментов свёртывания крови или активировать антикоагулянтную фазу, тормозящую образование тромба.
Антикоагулянтная фаза. Свёртывание крови должно быть ограничено не только в пространстве, но и во времени. Антикоагулянтная фаза ограничивает время существования активных факторов в крови и инициируется самим тромбином. Следовательно, тромбин, с одной стороны, ускоряет свёртывание крови, являясь последним ферментом каскада реакций коагуляции, а с другой - тормозит его, вызывая образование ферментных комплексов антикоагулянтной фазы на неповреждённом эндотелии сосудов. Этот этап представляет собой короткий каскад реакций, в котором кроме тромбина участвуют белок-активатор тромбомодулин (Тм), витамин К-зависимая сериновая протеаза протеин С, белок-активатор S и факторы Va и VIIIa (рис. 14-16). В каскаде реакций антикоагулянтной фазы последовательно образуются 2 мембранных комплекса IIа-Тм-Са2+ и Ca-S-Са2+.
Тромбомодулин - интегральный белок мембран эндотелиальных клеток. Он не требует протеолитической активации и служит белком-активатором тромбина. Тромбин приобретает способность активировать протеин С только после взаимодействия с тромбомодулином, причём связанный с тромбомодулином тромбин не может превращать фибриноген в фибрин, не активирует фактор V и тромбоциты.
Протеин С - профермент, содержащий остатки γ-карбоксиглутамата. Тромбин в мембранном комплексе IIа-Тм-Са2+ активирует частичным протеолизом протеин С. Активированный протеин С (Са) образует с белком-активатором S мембраносвязанный комплекс Ca-S-Са2+. Са в составе этого комплекса гидролизует в факторах Va и VIIIa по две пептидные связи и инактивирует эти факторы. Под действием комплекса Ca-S-Са2+ в течение 3 мин. теряется 80% активности факторов VIIIa и Va. Таким образом, тромбин по принципу положительной обратной связи не только ускоряет своё образование, но и, активируя протеин С, тормозит процесс свёртывания крови. Наследственный дефицит протеина С и S ведёт к снижению скорости инактивации факторов VIIIa и Va и сопровождается тромботической болезнью. Мутация гена фактора V, при которой синтезируется фактор V, резистентный к протеину С, также приводит к тромбогенезу. Антикоагулянтная фаза вызывает торможение каскада реакций свёртывания крови, а ингибиторы ферментов свёртывания инактивируют активные ферменты в кровяном русле.
Ингибиторы ферментов свёртывания крови. Физиологические ингибиторы ферментов свёртывания крови ограничивают распространение тромба местом повреждения сосуда. Белок плазмы крови антитромбин III - наиболее сильный ингибитор свёртывания крови; на его долю приходится около 80-90% антикоагулянтной активности крови. Он инактивирует ряд сериновых протеаз крови: тромбин, факторы IХа, Ха, ХIIа, калликреин, плазмин и урокиназу. Антитромбин III не ингибирует фактор VIIIa и не влияет на факторы в составе мембранных комплексов, а устраняет ферменты, находящиеся в плазме крови, препятствуя распространению тромбо-образования в кровотоке. Взаимодействие антитромбина с ферментами свёртывания крови ускоряется в присутствии гепарина. Гепарин - гетерополисахарид, который синтезируется в тучных клетках. В результате взаимодействия с гепарином антитромбин III приобретает конформацию, при которой повышается его сродство к сериновым протеазам крови. После образования комплекса антитромбин III-гепарин-фермент гепарин освобождается из него и может присоединяться к другим молекулам антитромбина. При наследственном дефиците антитромбина III в молодом возрасте наблюдают тромбозы и эмболии сосудов, опасные для жизни.
α2-Макроглобулин образует комплекс с сериновыми протеазами крови. В таком комплексе их активный центр полностью не блокируется, они могут взаимодействовать с субстратами небольшого размера. Однако высокомолекулярные субстраты, например фибриноген, становятся недоступными для действия протеаз в комплексе α2-макроглобулинтромбин.
Антиконвер гин (тканевый ингибитор внешнего пути свёртывания) синтезируется в эндотелии сосудов. Он специфически соединяется с ферментным комплексом Тф-VIIа-Са2+, после чего улавливается печенью и разрушается в ней.
α1-Антитрипсин ингибирует тромбин, фактор ХIа, калликреин, однако он не рассматривается как важный ингибитор факторов свёртывания крови, α1-Антитрипсин в основном на тканевом уровне ингибирует панкреатические и лейкоцитарные протеазы, коллагеназу, ренин, урокиназу. Пептиды, образующиеся в результате протеолитической активации проферментов и профакторов, тоже обладают выраженными антикоагулянтными свойствами, но механизм их действия в настоящее время не выяснен.
108 вопрос
Роль простогландинов и сосудистой стенки в гемостазе
Ведущая роль в осуществлении первичного гемостаза в микрососудах принадлежит тромбоцитам. Они прилипают к поврежденному участку сосудистой стенки, что является начальным этапом формирования тромбоцитарной пробки. В процессе адгезии (прилипания) происходит взаимодействие тромбоцитарных гликопротеинов с коллагеном и микрофибриллами эндотелия в присутствии фактора Виллебранда. Фактор Виллебранда секретируется клетками эндотелия сосудов и способствует адгезии тромбоцитов к сосудистой стенке. Поврежденные клетки эндотелия высвобождают также АТФ, АДФ и сосудосуживающие вещества — серотонин и катехоламины. В результате действия сосудосуживающих веществ просвет поврежденных сосудов уменьшается и перекрывается тромбоцитами, прилипшими к коллагеновым волокнам.
Выделившийся АДФ вызывает агрегацию — склеивание тромбоцитов между собой с образованием агрегатов.
Агрегация протекает в две стадии. Первая — обратимая, при которой агрегаты могут распадаться (дезагрегация). Вторая стадия — необратимая, обусловлена освобождением простагландинов, в частности мощного агрегирующего агента тромбоксанаАа.
Под влиянием циклооксигеназы образуются простагландины, из них в тромбоцитах под влиянием тромбоксан-синтетазы образуется чрезвычайно мощный агрегирующий агент – тромбоксан-А2. Тромбоксан угнетает аденилатциклазу и снижает содержание в тромбоцитах цАМФ, что повышает агрегацию тромбоцитов и вызывает выраженную вазоконстрикцию.
Продолжительность жизни тромбоксана, простациклина и других простагландинов несколько минут, но их значение в регуляции и патологии гемостаза весьма велико. Этот механизм является триггерным в реализации адгезивно-агрегационной функции тромбоцитов. Для осуществления этой функции кровяных пластинок необходим ряд плазменных кофакторов агрегации – ионы кальция и магния, фибриноген, альбумин и два белковых кофактора, обозначаемых как агрексоны A и B, фосфолипидный кофактор и др.
Наряду с тромбоксаном к числу стимуляторов агрегации тромбоцитов относится также коллаген сосудистой стенки, тромбин, АДФ, серотонин, простагландин Е2. Прямо противоположную роль играет простациклин (ПГ12). Он препятствует агрегации тромбоцитов и вызывает вазодилатацию. Механизм действия простациклина заключается в том, что он стимулирует аденилатциклазу и повышает содержание цАМФ в тромбоцитах и стенке сосудов. От взаимодействия простациклина и тромбоксана зависит, произойдут адгезия тромбоцитов к стенке сосудов и их агрегация или нет.
109 вопрос
Тромботические и антитромботические свойства тромбина
Тромбин (фактор Па) - гликопротеин с молекулярной массой 39 кД. Он образуется в крови из неактивного предшественника протромбина. Протромбин синтезируется в печени, имеет молекулярную массу 70 кД и содержит остатки γ-карбоксиглутаминовой кислоты. Концентрация этого белка в крови в норме составляет 0,1 г/л. Он фиксируется на мембранном ферментном комплексе Xa-Va-Са2+, взаимодействуя, с одной стороны, остатками у-карбоксиглутамата с Са2+, а с другой - непосредственно с белком-активатором Va. Таким образом, создаются наилучшие стерические условия для протекания ферментативной реакции. Фактор Ха гидролизует две пептидные связи в молекуле протромбина. В результате этого образуется молекула тромбина, состоящая из двух цепей - лёгкой и тяжёлой, связанных между собой одной дисульфидной связью (рис. 14-12). Молекула тромбина не содержит остатков γ-карбоксиглутамата и освобождается из протромбиназного комплекса. Тромбин частичным протеолизом превращает фибриноген в фибрин и активирует факторы VII, VIII, V, XIII. Тромбин выполняет ряд важных физиологических функций: является ферментом прокоагулянтного и контактного путей свёртывания крови, инициирует реакции антикоагулянтной фазы, вызывает агрегацию тромбоцитов и оказывает митогенное действие, участвуя в пролиферации и репарации клеток. Частичным протеолизом активируются также факторы V и VIII, превращаясь, соответственно, в факторы Va и VIIIa. В результате активации этих факторов изменяется их конформация и повышается сродство к фосфолипидам мембран и ферментам, которые они активируют. Взаимодействие белков-активаторов с протеолитическими ферментами. Тканевый фактор, фактор Va и фактор VIIIa имеют центры связывания с фосфолипидами мембран и ферментами VIIa, IXa и Ха, соответственно. При связывании с белками-активаторами в результате конформационных изменений активность этих ферментов повышается. Тромбин, образующийся в результате реакций прокоагулянтного и контактного путей свёртывания крови, вымывается током крови из тромба. Он может инактивироваться при взаимодействии с ингибиторами ферментов свёртывания крови или активировать антикоагулянтную фазу, тормозящую образование тромба. Антикоагулянтная фаза. Свёртывание крови должно быть ограничено не только в пространстве, но и во времени. Антикоагулянтная фаза ограничивает время существования активных факторов в крови и инициируется самим тромбином. Следовательно, тромбин, с одной стороны, ускоряет свёртывание крови, являясь последним ферментом каскада реакций коагуляции, а с другой - тормозит его, вызывая образование ферментных комплексов антикоагулянтной фазы на неповреждённом эндотелии сосудов. Этот этап представляет собой короткий каскад реакций, в котором кроме тромбина участвуют белок-активатор тромбомодулин (Тм), витамин К-зависимая сериновая протеаза протеин С, белок-активатор S и факторы Va и VIIIa (рис. 14-16).
В каскаде реакций антикоагулянтной фазы последовательно образуются 2 мембранных комплекса IIа-Тм-Са2+ и Ca-S-Са2+.
Тромбомодулин - интегральный белок мембран эндотелиальных клеток. Он не требует протеолитической активации и служит белком-активатором тромбина. Тромбин приобретает способность активировать протеин С только после взаимодействия с тромбомодулином, причём связанный с тромбомодулином тромбин не может превращать фибриноген в фибрин, не активирует фактор V и тромбоциты.
Протеин С - профермент, содержащий остатки γ-карбоксиглутамата. Тромбин в мембранном комплексе IIа-Тм-Са2+ активирует частичным протеолизом протеин С. Активированный протеин С (Са) образует с белком-активатором S мембраносвязанный
комплекс Ca-S-Са2+. Са в составе этого комплекса гидролизует в факторах Va и VIIIa по две пептидные связи и инактивирует эти факторы. Под действием комплекса Ca-S-Са2+ в течение 3 мин. теряется 80% активности факторов VIIIa и Va. Таким образом, тромбин по принципу положительной обратной связи не только ускоряет своё образование, но и, активируя протеин С, тормозит процесс свёртывания крови.
Наследственный дефицит протеина С и S ведёт к снижению скорости инактивации факторов VIIIa и Va и сопровождается тромботической болезнью. Мутация гена фактора V, при которой синтезируется фактор V, резистентный к протеину С, также приводит к тромбогенезу.
Антикоагулянтная фаза вызывает торможение каскада реакций свёртывания крови, а ингибиторы ферментов свёртывания инактивируют активные ферменты в кровяном русле.
Ингибиторы ферментов свёртывания крови. Физиологические ингибиторы ферментов свёртывания крови ограничивают распространение тромба местом повреждения сосуда. Белок плазмы крови антитромбин III - наиболее сильный ингибитор свёртывания крови; на его долю приходится около 80-90% антикоагулянтной активности крови. Он инактивирует ряд сериновых протеаз крови: тромбин, факторы IХа, Ха, ХIIа, калликреин, плазмин и урокиназу. Антитромбин III не ингибирует фактор VIIIa и не влияет на факторы в составе мембранных комплексов, а устраняет ферменты, находящиеся в плазме крови, препятствуя распространению тромбо-образования в кровотоке.
Взаимодействие антитромбина с ферментами свёртывания крови ускоряется в присутствии гепарина. Гепарин - гетерополисахарид, который синтезируется в тучных клетках. В результате взаимодействия с гепарином антитромбин III приобретает конформацию, при которой повышается его сродство к сериновым протеазам крови. После образования комплекса антитромбин III-гепарин-фермент гепарин освобождается из него и может присоединяться к другим молекулам антитромбина.
При наследственном дефиците антитромбина III в молодом возрасте наблюдают тромбозы и эмболии сосудов, опасные для жизни.
α2-Макроглобулин образует комплекс с сериновыми протеазами крови. В таком комплексе их активный центр полностью не блокируется,
и они могут взаимодействовать с субстратами небольшого размера. Однако высокомолекулярные субстраты, например фибриноген, становятся недоступными для действия протеаз в комплексе α2-макроглобулинтромбин.
Антиконвер гин (тканевый ингибитор внешнего пути свёртывания) синтезируется в эндотелии сосудов. Он специфически соединяется с ферментным комплексом Тф-VIIа-Са2+, после чего улавливается печенью и разрушается в ней.
α1-Антитрипсин ингибирует тромбин, фактор ХIа, калликреин, однако он не рассматривается как важный ингибитор факторов свёртывания крови, α1-Антитрипсин в основном на тканевом уровне ингибирует панкреатические и лейкоцитарные протеазы, коллагеназу, ренин, урокиназу.
Пептиды, образующиеся в результате протеолитической активации проферментов и профакторов, тоже обладают выраженными антикоагулянтными свойствами, но механизм их действия в настоящее время не выяснен.
Тромбин взаимодействует со специфическим рецептором - интегральным белком, имеющим 7 трансмембранных доменов. Тромбин активирует рецептор частичным протеолизом, отщепляя от него N-концевой пептид, находящийся на внешней плазматической поверхности тромбоцита. Следовательно, тромбин, в отличие от других активаторов, действует каталитически, и одна молекула тромбина может активировать несколько рецепторов. Передача сигнала осуществляется через инозитолфосфатную систему, в результате чего в тромбоците повышается концентрация Са2+ и активируется протеинкиназа С. Образующийся комплекс кальмодулин- 4Са2+-миозинкиназа фосфорилирует миозин, взаимодействие которого с актином приводит к изменению формы тромбоцитов, к их адгезии и агрегации. Протеинкиназа С, кроме того, фосфорилирует белок тромбоцитов плекстрин. Фос-форилированный плекстрин вызывает "реакцию освобождения" содержащихся в гранулах тромбоцитов вторичных индукторов активации и агрегации тромбоцитов. К этим веществам относят содержащиеся в плотных гранулах тромбоцитов АДФ, Са2+, ГДФ, серотонин, гистамин и присутствующие в осгранулах белок β-тромбоглобулин, фактор фон Виллебранда, белок фибронектин, тромбосподин и ВМК. Тромбос-подин участвует во взаимодействии тромбоцитов друг с другом. р-Тромбоглобулин снижает секрецию простациклина и связывает гепарин. Фибронектин имеет центры связывания для коллагена, гепарина и тромбоцитов.
110 вопрос
Общая характеристика хромопротеидов. Структура и биологическая роль миоглобина, цитохромов, каталазы, пероксидазы.
Хромопротеиды- слож белки которые окрашиваются. Классификация: 1.Fe содержащие (красные) 2. Mg содержащ (зеленые) 3. Флавопротеиды (желтые) Среди ХП различают дыхательные белки и дыхательные ферменты, которые образуют подгруппу гемопротеидов. К дыхательным белкам относятся гемоглобин (Нb) – красный пигмент крови и миоглобин (Мgb) – красный пигмент мышц.
Гем – производное порфирина, состоит из 4-х пиррольных колец, связанных в циклическую структуру метиновыми мостиками. Порфин с заместителями у бета-углерода называется порфирином.
Миоглобин - хромопротеин, присутствующий в мышечной ткани и обладающий большим сродством к кислороду. Молекулярная масса этого белка около 16000 Да, Молекула миоглобина имеет третичную структуру и представляет собой одну полипептидную цепь, соединённую с гемом. Миоглобин не обладает аллостерическими свойствами. Функция миоглобина заключается в создании в мышцах кислородного резерва, который расходуется по мере необходимости, восполняя временную нехватку кислорода.
ЦИТОХРОМЫ, сложные белки (гемопротеиды), содержащие в качестве простетич. группы гем. Служат переносчиками электронов в процессах внутриклеточного дыхания, окислит. фосфорилирования, фотосинтеза, ферментативного гидроксилирования и в др. биол. окислит.-восстановит. р-циях. В зависимости от природы гема цитохромы делят на 4 группы, обозначаемые буквами а, b, с и d. У цитохрома а гем имеет строение протопорфирина (см. Порфирины) и содержит формильный заместитель; цитохром b содержит протогем (ферропротопорфирин), нековалентно связанный с полипептидной цепью; у цитохрома с боковые заместители протопорфирина ковалентно связаны с полипептидной цепью; у цитохрома d гем представлен дигидропорфирином (хлорином). Атом Fe, входящий в состав гемовцитохромов и подвергающийся окислению и восстановлению, координирован 4 связями с атомами N порфириновых колец и 2 - с лигандами, принадлежащими полипептидным цепям (остатки гистидина, цистеина). Нек-рые цитохромы содержат неск. одинаковых или разных гемов. Цитохромы реагируют с лигандами, конкурирующими с естественным координац. окружением атома Fe гемов (СО,анионы азида, цианида и др.). Связывание этих лигандов приводит к изменению спектральных св-в и инактивации цитохромов.
КATАЛA3А (от греч. katalysis - разрушение) (перекись водорода: перекись водорода оксидоредуктаза), ферменткласса оксидоредуктаз, катализирующий разложение Н2О2 на Н2О и О2. При низких концентрациях Н2О2 каталаза проявляет также пероксидазную активность, окисляя низшие спирты, полифенолы и др. Каталаза содержится у всех животных и растений, в т. ч. в печени (в спец. внутриклеточных органеллах - пероксисомах), в эритроцитахмлекопитающих (до 2% от сухого веса) и почти у всех аэробных микроорганизмов. Молекула каталазы из печенибыка (мол. м. 250 тыс.) состоит из четырех идентичных субъединиц, к-рые не обладают ферментативнойактивностью. Каждая субъединица содержит гем с Fe2+ (см. Гемоглобин). Активность каталазы - одна из наибольших среди известных ферментов (одна молекула каталазы способна разложить за 1с 44 тыс. молекул Н2О2). Оптим. каталитич. активность проявляется при рН 7,6; рI 5,6. Ингибиторы каталазы - мн. соли (напр., сульфиды, цианиды,азиды, фториды). Биол. ф-ция каталазы - защита клеточных мембран от Н2О2, а вместе с супероксиддисмутазой - и от супероксидного радикала. Активность каталазы оценивают по объему выделившегося в каталитич. р-ции О2 или по изменению концентрации Н2О2. Определение активности фермента в эритроцитах человека используют в медицине для диагностики нек-рых заболеваний крови.
ПЕРОКСИДАЗЫ (донор: пероксид водорода оксидоредук-тазы), ферменты класса оксидоредуктаз, катализирующиеокисление с помощью H2O2 разл. неорг. и орг. в-в по схеме:
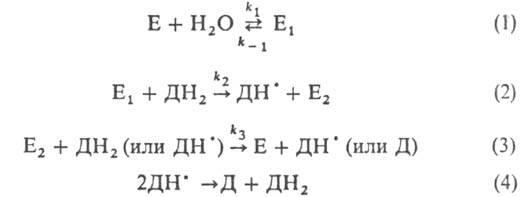
E, E1 и E2- соотв. исходная пероксидаза и ее окисленные формы; ДН2, ДН• и Д-соотв. исходный, полуокисленный и окисленный субстраты; k-константа скорости р-ции.
Р-ция 1 практически необратима (k1/k_1 > 108). Наиб. медленная стадия - р-ция 3. Пероксидазы высокоспецифичны к H2O2 и обычно обладают широкой специфичностью к субстрату (известны пероксидазы, проявляющие высокуюспецифичность).
111 вопрос
Порфирины как структурные компоненты хромопротеидов. Порфирии и порфиринурии.
Порфирины. Основу стр-ры простетической группы большинства гемосодержащих белков составляет порфиновое кольцо, являющееся производным порфина, котоый состоит из 4 замещенных пирролов, соединенных мужду собой метиновыми мостиками.
Нарушения биосинтеза гема. Порфирии
Наследственные и приобретённые нарушения синтеза гема, сопровождающиеся повышением содержания порфириногенов, а также. Белковые факторы инициации трансляции не могут присоединиться к мРНК, и трансляция прекращается.продуктов их окисления в тканях и крови и появлением их в моче, называют порфириями ("порфирин" в переводе с греч. означает пурпурный). Наследственные порфирии обусловлены генетическими дефектами ферментов, участвующих в синтезе гема, за исключением аминолевулинатсинтазы. При этих заболеваниях отмечают снижение образования гема. Поскольку гем - аллостерический ингибитор аминолевулинатсинтазы, то активность этого фермента повышается, и это приводит к накоплению промежуточных продуктов синтеза гема - аминолевулиновой кислоты и порфириногенов. В зависимости от основной локализации патологического процесса различают печёночные и эритропоэтические наследственные порфирии. Эритропоэтические порфирии сопровождаются накоплением порфиринов в нормобластах и эритроцитах, а печёночные - в гепатоцитах. При тяжёлых формах порфирии наблюдают нейропсихические расстройства, нарушения функций РЭС, повреждения кожи. Порфириногены не окрашены и не флуоресцируют, но на свету они легко превращаются в порфирины. Последние проявляют интенсивную красную флуоресценцию в ультрафиолетовых лучах. В коже на солнце в результате взаимодействия с порфиринами кислород переходит в синглетное состояние. Синглетный кислород вызывает ускорение ПОЛ клеточных мембран и разрушение клеток, поэтому порфирии часто сопровождаются фотосенсибилизацией и изъязвлением открытых участков кожи. Нейропсихические расстройства при порфириях связаны с тем, что аминолевулинат и порфириногены являются нейротоксинами. Иногда при лёгких формах наследственных порфирии заболевание может протекать бессимптомно, но приём лекарств, являющихся индукторами синтеза аминолевулинатсинтазы, может вызвать обострение болезни. Индукторами синтеза аминолевулинатсинтазы являются такие известные лекарства, как сульфаниламиды, барбитураты, диклофенак, вольтарен, стероиды, гестагены. В некоторых случаях симптомы болезни не проявляются до периода полового созревания, когда повышение образования β-стероидов вызывает индукцию синтеза аминолевулинатсинтазы. Порфирии наблюдают и при отравлениях солями свинца, так как свинец нгибирует аминолевулинатдегидратазу и феррохелатазу. Некоторые галогенсодержащие гербициды и инсектициды являются индукторами синтеза аминолевулинатсинтазы, поэтому попадание их в организм сопровождается симптомами порфирии.
Порфиринурия (синоним гематопорфиринурия) — увеличение содержания в моче порфиринов (см.). Наблюдается при порфириновой болезни (см.) как одно из проявлений нарушенного пигментного обмена или как вторичный симптом при некоторых заболеваниях печени, анемиях, отравлениях. Моча при порфиринурии красная.
Порфиринурия (от греч. porphyreos — багровый и uron — моча) — увеличенное выделение с мочой пигмента порфирина, образующегося в избыточном количестве при нарушении обменных процессов в организме. Порфирин образуется из гликокола и из близких к уксусной кислоте дериватов, имеющих пиролловое ядро, вследствие нарушения биосинтеза гемоглобина, миоглобина, каталазы, пероксидазы, цитохромов и является межуточным или побочным продуктом этих гемо- или геминпротеидов. В человеческом организме множество разнообразных порфириновых соединений (см. Порфирины) участвует в пигментном обмене. В норме порфирин в незначительных количествах содержится в кале и моче. Специальные методы исследования обнаруживают также небольшие количества протопорфирина и порфобилиногена, следы уропорфирина. Суточное количество порфиринов в моче зависит от попадающих в организм извне (экзогенных) и образующихся в организме (эндогенных) порфиринов. Прием магнезии, жиров или алкоголя, кислых продуктов, а также физические напряжения, солнечный загар, рентгеновское облучение, менструации могут значительно увеличить количество порфиринов в моче. К порфиринурии приводят также инфекции, некоторые заболевания кожи, крови (пернициозная анемия, гемолитическая анемия и др.), печени (желтуха, цирроз печени и др.), введение в организм сыворотки, прививки, авитаминозы (особенно недостаточность рибофлавина), некоторые снотворные (сульфонал, трионал, барбитал, паральдегид и др.) и отравления арсеновыми соединениями, фосфором и тяжелыми металлами, особенно свинцом. При нарушении порфиринового обмена возникает так называемая истинная порфирия, в частности, порфириновая болезнь.
