- •1 Вопрос
- •2 Вопрос
- •3 Вопрос
- •4 Вопрос
- •5 Вопрос
- •6 Вопрос
- •7 Вопрос
- •8 Вопрос
- •9 Вопрос
- •10 Вопрос
- •11 Вопрос
- •12 Вопрос
- •13 Вопрос
- •14 Вопрос
- •15 Вопрос
- •16 Вопрос
- •17 Вопрос
- •18 Вопрос
- •19 Вопрос
- •20 Вопрос
- •1. Последовательность реакций цитратного цикла
- •21 Вопрос
- •28 Вопрос
- •31 Вопрос
- •32 Вопрос
- •33 Вопрос
- •36 Вопрос
- •1. Теория оперона
- •37 Вопрос
- •38 Вопрос
- •39 Вопрос
- •40 Вопрос
- •41 Вопрос
- •3. Биологическое значение трансаминирования
- •42 Вопрос
- •43 Вопрос
- •1. Реакции синтеза мочевины
- •3. Биологическая роль орнитинового цикла Кребса-Гензелейта
- •44 Вопрос
- •45 Вопрос
- •46 Вопрос
- •1. Пути метаболизма серина и глицина
- •3. Образование и использование одноуглеродных фрагментов
- •47 Вопрос
- •48 Вопрос
- •49 Вопрос
- •51 Вопрос
- •52 Вопрос
- •53 Вопрос
- •54 Вопрос
- •55 Вопрос
- •56 Вопрос
- •57 Вопрос
- •58 Вопрос
- •59 Вопрос
- •60 Вопрос
- •61 Вопрос
- •62 Вопрос
- •63 Вопрос
- •64 Вопрос
- •1. Подтип iIa:
- •2. Подтип iIb:
- •1. Ан‑α‑липопротеинемия (танжерская болезнь).
- •2. А‑β‑липопротеинемия.
- •65 Вопрос
- •67 Вопрос
- •68 Вопрос
- •69 Вопрос
- •70 Вопрос
- •71 Вопрос
- •72 Вопрос
- •73 Вопрос
- •74 Вопрос
- •75 Вопрос
- •76 Вопрос
- •77 Вопрос
- •78 Вопрос
- •79 Вопрос
- •80 Вопрос
- •81 Вопрос
- •82 Вопрос
- •83 Вопрос
- •84 Вопрос
- •85 Вопрос
- •86 Вопрос
- •1. Синтез и секреция катехоламинов
- •2. Механизм действия и биологические функции катехоламинов
- •3. Патология мозгового вещества надпочечников
- •2. Биологические функции инсулина
- •1. Инсулинзависимый сахарный диабет
- •91 Вопрос
- •92 Вопрос
- •1. Синтез и секреция антидиуретического гормона
- •2. Механизм действия
- •3. Несахарный диабет
- •1. Механизм действия альдостерона
- •98 Вопрос
- •99 Вопрос
- •101 Вопрос
- •102 Вопрос
- •103 Вопрос
- •106 Вопрос
- •107 Вопрос
- •112 Вопрос
- •113 Вопрос
- •114 Вопрос
- •1. Основные ферменты микросомальных электронтранспортных цепей
- •1. Участие трансферам в реакциях конъюгации
- •115 Вопрос
- •116 Вопрос
- •Анаэробные пути ресинтеза атф
- •117 Вопрос
- •118 Вопрос
- •122 Вопрос
- •123 Вопрос
- •124 Вопрос
10 Вопрос
Характеристика кофакторов ферментов: строение и классификация. Коферменты НАД, НАДФ, ФАД, ФМН, КоАSH, ГДФ, пиридоксальфосфат, ТГФК: химическая природа, витамины-предшественники, катализируемые реакции.
Большинство ферментов для проявления каталитической активности нуждается в присутствии некоторых веществ небелковой природы - кофакторов. Различают две группы кофакторов: ионы металлов и коферменты.
1. Ионы металла участвуют в функционировании фермента различными способами.
• Изменяют конформацию молекулы субстрата, что обеспечивает комплементарное взаимодействие с активным центром. Например, в качестве субстрата выступает комплекс Mg2+-АТФ.
• Обеспечивают нативную конформацию активного центра фермента. Ионы Mg2+, Mn2+, Zn2+, Co2+, Mo2+ участвуют в стабилизации активного центра ферментов и способствуют присоединению кофермента.
• Стабилизируют конформацию белковой молекулы фермента. Например, для стабилизации четвертичной структуры фермента алкогольдегидрогеназы, катализирующей реакцию окисления этанола, необходимы ионы цинка.
• Непосредственно участвуют в ферментативном катализе. Ионы Zn2+, Fe2+, Мп2+, Cu2+ принимают участие в электрофильном катализе. Ионы металлов с переменной валентностью могут также участвовать в переносе электронов. Например, в цитохромах (гемсодержащих белках) ион железа способен присоединять и отдавать один электрон. Благодаря этому свойству цитохромы участвуют в окислительно-восстановительных реакциях:
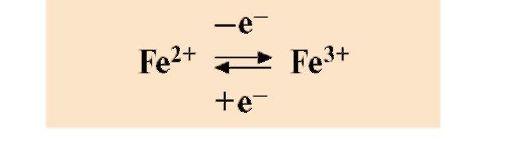 2.
Коферменты являются
органическими веществами, чаще всего
производными витаминов, которые
непосредственно участвуют в ферментативном
катализе, так как находятся в активном
центре ферментов. Фермент, содержащий
кофермент и обладающий ферментативной
активностью, называют холоферментом. Белковую
часть такого фермента
называют апоферментом, который в
отсутствие кофермента не обладает
каталитической активностью.
2.
Коферменты являются
органическими веществами, чаще всего
производными витаминов, которые
непосредственно участвуют в ферментативном
катализе, так как находятся в активном
центре ферментов. Фермент, содержащий
кофермент и обладающий ферментативной
активностью, называют холоферментом. Белковую
часть такого фермента
называют апоферментом, который в
отсутствие кофермента не обладает
каталитической активностью.
![]() Кофермент
может связываться с белковой частью
фермента только в момент реакции или
быть связанным с апоферментом прочными
ковалентными связями. В последнем случае
он называется простетической группой.
Кофермент
может связываться с белковой частью
фермента только в момент реакции или
быть связанным с апоферментом прочными
ковалентными связями. В последнем случае
он называется простетической группой.
Коферменты- Тип реакции, в которой участвует кофермент, роль кофермента и участие активной группы в катализе- Витамин-предшественник
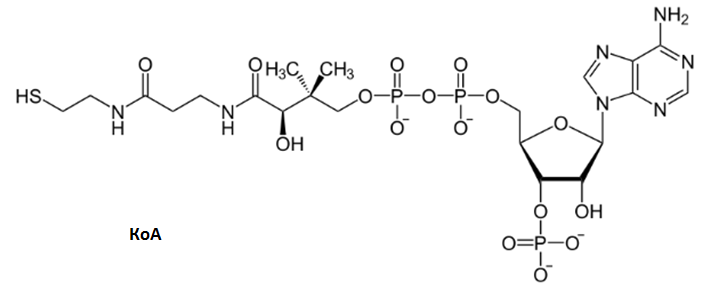
Кофермент (коэнзим) А (НSКоА) - Реакция ацилирования.Образование высокоэнергетической тиоэфирной группы с карбоксильными группами карбоновых кислот R-СО-SКоА - Пантотеновая кислота
Никотинамидадениндинуклеотид,(НАД) никотинамидадениндинуклеотидфосфат (НАДФ) – никотинамидные коферменты - Окислительно-восстановительные реакции. При окислении субстрата к пиридиновому кольцу присоединяются 1 протон (2-й переходит в среду) и 2 электрона, при этом положительный заряд утрачивается. - Никотинамид (витамин РР)
Пиридоксальфосфат (ПФ) - Трансаминирование, декарбоксилирование аминокислот. При сближении азота аминокислоты и углерода альдегидной группы ПФ образуется альдиминная связь. Далее после вутримолекулярных перестроек образуется аминогруппа на коферменте и кетогруппа на бывшей аминокислоте. - Пиридоксин (В6)
Флавинмононуклеотид, (ФМН) флавин-адениндинуклеотид, (ФАД) - флавиновые коферменты - Окислительно-восстановительные реакции. Два атома водорода от субстрата присоединяются к атома азота N1 и N10. - Рибофлавин (В2)
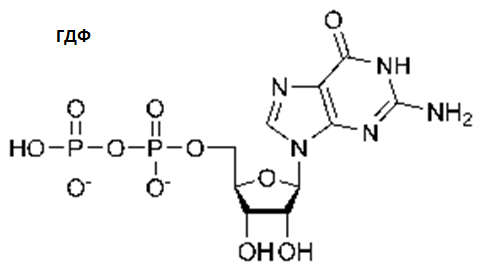
Гуанозиндифосфат (ГДФ, GDP,) — нуклеотид, эфир пирофосфорной кислоты с гуаниловым нуклеозидом. ГДФ состоит из пирофосфата, сахара пентозы рибозы и азотистого основания гуанина.ГДФ — продукт дефосфорилирования ГТФ ГТФазами, например, в реакциях передачи сигнала G-белками. В клетке ГДФ превращается в ГТФ ферментом пируваткиназой, дополнительная фосфатная группа переносится с молекулы фосфоенолпирувата.
Никотинамидные коферментыНАД+, НАДФ+.
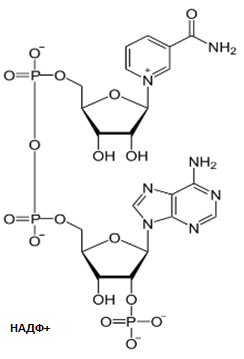
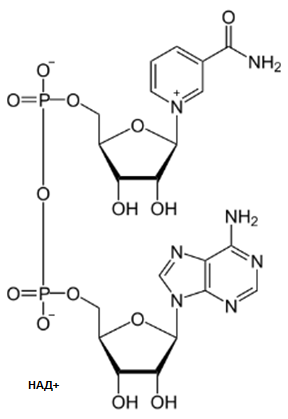 НАД+,
НАДФ+-содержащие дегидрогеназы
катализируют перенос гидрид-иона (Н-)
от субстрата к никотинамидной части
кофермента.Восстановленная при этом
часть кофермента отличается от окисленной
только по производному никотиновой
кислоты. Восстановленные формы НАДН и
НAДФH отсоединяются от апофермента и
отделяются от дегидрогеназы. Затем они
переносят гидрид ион на другую молекулу
фермента (чаще всего- ФМН, ФАД-зависимого).
Катализируют обратимые реакции окисления
спиртов, оксикислот, аминов и др. Хорошо
изучены ЛДН- лактатдегидрогеназа, MДH-
малатдегидрогеназа, AДH- алкогольдегидрогеназа.
НАД+,
НАДФ+-содержащие дегидрогеназы
катализируют перенос гидрид-иона (Н-)
от субстрата к никотинамидной части
кофермента.Восстановленная при этом
часть кофермента отличается от окисленной
только по производному никотиновой
кислоты. Восстановленные формы НАДН и
НAДФH отсоединяются от апофермента и
отделяются от дегидрогеназы. Затем они
переносят гидрид ион на другую молекулу
фермента (чаще всего- ФМН, ФАД-зависимого).
Катализируют обратимые реакции окисления
спиртов, оксикислот, аминов и др. Хорошо
изучены ЛДН- лактатдегидрогеназа, MДH-
малатдегидрогеназа, AДH- алкогольдегидрогеназа.
Флавиновые простетические группы.Окисленные формы флавиновых простетических групп выглядят следующим образом:
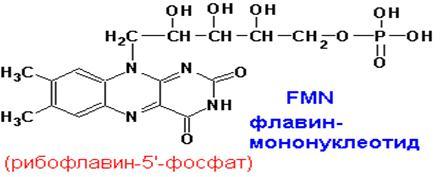
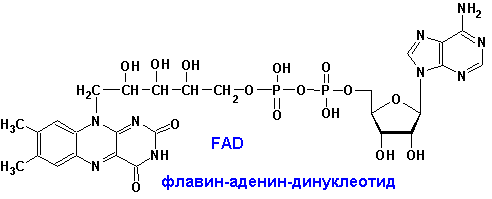 ФМН
и ФAД катализируют переходы: спирты-альдегиды,
амины-имины, НAДH, НAДФH-НAД+, НAДФ+. ФМН,
ФAД- более сильные окислители. Сами
передают гидрид ион непосредственно
на кислород: ФAДH2, ФMНH2 + O2 → ФAД, ФMН + H2O2.
ФМН
и ФAД катализируют переходы: спирты-альдегиды,
амины-имины, НAДH, НAДФH-НAД+, НAДФ+. ФМН,
ФAД- более сильные окислители. Сами
передают гидрид ион непосредственно
на кислород: ФAДH2, ФMНH2 + O2 → ФAД, ФMН + H2O2.
Коэнзим А: Пиридоксальфосфат:
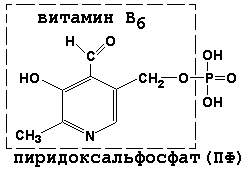
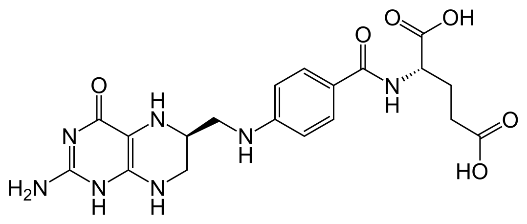
Тетрагидрофолат(ТГФК) — это кофермент, участвующий во многих реакциях, особенно при метаболизме аминокислот и нуклеиновых кислот. Является донором одноуглеродной группы. Получает атом углерода путем образования комплекса с формальдегидом, который образуется в других реакциях. Недостаток тетрагидрофолата вызывает анемию. Концентрация тетрагидрофолата снижается под действием лекарственного препарата (цитостатика) метотрексата, который используют для остановки синтеза нуклеотидов. Предшественник – фолиевая кислота.