
- •1 Вопрос
- •2 Вопрос
- •3 Вопрос
- •4 Вопрос
- •5 Вопрос
- •6 Вопрос
- •7 Вопрос
- •8 Вопрос
- •9 Вопрос
- •10 Вопрос
- •11 Вопрос
- •12 Вопрос
- •13 Вопрос
- •14 Вопрос
- •15 Вопрос
- •16 Вопрос
- •17 Вопрос
- •18 Вопрос
- •19 Вопрос
- •20 Вопрос
- •1. Последовательность реакций цитратного цикла
- •21 Вопрос
- •28 Вопрос
- •31 Вопрос
- •32 Вопрос
- •33 Вопрос
- •36 Вопрос
- •1. Теория оперона
- •37 Вопрос
- •38 Вопрос
- •39 Вопрос
- •40 Вопрос
- •41 Вопрос
- •3. Биологическое значение трансаминирования
- •42 Вопрос
- •43 Вопрос
- •1. Реакции синтеза мочевины
- •3. Биологическая роль орнитинового цикла Кребса-Гензелейта
- •44 Вопрос
- •45 Вопрос
- •46 Вопрос
- •1. Пути метаболизма серина и глицина
- •3. Образование и использование одноуглеродных фрагментов
- •47 Вопрос
- •48 Вопрос
- •49 Вопрос
- •51 Вопрос
- •52 Вопрос
- •53 Вопрос
- •54 Вопрос
- •55 Вопрос
- •56 Вопрос
- •57 Вопрос
- •58 Вопрос
- •59 Вопрос
- •60 Вопрос
- •61 Вопрос
- •62 Вопрос
- •63 Вопрос
- •64 Вопрос
- •1. Подтип iIa:
- •2. Подтип iIb:
- •1. Ан‑α‑липопротеинемия (танжерская болезнь).
- •2. А‑β‑липопротеинемия.
- •65 Вопрос
- •67 Вопрос
- •68 Вопрос
- •69 Вопрос
- •70 Вопрос
- •71 Вопрос
- •72 Вопрос
- •73 Вопрос
- •74 Вопрос
- •75 Вопрос
- •76 Вопрос
- •77 Вопрос
- •78 Вопрос
- •79 Вопрос
- •80 Вопрос
- •81 Вопрос
- •82 Вопрос
- •83 Вопрос
- •84 Вопрос
- •85 Вопрос
- •86 Вопрос
- •1. Синтез и секреция катехоламинов
- •2. Механизм действия и биологические функции катехоламинов
- •3. Патология мозгового вещества надпочечников
- •2. Биологические функции инсулина
- •1. Инсулинзависимый сахарный диабет
- •91 Вопрос
- •92 Вопрос
- •1. Синтез и секреция антидиуретического гормона
- •2. Механизм действия
- •3. Несахарный диабет
- •1. Механизм действия альдостерона
- •98 Вопрос
- •99 Вопрос
- •101 Вопрос
- •102 Вопрос
- •103 Вопрос
- •106 Вопрос
- •107 Вопрос
- •112 Вопрос
- •113 Вопрос
- •114 Вопрос
- •1. Основные ферменты микросомальных электронтранспортных цепей
- •1. Участие трансферам в реакциях конъюгации
- •115 Вопрос
- •116 Вопрос
- •Анаэробные пути ресинтеза атф
- •117 Вопрос
- •118 Вопрос
- •122 Вопрос
- •123 Вопрос
- •124 Вопрос
41 Вопрос
Трансаминирование аминокислот. Структура кофермента и механизм переаминирования. Специфичность трансаминаз. Значение реакций трансаминирования. Диагностическое значение определения в сыворотке крови органоспецифичных аминотрансфераз АЛТ и АСТ. Коэффициент де Ритиса.
Трансаминирование
Трансаминирование - реакция переноса α-аминогруппы с аминокислоты на α-кетокислоту, в результате чего образуются новая кетокислота и новая аминокислота. Константа равновесия для большинства таких реакций близка к единице (Кр~1,0), поэтому процесс трансаминирования легко обратим (см. схему А).
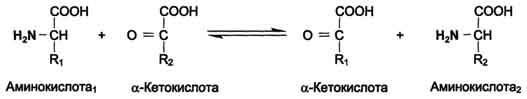
Реакции катализируют ферменты аминотрансферазы, коферментом которых служит пиридоксальфосфат (ПФ) - производное витамина В6 (пиридоксина, см. раздел 3) (см. схему Б).
Аминотрансферазы обнаружены как в цитоплазме, так и в митохондриях клеток эукариот. Причём митохондриальные и цитоплазматические формы ферментов различаются по физико-химическим свойствам. В клетках человека найдено более 10 аминотрансфераз, отличающихся по субстратной специфичности. Вступать в реакции трансаминирования могут почти все аминокислоты за исключением лизина, треонина и пролина.
Механизм реакции
Аминотрансферазы - классический пример ферментов, катализирующих реакции, протекающие по механизму типа "пинг-понг" (см. раздел 2). В таких реакциях первый продукт должен уйти из активного центра фермента до того, как второй субстрат сможет к нему присоединиться.
Активная форма аминотрансфераз образуется в результате присоединения пиридоксальфосфата к аминогруппе лизина прочной альдиминной связью (рис. 9-6). Лизин в положении 258 входит в состав активного центра фермента. Кроме того, между ферментом и пиридоксальфосфатом образуются ионные связи с участием заряженных атомов фосфатного остатка и азота в пиридиновом кольце кофермента.
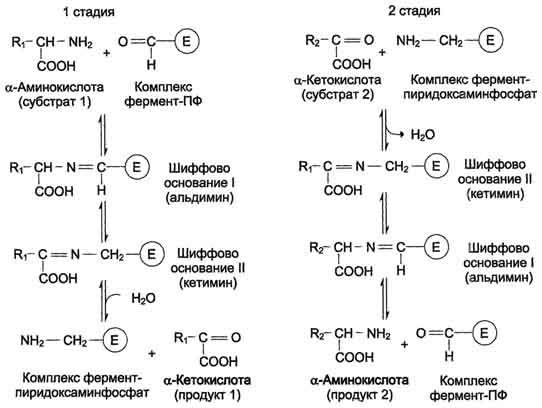
Пиридоксальфосфат в данном случае служит переносчиком аминогрупп. При этом наиболее важную роль играет его альдегидная группа, которая может обратимо присоединять различные амины с образованием шиффовых оснований. Реакции трансаминирования проходят в 2 стадии, во время которых пиридрксальфосфат претерпевает обратимые превращения между свободной альдегидной формой (ПФ) и аминированной формой (пиридоксаминфосфат).
Последовательность реакций трансаминирования представлена ниже.
На первой стадии к пиридоксальфосфату в активном центре фермента с помощью альдиминной связи присоединяется аминогруппа от первого субстрата - аминокислоты. Образуются комплекс фермент-пиридокса-минфосфат и кетокислота - первый продукт реакции. Этот процесс включает промежуточное образование 2 шиффовых оснований.
На второй стадии комплекс фермент-пиридоксаминфосфат соединяется с кетокислотой (вторым субстратом) и снова через промежуточное образование 2 шиффовых оснований передаёт аминогруппу на кетокислоту. В результате фермент возвращается в свою нативную форму, и образуется новая аминокислота - второй продукт реакции. Если альдегидная группа пиридоксальфосфата не занята аминогруппой субстрата, то она образует шиффово основание (альдимин) с ε-аминогруппой радикала лизина в активном центре фермента (см. схему на с. 471).
Органоспецифичные аминотрансферазы АНТ и ACT
Чаще всего в реакциях трансаминирования участвуют аминокислоты, содержание которых в тканях значительно выше остальных - глутамат, аланин, аспартат и соответствующие им кетокислоты - α-кетоглутарат, пируват и оксалоацетат. Основным донором аминогруппы служит глутамат.
Суммарно эти реакции можно представить в виде схемы:

Акцептором аминогруппы любой аминокислоты, подвергающейся трансаминированию (аминокислота 1), служит α-кетоглутарат. Принимая аминогруппу, он превращается в глутамат, который способен передавать эту группу любой α-кетокислоте с образованием другой аминокислоты (аминокислота 2).
Аминотрансферазы обладают субстратной специфичностью к разным аминокислотам. В тканях человека обнаружено более 10 разных аминотрансфераз.
Наиболее распространёнными ферментами в большинстве тканей млекопитающих являютсяаланинаминотрансфераза (АЛТ), по обратной реакции - глутамат-пируватаминотрансфераза(ГПТ) и аспартатаминотрансфераза (ACT), по обратной реакции - глутамат-оксалоацетатаминотрансфераза (ГОТ).
АЛТ (АлАТ) катализирует реакцию транса-минирования между аланином и α-кетоглутаратом (см. схему А на с. 472).
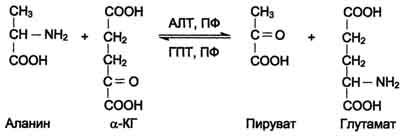
Локализован этот фермент в цитозоле клеток многих органов, но наибольшее его количество обнаружено в клетках печени и сердечной мышцы.
ACT (АсАТ) катализирует реакцию трансами-нирования между аепартатом и α-кетоглутаратом аналогично предыдущей (см. схему Б на с. 472).
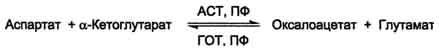
В результате образуются оксалоацетат и глутамат. ACT имеет как цитоплазматическую, так и митохондриальную формы. Наибольшее его количество обнаружено в клетках сердечной мышцы и печени.
Так как наибольшее количество АЛТ и ACT сосредоточено в печени и миокарде, а содержание в крови очень низкое, можно говорить об органоспецифичности этих ферментов.
В результате работы аминотрансфераз аминный азот многих аминокислот переходит в состав глутамата. Есть основания считать, что накопление аминогрупп в форме глутаминовой кислоты происходит в цитозоле. Затем глутамат с помощью транслоказ попадает в митохондрии, где активна специфическая ACT. В результате действия этого фермента глутамат снова превращается в α-кетоглутарат. Последний используется для непрямого дезаминирования аминокислот, содержащихся в митохондриях. Это очень важно, так как только глутамат в тканях млекопитающих наиболее быстро может подвергаться окислительному дезаминированию (см. ниже).
