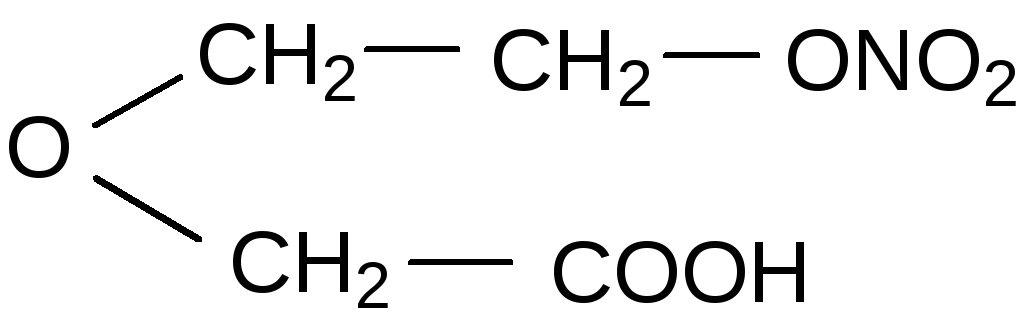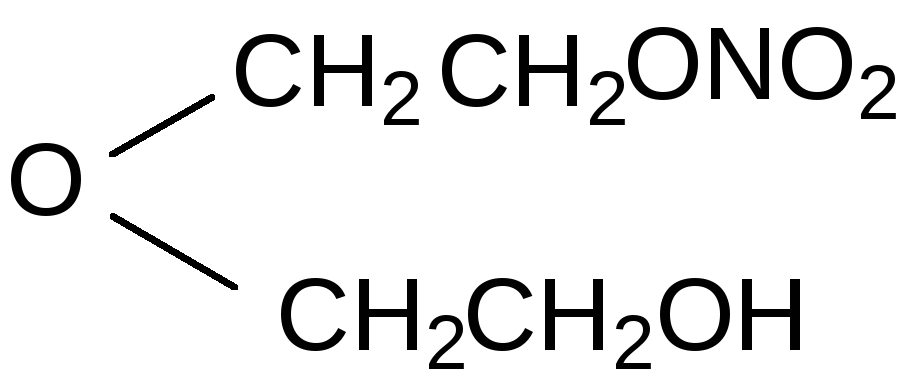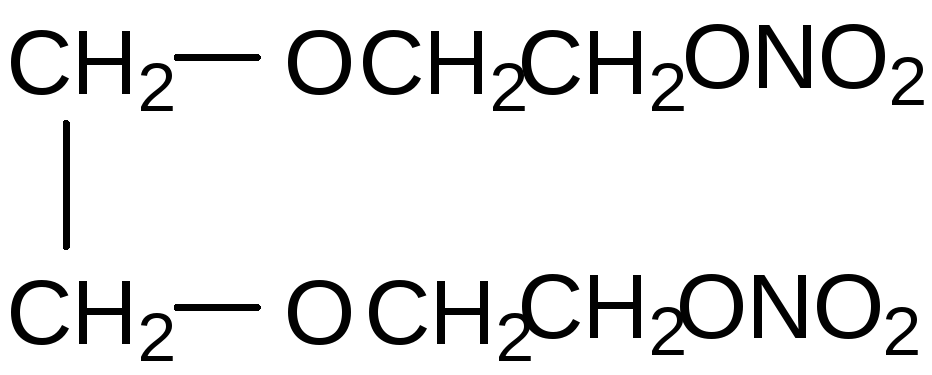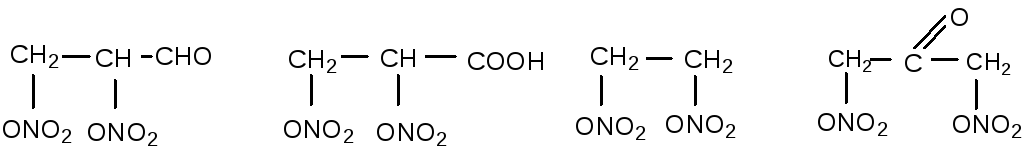- •Бийский технологический институт (филиал)
- •Р.Н. Питеркин, р.Ш. Просвирнин, е.А. Петров технология нитроэфиров и нитроэфирсодержащих промышленных вв
- •Содержание
- •Введение
- •Часть I. Нитроэфиры
- •1 Историческая справка о развитии промышленных способов производства нитроглицерина
- •2 Современные способы производства нитроэфиров
- •2.1 Оптимальные составы кислот и модули нитрации
- •2.2 Инжекторы для осуществления нитрационного
- •2.3 Холодильники для охлаждения эмульсии
- •2.4 Центробежные сепараторы для разделения эмульсии нитроэфир–отработанная кислота
- •2.5 Процесс и оборудование для стабилизации
- •2.6 Весовой дозатор-расходомер нитроэфиров
- •2.7 Насосы для транспортирования отработанных
- •2.8 Технологическая схема производства нитроэфиров в малогабаритном оборудовании
- •3 Вспомогательные стадии процесса производства нитроэфиров
- •3.1 Разложение нитротел в отработанных кислотах
- •3.2 Обезвреживание сточных вод производства
- •3.2.1 Адсорбционный способ обезвреживания
- •3.2.2 Автоклавный способ очистки сточных вод
- •3.2.3 Восстановление нитроэфиров
- •3.2.4 Электрохимический метод обезвреживания
- •3.2.5 Сверхкритическое водное окисление
- •3.3 Приборы для непрерывной оценки качества нитроэфиров
- •I, мA 0,1 % hno3 0,03 % hno3 0,01 % hno3
- •0,2 0,4 0,6 Содержание н2о, %
- •4 Свойства нитроэфиров
- •4.1 Физические свойства нитроэфиров
- •4.2 Взрывчатые свойства нитроэфиров
- •4.3 Поведение нитроэфиров в кислых средах
- •4.3.1 Стойкость кислых нгц, дндэг и их смеси
- •4.3.2 Стойкость кислых динитрата триэтиленгликоля, тринитрата нитроизобутилглицерина и динитрата
- •4.3.3 Влияние воды на стойкость кислых нитроэфиров
- •4.3.4 Влияние серной и азотной кислот
- •4.3.5 Влияние окислов азота
- •4.3.6 Стойкость нгц и дндэг с пониженной
- •4.3.7 Механизм разложения кислых нитроэфиров
- •4.3.8 Разложение нитроэфиров в отработанных
- •4.3.9 Разложение нитротел в слабых отработанных кислотах
- •4.4 Реакции нитроэфиров с основаниями
- •4.4.1 Гидролиз нитроглицерина
- •4.4.2 Гидролиз динитрата этиленгликоля (днэг)
- •4.4.3 Гидролиз динитрата диэтиленгликоля (дндэг)
- •4.5 Причины аварий на производствах нитроэфиров
- •Литература
- •Часть II. Нитроэфирсодержащие взрывчатые вещества
- •5 Технология производства нитроэфирсодержащих взрывчатых веществ
- •5.1 Современные направления развития
- •5.2 Разработка технологии и создание
- •Фаза подготовки компонентов
- •Фаза конечных операций
- •5.3 Автоматизация производства
- •5.4 Экологическая защита производства
- •5.4.1 Разработка эффективных методов
- •5.4.2 Технико-экономические показатели производства
- •6 Оптимизация и модернизация штатных рецептур нитроэфирсодержащих вв
- •6.1 Оптимизация угленита э-6
- •6.2 Исследование предохранительных свойств
- •6.3 Разработка и исследование угленита м – новой рецептуры вв V класса [15]
- •6.4 Модернизация детонита м
- •6.4.1 Разработка рецептуры модернизированного
- •6.4.2 Отработка технологии модернизированного
- •6.4.3 Промышленные испытания модернизированных детонитов [24]
- •7 Некоторые аспекты безопасности нитроэфирсодержащих вв
- •7.1 О химической стабильности и предельных сроках хранения нитроэфирсодержащих промышленных вв
- •7.2 О чувствительности нитроэфирсодержащих
- •7.3 О физической стабильности
- •Литература
- •Сокращения и обозначения
4.4.2 Гидролиз динитрата этиленгликоля (днэг)
Продуктами гидролиза ДНЭГ являются нитрит и нитрат натрия в соотношении от 2,7:1 до 3:1, расход гидроокиси натрия составляет от 2,5 до 2,8 моль на моль ДНЭГ.
Из всех возможных направлений гидролиза ДНЭГ преобладает механизм β-элиминирования водорода с образованием промежуточного нитрата олефина и одновременно меньшая часть ДНЭГ гидролизуется по механизму α-элиминирования водорода до нитрата гликолевого альдегида.
Гидролиз по механизму нуклеофильного замещения до мононитрата этиленгликоля не реализуется, так как этот нитрат гидролизуется только через образование окиси этилена с последующей гидратацией её до этиленгликоля, а при гидролизе ДНЭГ выделение окиси этилена не наблюдается и этиленгликоль отсутствует в продуктах реакции.
Гидролиз ДНЭГ по указанным направлениям должен приводить к нитритам и нитратам в соотношении не более чем 1:1. Фактическое соотношение (2,7–3,0):1 указывает на восстановление нитрат-ионов до нитрит-ионов. Восстановителем в такой системе является очень реакционноспособный кетен, образующийся из нитрата винилового спирта.
Схема щелочного гидролиза ДНЭГ:
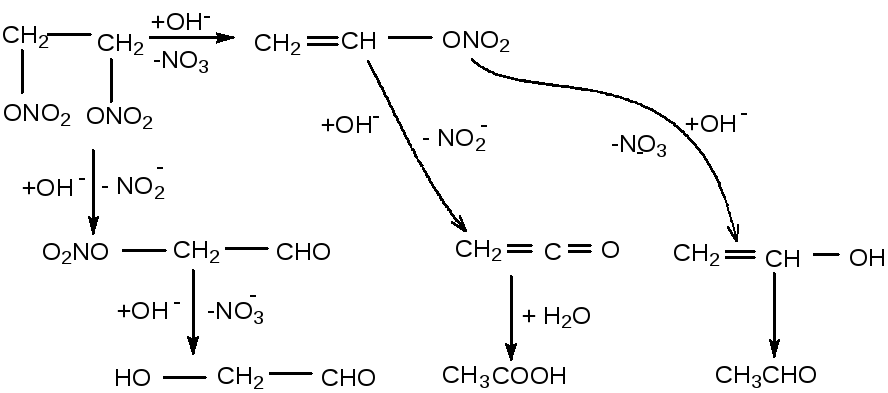
Отдельными экспериментами было показано, что гидролиз нитрата гликолевого альдегида идёт только до гликолевого альдегида с выделением одного моля NaNO3, что отражено на данной схеме.
Константы скорости гидролиза ДНЭГ по указанным направлениям представлены в таблице 4.23.
Таблица 4.23 – Константы скорости гидролиза
ДНЭГ (по расходу щёлочи)
|
Температура ,°C |
K, л/моль·с |
|
60 70 85 |
(3,904,80)·10-4 (1,451,73)·10-3 (5,85,9)·10-3 |
Оценка скорости реакции по накоплению нитритов и нитратов в данном случае неправомерна, т.к. часть нитратов восстанавливалась до нитритов независимо от расходования ДНЭГ на реакцию гидролиза.
4.4.3 Гидролиз динитрата диэтиленгликоля (дндэг)
Поскольку промежуточным продуктом гидролиза ДНДЭГ может быть мононитрат диэтиленгликоля (МНДЭГ), то предварительно была изучена кинетика гидролиза этого нитрата по скорости расходования щёлочи и скорости образования нитрата натрия. Нитрит натрия в растворе не обнаруживается. После завершения реакции гидролиза определяли содержание в растворе диэтиленгликоля с помощью янтарного ангидрида [74] по специально разработанной методике. В целой серии опытов диэтиленгликоль не обнаружен. Кроме того, также анализом с использованием брома не обнаружено образования олефинов.
Количественное определение диоксана газохроматографическим методом показало, что вся навеска МНДЭГ в растворе превращается в диоксан. Следовательно, гидролиз идёт по схеме
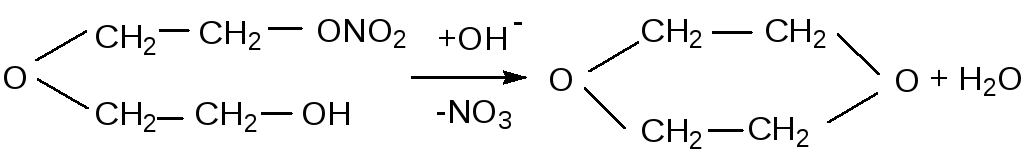
Константа скорости K, л/моль·с:
– при 60 °C 3,16·10-4;
– при 70 °C 7,9·10-4;
– при 75 °C 1,26·10-3;
– при 85 °C 3,16·10-3;
– при 91 °C 5,13·10-3.
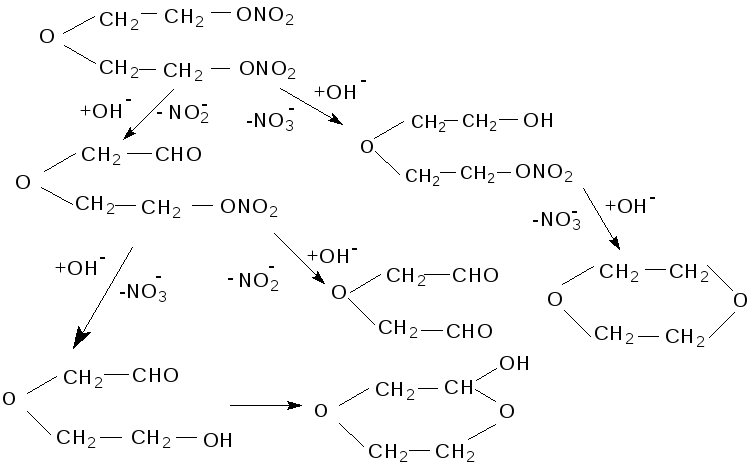
При гидролизе ДНДЭГ, кроме нитрата натрия в количестве 1,35–1,6 моль образуется нитрит натрия 0,40–0,65 моль/моль. Расход щёлочи 2,3–2,45 моль/моль ДНДЭГ.
Олефины в продуктах гидролиза отсутствуют, образуется 0,7–0,8 моль диоксана, а также 0,07–0,2 моль спиртов.
Следовательно, гидролиз ДНДЭГ идёт в двух направлениях: до МНДЭГ и до 1-нитрокси-3-оксопентаналя с соотношением скоростей от 2,5:1 до 4,5:1. Ниже представлена схема гидролиза ДНДЭГ.
Константа скорости гидролиза ДНДЭГ K, л/моль·с:
– при 60 °C – 0,07·10-4;
– при 70 °C – 0,23·10-4;
– при 75 °C – 0,55·10-4;
– при 80 °C – 1,0·10-4;
– при 85 °C – 1,4·10-4.
Гидролиз ДНДЭГ в растворах соды имеет существенные отличия от гидролиза в растворах NaOH. Это ничтожное выделение нитритных ионов. Их количество не превышало 0,062 моль на моль ДНДЭГ, т.е. гидролиз в направлении образования альдегидного производного составляет не более 3 %.
Расход соды сохраняется на уровне 2,3–2,7 моль/моль, как и расход NaOH.
Кроме подавления реакции образования нитрит-ионов в содовом растворе резко увеличена скорость гидролиза.
При 85 °C константа скорости находится в пределах (2,2–6,4)·10-3 л/моль·с, что более чем на порядок выше, чем при гидролизе в растворах гидроокиси натрия.
Аналог ДНДЭГа формаль мононитрата диэтиленгликоля (ФМНЭГ) гидролизуется в растворах NaOH с такими же скоростями, что и ДНДЭГ. Соотношение нитрат- и нитрит-ионов и расход щёлочи также не отличается от этих величин для ДНДЭГ. Это говорит об аналогичном механизме гидролиза этих нитроэфиров.
Подобным образом ведёт себя при щелочном гидролизе динитрат триэтиленгликоля.
В результате экспериментов по кинетике гидролиза 20 представителей нитратных эфиров определены константы скорости гидролиза и направления этих реакций. В таблице 4.24 приведены константы скорости гидролиза при 85 и 70 °C для исследованных нитратных эфиров, где механизм гидролиза обозначен соответствующими символами. Приведены также значения скоростей относительно скорости гидролиза НГЦ, принятой за единицу. Разница в скоростях гидролиза между первым и последним членами в этом ряду нитроэфиров чрезвычайно велика, соотношение скоростей 109.
Таблица 4.24 – Константы скорости щелочного гидролиза нитроэфиров
|
Наименование нитроэфира |
Механизм гидролиза |
Константа скорости, л/моль·с |
Скорость по отношению к НГЦ | ||
|
85 °C |
70 °C |
85 °C |
70 °C | ||
|
1 |
2 |
3 |
4 |
5 |
6 |
|
Нитрат гликолевой кислоты O2NOCH2COOH |
SN2 |
∞ |
– |
∞ |
|
|
Динитрат диоксиацетона
|
SN2+EСО2 |
– |
– |
~10000 |
~10000 |
|
Нитрат гликолевого альдегида O2NO-CH2-CHO |
SN2 |
– |
– |
~1760 |
~1760 |
|
Динитрат глицерина – α,γ O2NO-CH2-CH(OH)CH2ONO2 |
SιN2+SN2 |
97 |
29,1 |
25,5 |
16,6 |
|
Динитрат глицериновой кислоты – α,β
|
ECO2 |
29 |
– |
– |
~16 |
|
Тринитрат нитроизобутилглицерина O2NC(CH2ONO2)3 |
SN2
|
12,9 |
7,1 |
3,4 |
4,0 |
Продолжение таблицы 4.24
|
1 |
2 |
3 |
4 |
5 |
6 |
|
Динитрат глицеринового альдегида
|
E2+SN2 |
– |
5,2 |
– |
3,0 |
|
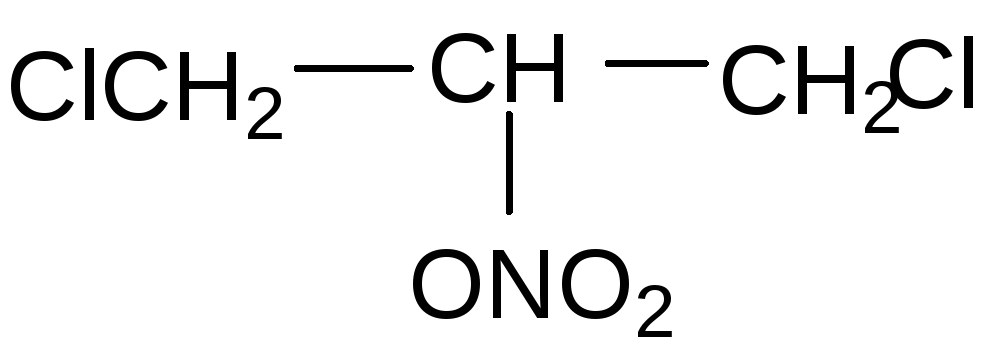
Динитрат хлоргидринглицерина – α,β
|
ECO2+E2 |
– |
3,82 |
– |
2,2 |
|
Нитроглицерин O2NOCH2CH(ONO2)CH2ONO2 |
ECO2 |
3,8 |
1,75 |
1 |
1 |
|
Мононитрат глицерина – α
|
SιN2 |
3,13 |
1,0 |
0,82 |
0,57 |
|
Нитрат глицидола
|
SN2+ гидратация |
3,7 |
0,24 |
0,97 |
0,14 |
Продолжение таблицы 4.24
|
1 |
2 |
3 |
4 |
5 |
6 |
|
Нитрат диэтиленгликолевой кислоты
|
SN2 |
0,91 |
– |
0,24 |
– |
|
Нитрат дихлоргидринглицерина – α
|
E2 |
– |
– |
– |
~0,16 |
|
Нитрат дихлоргидринглицерина – β
|
E2 |
0,1 |
– |
0,026 |
– |
|
Мононитрат этиленгликоля O2NOCH2CH2OH
|
SιN2 |
0,1 |
0,03 |
0,026 |
0,017 |
|
Динитрат этиленгликоля O2NOCH2–CH2ONO2 |
ECO2+E2 |
0,0077 |
0,0017 |
0,002 |
0,001 |
Продолжение таблицы 4.24
|
1 |
2 |
3 |
4 |
5 |
6 |
|
Мононитрат диэтиленгликоля
|
SιN2 |
0,0032 |
0,0008 |
0,00083 |
0,00045 |
|
Динитрат диэтиленгликоля O(CH2CH2ONO2)2 |
SN2+EСО2 |
0,00013 |
0,000023 |
0,000034 |
0,000013 |
|
Формаль мононитрата диэтиленгликоля CH2(OCH2CH2ONO2)2 |
SN2+ECO2 |
0,00013 |
0,000021 |
0,000034 |
0,000013 |
|
Динитрат триэтиленгликоля
|
SN2+ECO2 |
0,00013 |
|
0,000034 |
|
Полученные кинетические данные достаточно убедительно объясняются тремя типами взаимодействия нуклеофильного реагента (гидроксильного иона) с нитроэфирами, которые характерны для представителей простых нитратов [53].
Направление, в котором идёт гидролиз нитроэфира, определяется в первую очередь расположением и доступностью реакционных центров, по которым осуществляется атака гидроксильного иона. Известные реакционные центры для нитроэфиров представлены на схеме:
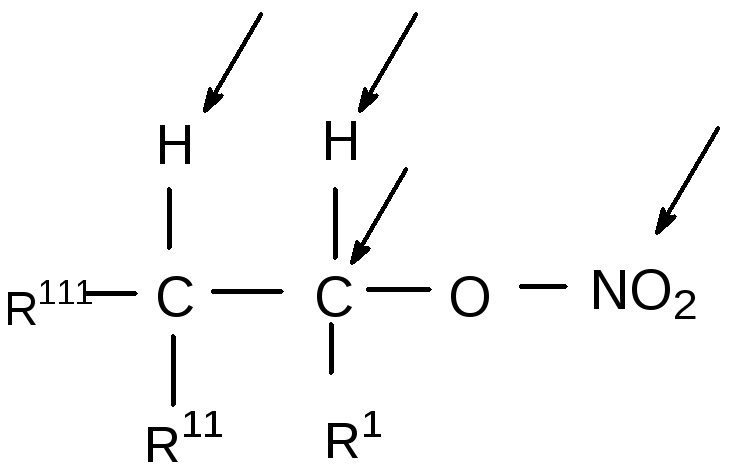
Они дают возможность протекания реакции по механизму β-элиминирования с выделением водорода и нитрат-иона от соседних углеродных атомов (механизм E2 и E1), α-элиминирования с выделением водорода и нитрит-иона от соседних атомов углерода и кислорода (механизм ECO2 или ECO1), нуклеофильного замещения нитратной группы гидроксилом (механизм SN2 или SN1) и по механизму с атакой гидроксила по азоту нитратной группы с выделением азотной кислоты. Последний механизм по своему результату аналогичен нуклеофильному замещению и при анализе кинетических данных нами не рассматривался.
Особую группу по механизму гидролиза представляют неполные нитраты полиспиртов, так как они имеют дополнительный легкодоступный реакционный центр. Это водород гидроксильной группы:
![]()
Здесь рядом с реакционным атомом углерода расположен атом кислорода с неподелённой парой электронов, который после отщепления от него водорода становится сильным нуклеофилом.
Механизм гидролиза таких нитроэфиров аналогичен гидролизу галоид гидринов [75]:
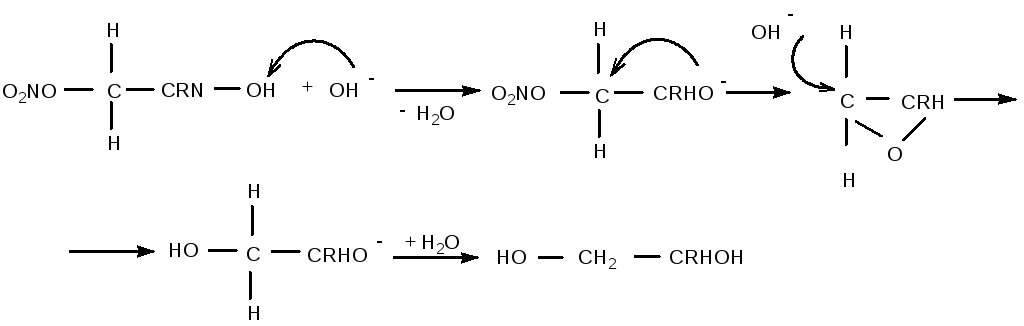
На первой стадии неполный нитрат превращается в алкоксид-ион, который за счёт внутреннего нуклеофильного замещения превращается в окись алкилена или эпоксид. Кольцо затем вновь раскрывается под действием иона OH-, и реакция завершается превращением нитроэфира в спирт.
Изученный ряд неполных нитратов отличается количеством и характером заместителей у углерода, несущего нитратную группу.
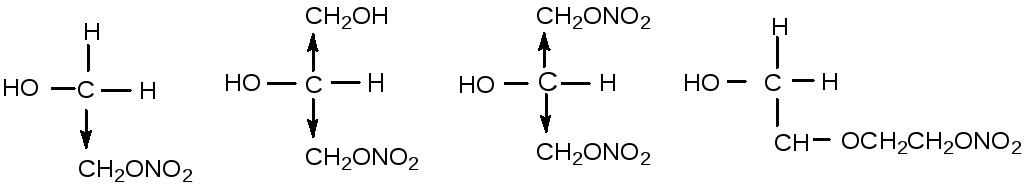
Соотношение констант скорости гидролиза для них равно 1:33,3:485:0,027. У первых трёх представителей этого ряда подвижность водорода гидроксильной группы возрастает из-за наличия электроотрицательных заместителей, повышающих положительный заряд на углероде. У последнего представителя гидроксильная и нитратная группы настолько удалены друг от друга, что индукционный эффект нитратной группы на гидроксильный водород становится незначительным. Казалось бы, что здесь должен реализоваться механизм SN2, но пространственное строение молекулы МНДЭГ затрудняет подход гидроксил-иона к α-углеродному атому со стороны, противоположной расположению нитратной группы. Реализуется атака этого углерода кислородом гидроксильной группы с образованием цикла.
Механизм внутреннего нуклеофильного замещения реализуется у нитратов оксикислот: этилен- и диэтиленгликолевой. Здесь гидролиз обеспечивается отрицательно заряженным кислородом карбоксильной группы:
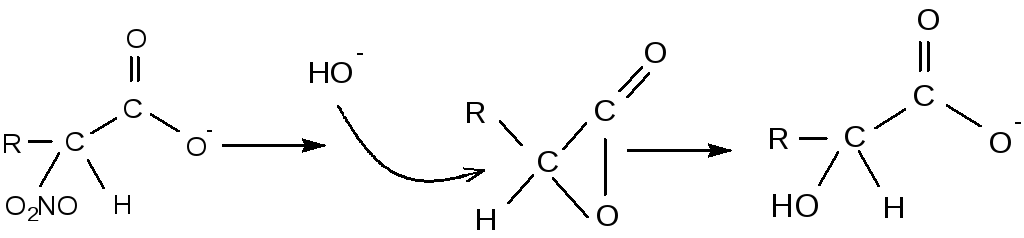
К отдельной группе по механизму щелочного гидролиза относятся нитроэфиры, содержащие по 2 или по 3 нитратные группы у соседних углеродных атомов или же способный к нуклеофильному вытеснению и выделению по механизму элиминирования атом хлора. Ниже представлен этот ряд нитроэфиров с указанием относительной скорости гидролиза и механизма гидролиза:
|
| |||
|
ECO2 1,0 |
ECO2+ E2 2,2 |
E2 0,16 |
E2 0,026 |
|
| |||
|
E2+ SN2 3,0 |
ECO2 16,0 |
E2+ ECO2 0,001 |
ECO2+SN2 10000 |
Первые шесть членов приведённого ряда имеют водород у β-углеродного атома, который отличается высокой подвижностью из-за присутствия сильных электроотрицательных заместителей как непосредственно у β-углерода, так и у соседних атомов углерода. Гидролиз этих нитроэфиров осуществляется за счёт атаки гидроксил-ионом по водороду у центрального углеродного атома. Но результат атаки не одинаков. Так, НГЦ практически нацело гидролизуется с выделением вторичной нитратной группы в виде нитрита. При замене одной нитратной группы атомом хлора наряду с отщеплением нитрита из β-положения отщепляется хлор из γ-положения. Замена хлором второй нитратной группы (β-нитратдихлоргидрин глицерина) ведёт полностью к изменению механизма реакции (E2 вместо ECO2) и снижению скорости реакции. α–Нитратдихлоргидрин глицерина структурно не может гидролизоваться по механизму ECO2, поэтому наблюдается механизм E2 с отщеплением наряду с β-водородом γ-хлора. По E2 механизму гидролизуется динитрат глицеринового альдегида, здесь наличие карбонильной группы делокализует отрицательный заряд на β-углероде и стабилизирует переходное к олефину состояние.
Замена алкильной группы карбоксильной вновь обусловливает прохождение гидролиза по ECO2 механизму.
Для динитрата этиленгликоля скорость гидролиза резко падает, что естественно, так как подвижность водородов здесь ниже, чем β-водорода в молекуле НГЦ. Поскольку обе нитратные группы равноценны, то реализуются оба механизма гидролиза, как E2, так и ECO2.
Приведённые значения констант позволяют оценить потери нитроэфиров за счёт гидролиза в процессе стабилизации содовым раствором в производственной аппаратуре. Такая оценка наиболее целесообразна для НГЦ, гидролизующегося с наибольшей скоростью в ряду штатных нитроэфиров, используемых в промышленности. Нитроэфиры промывают 0,52 %-ными растворами соды, значения pH этих растворов изменяются незначительно от 10,93 до 11,0, т.е. концентрация гидроксил-ионов в них практически постоянна и в зависимости от температуры имеет следующие значения:
|
40 °C |
50 °C |
60 °C |
|
3,8·10-3 моль/л |
5,95·10-3 моль/л |
12,6·10-3 моль/л |
Концентрация НГЦ в содовом растворе по данным [25] в моль/л:
|
|
40 °C |
50 °C |
60 °C |
|
1 % Na2CO3 |
0,00908 |
0,0097 |
0,0106 |
|
2 % Na2CO3 |
0,00767 |
0,0088 |
0,00995 |
В таблице 4.25 представлены результаты расчёта потерь НГЦ в содовом растворе в зависимости от времени контакта.
Расчётные данные проверены экспериментами с 2 %-ным содовым раствором. Результаты близки к приведённым в таблице 4.25 величинам. При 40 °C потери НГЦ невелики, однако с повышением температуры обработки НГЦ содовым раствором до 50 °C ими пренебрегать уже нельзя. Концентрацию соды можно увеличить до 4 %, так как при этом гидролиз замедляется из-за снижения растворимости НГЦ в промывном растворе.
Таблица 4.25 – Потери НГЦ за счёт гидролиза
|
Температура, °C |
Потери в процентах при времени контакта, мин | |||
|
55 |
17 | |||
|
1 % Na2CO3 |
2 % Na2CO3 |
1 % Na2CO3 |
2 % Na2CO3 | |
|
40 50 60 |
0,07 0,25 1,25 |
0,06 0,23 1,17 |
0,022 0,080 0,39 |
0,018 0,072 0,36 |
Скорость гидролиза ДНДЭГ на 4, а ДНЭГ на 3 порядка ниже, чем НГЦ. Поэтому их потери при промывке за счёт гидролиза ничтожны.
Неорганическими продуктами щелочного гидролиза нитроэфиров являются нитрат и нитрит натрия, которые в виде примесей несомненно остаются в промытом нитроэфире. В отработанных промывных водах содержание нитратов и нитритов после каждой промывки приведено в таблице 4.26.
Таблица 4.26 – Концентрация нитрата и нитрита
натрия в промывных водах
|
Номер промывки |
Наименование промывок |
Нитриты, мг/л |
Нитраты, мг/л |
|
1 |
Вода, 20–25 °C |
2,7 |
42500 |
|
2 |
2 %-ный раствор соды, 40–45 °C |
177 |
5870 |
|
3 |
2 %-ный раствор соды, 45–50 °C |
345 |
4170 |
|
4 |
Вода, 30–35 °C |
4,27 |
1000 |
Органическими продуктами щелочного гидролиза НГЦ и ДНДЭГ является сложная смесь веществ, в молекуле которых имеются гидроксильные, карбонильные и карбоксильные группы. Некоторые представители этой группы веществ могут снижать химическую стабильность нитроэфира и, соответственно, изделий из него.
Снижают стойкость НГЦ, определяемую на йодокрахмальной пробе, особенно в процессе хранения, щавелевая кислота, нитраты глицериновой кислоты или продукты её гидролиза и окисления, мононитрат глицерина. Стойкость ДНДЭГ снижает примесь диэтиленгликолевой кислоты.
Анализ стойкости по объективной манометрической пробе показал, что примесями, снижающими стойкость НГЦ, являются глицериновый альдегид, диоксиацетон и органические кислоты.
При стабилизации нитроэфиров щелочными растворами необходимо, по возможности, сокращать длительность нахождения нитроэфира в щелочной среде. Если после часового контактирования НГЦ с 2 %-ным содовым раствором стойкость по йодокрахмальной пробе не изменяется, то по манометрической пробе индукционный период до начала ускоренного разложения при 95 °C сокращается с 18 до 8 часов. Причина в накоплении органических продуктов щелочного гидролиза НГЦ.