
- •Бийский технологический институт (филиал)
- •Р.Н. Питеркин, р.Ш. Просвирнин, е.А. Петров технология нитроэфиров и нитроэфирсодержащих промышленных вв
- •Содержание
- •Введение
- •Часть I. Нитроэфиры
- •1 Историческая справка о развитии промышленных способов производства нитроглицерина
- •2 Современные способы производства нитроэфиров
- •2.1 Оптимальные составы кислот и модули нитрации
- •2.2 Инжекторы для осуществления нитрационного
- •2.3 Холодильники для охлаждения эмульсии
- •2.4 Центробежные сепараторы для разделения эмульсии нитроэфир–отработанная кислота
- •2.5 Процесс и оборудование для стабилизации
- •2.6 Весовой дозатор-расходомер нитроэфиров
- •2.7 Насосы для транспортирования отработанных
- •2.8 Технологическая схема производства нитроэфиров в малогабаритном оборудовании
- •3 Вспомогательные стадии процесса производства нитроэфиров
- •3.1 Разложение нитротел в отработанных кислотах
- •3.2 Обезвреживание сточных вод производства
- •3.2.1 Адсорбционный способ обезвреживания
- •3.2.2 Автоклавный способ очистки сточных вод
- •3.2.3 Восстановление нитроэфиров
- •3.2.4 Электрохимический метод обезвреживания
- •3.2.5 Сверхкритическое водное окисление
- •3.3 Приборы для непрерывной оценки качества нитроэфиров
- •I, мA 0,1 % hno3 0,03 % hno3 0,01 % hno3
- •0,2 0,4 0,6 Содержание н2о, %
- •4 Свойства нитроэфиров
- •4.1 Физические свойства нитроэфиров
- •4.2 Взрывчатые свойства нитроэфиров
- •4.3 Поведение нитроэфиров в кислых средах
- •4.3.1 Стойкость кислых нгц, дндэг и их смеси
- •4.3.2 Стойкость кислых динитрата триэтиленгликоля, тринитрата нитроизобутилглицерина и динитрата
- •4.3.3 Влияние воды на стойкость кислых нитроэфиров
- •4.3.4 Влияние серной и азотной кислот
- •4.3.5 Влияние окислов азота
- •4.3.6 Стойкость нгц и дндэг с пониженной
- •4.3.7 Механизм разложения кислых нитроэфиров
- •4.3.8 Разложение нитроэфиров в отработанных
- •4.3.9 Разложение нитротел в слабых отработанных кислотах
- •4.4 Реакции нитроэфиров с основаниями
- •4.4.1 Гидролиз нитроглицерина
- •4.4.2 Гидролиз динитрата этиленгликоля (днэг)
- •4.4.3 Гидролиз динитрата диэтиленгликоля (дндэг)
- •4.5 Причины аварий на производствах нитроэфиров
- •Литература
- •Часть II. Нитроэфирсодержащие взрывчатые вещества
- •5 Технология производства нитроэфирсодержащих взрывчатых веществ
- •5.1 Современные направления развития
- •5.2 Разработка технологии и создание
- •Фаза подготовки компонентов
- •Фаза конечных операций
- •5.3 Автоматизация производства
- •5.4 Экологическая защита производства
- •5.4.1 Разработка эффективных методов
- •5.4.2 Технико-экономические показатели производства
- •6 Оптимизация и модернизация штатных рецептур нитроэфирсодержащих вв
- •6.1 Оптимизация угленита э-6
- •6.2 Исследование предохранительных свойств
- •6.3 Разработка и исследование угленита м – новой рецептуры вв V класса [15]
- •6.4 Модернизация детонита м
- •6.4.1 Разработка рецептуры модернизированного
- •6.4.2 Отработка технологии модернизированного
- •6.4.3 Промышленные испытания модернизированных детонитов [24]
- •7 Некоторые аспекты безопасности нитроэфирсодержащих вв
- •7.1 О химической стабильности и предельных сроках хранения нитроэфирсодержащих промышленных вв
- •7.2 О чувствительности нитроэфирсодержащих
- •7.3 О физической стабильности
- •Литература
- •Сокращения и обозначения
4.2 Взрывчатые свойства нитроэфиров
Значения бризантности и фугасности некоторых НЭ представлены в таблице 4.10.
Таблица 4.10 – Бризантность по обжатию свинцовых
столбиков и фугасность некоторых нитроэфиров
|
Показатель |
Нитроэфиры | |||
|
НГЦ |
ДНЭГ |
ДНДЭГ |
тринитрат метилэтриола | |
|
Бризантность, мм |
25,4 |
30,0 |
6,5 |
11 |
|
Фугасность, см3 |
590 |
650 |
350 |
340 |
По чувствительности к механическим воздействиям нитроглицерин превосходит другие штатные нитроэфиры. По данным ЛТИ им. Ленсовета (1988 г.) на копре Каста высота падения груза, при которой наблюдается 50 % взрывов представлена в таблице 4.11).
Таблица 4.11 – Чувствительность НЭ к удару на копре Каста
|
Масса груза, кг |
Высота падения H50%, см | ||
|
НГЦ |
ДНДЭГ |
ДНТЭГ | |
|
2 1 |
8,25 - |
72,5 36 |
- 95,0 |
По методу дробного удара [41] при грузе 5 кг высота падения (H50%): для НГЦ 5,6 см, для ДНДЭГ 32 см, для ДНЭГ 17 см.
Принято,
что граница эксплуатационной безопасности
![]() составляет не более 0,12.
составляет не более 0,12.
Кристаллический НГЦ значительно менее чувствителен к удару, чем жидкий. По данным [36] средняя работа для 50 % взрывов при 0 °C равна:
– НГЦ твёрдый (стаб.) 0,650 кгм/см2;
– НГЦ твёрдый (лаб.) 0,784 кгм/см2;
– НГЦ жидкий 0,110 кгм/см2.
Относительная чувствительность к удару нитроэфиров по энергии, дающей 50 % взрывов, представлена в работе [42] (таблица 4.12).
Таблица 4.12 – Относительная чувствительность НЭ к удару
|
Нитроэфир |
Энергия, кгм |
|
Метилнитрат Нитроглицерин Тринитрат 2,3,4-пентантриола ДНЭГ Тринитрат нитроизобутилглицерина Этилнитрат ДНДЭГ ДНТЭГ Изопропилнитрат |
0,20 0,40 0,40 0,46 0,70 1,0 1,44 5,6 10,0 |
Взрывчатые свойства эмульсий НГЦ:вода определялись прямым экспериментом в полевых условиях. Транспортирующим инжектором НГЦ передавали из ёмкости по свинцовому трубопроводу диаметром 35 мм на расстояние 75 м. После приёма 18 кг НГЦ (соотношение вода:НГЦ 1,52:1) проводили его подрыв. Затем после приёма 19,2 кг в бак, в который заранее помещали 1,2 кг НГЦ, также проводили подрыв (соотношение вода:НГЦ 0,94:1). В обоих экспериментах передачи детонации по нитропроводу с эмульсией не происходило. Сделан вывод о том, что эмульсия вода:НГЦ с соотношением по массе 1:1, движущаяся со скоростью не менее 1 м/с, не способна взрываться. ДНДЭГ не взрывается при соотношении 0,6:1 (вода:нитроэфир).
4.3 Поведение нитроэфиров в кислых средах
Чистый, свободный от примесей и воды НГЦ в обычных условиях в химическом отношении является стойким веществом. Но его поведение, как и других нитроэфиров, существенно изменяется в присутствии азотной и серной кислот. В кислой среде нитроэфиры гидролизуются под действием воды до исходного спирта и азотной кислоты. Концентрированная серная кислота сульфирует нитроэфиры. НГЦ и динитрат этиленгликоля мало подвержены действию серной кислоты, но легко гидролизуются, в то время как ДНДЭГ и ДНТЭГ практически почти не подвергаются гидролизу, но чувствительны к действию серной кисло-ты [2]. Сульфоэфиры диэтиленгликоля легко окисляются азотной кислотой.
Сведения о поведении нитроэфиров в кислых средах имеют существенное практическое значение, так как в производственных условиях образуются и довольно длительное время находятся в технологических аппаратах растворы нитроэфиров в смесях серной и азотной кислот (крепкие отработанные кислоты после отделения кислого нитроэфира, слабые отработанные кислоты после первой водной промывки кислого нитроэфира и рабочие нитрующие смеси в инжекторном способе нитрования спиртов) и растворы кислот в нитроэфирах (кислые нитроэфиры после отделения от крепкой и слабой отработанных кислот).
Исследованием стабильности нитроэфиров в указанных растворах с давних времён занимались многие авторы опубликованных работ как за рубежом, так и в нашей стране [43, 44]. Все они отмечают, что в присутствии азотной кислоты и воды идёт гидролиз нитроэфира, сопровождаемый окислением продуктов гидролиза. Окисляются также сульфоэфиры, образовавшиеся под действием серной кислоты.
На примере окисления этанола азотной кислотой в 30–80 %-ной серной кислоте и ацетальальдегида в этой же среде доказан следующий механизм реакций [45]. Гидролиз нитроэфира:
![]()
Окисление спирта:
![]()
Катализ реакции окисления азотистой кислотой:

Наблюдается частичное торможение окислительных реакций с ростом концентрации серной кислоты:
![]()
Нитрозирование альдегида:
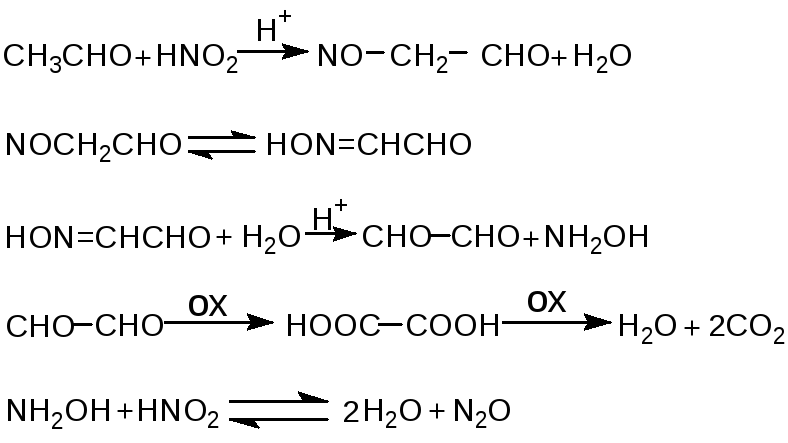
При окислении этанола чётко фиксировали падение концентрации этанола во времени (в 30 %-ной H2SO4 при 25 °C за 110 мин этанол исчезает), рост и затем падение концентрации ацетальдегида, рост концентрации уксусной кислоты и щавелевой кислоты.
Мочевина тормозит, а нитрит натрия ускоряет окисление.
Поведение нитроэфиров в кислых средах, в частности в 45–65 %-ной H2SO4 подробно исследовали авторы [45, 46, 47, 48]. Они по результатам гидролиза этилнитрата и окисления продукта гидролиза этанола предложили механизм процесса, который использовали применительно к нитрогликолю и НГЦ:
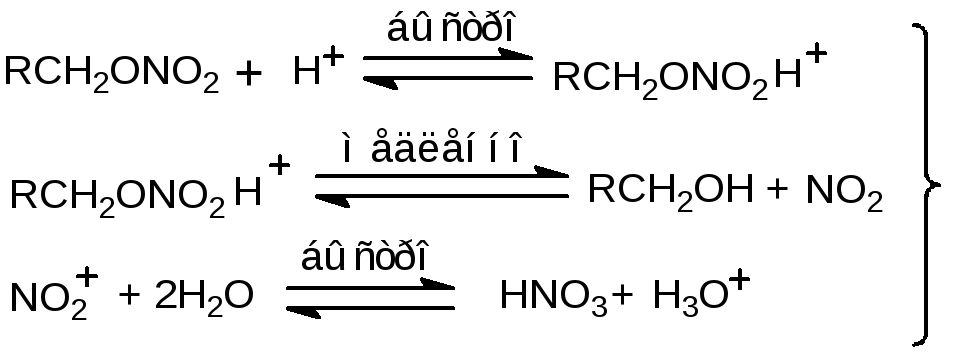
В серной кислоте, даже в присутствии азотной кислоты, нитроэфиры подвержены только гидролизу, скорость которого на порядок выше по сравнению с этилнитратом. Образующиеся спирты медленно окисляются азотной кислотой до альдегида с выделением азотистой кислоты. Как только образовалась азотистая кислота, происходит быстрая реакция, имеющая характер радикальной реакции с разветвлением цепи. Она одна ответственна за наблюдаемое быстрое разложение из-за экзотермичности и соответствующего выделения газа:
![]()
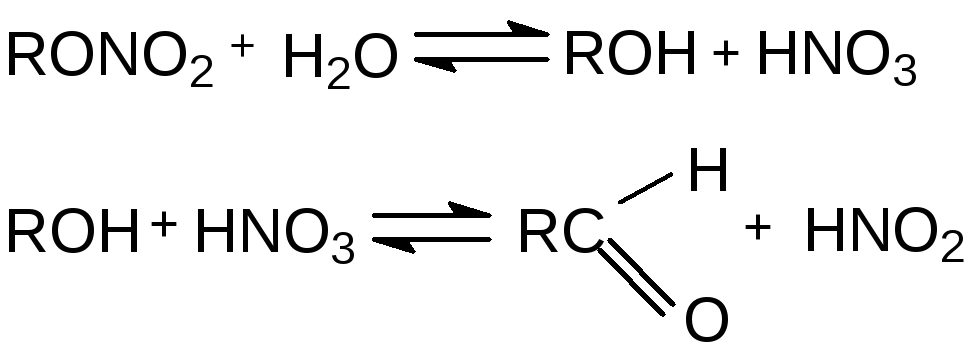
Гидролиз:
![]()
Окисление азотной кислотой:

Последующее окисление альдегидов авторы исследовали на примере ацетальдегида и предложили следующую схему окисления:

В выделяющихся газах содержится N2O, N2, NO, CO2.
В слабых кислотах нитраты превращаются в соответствующие сложные эфиры. Динитрат 3-нитраза-пентандиола-1,5 при кипячении в 97 %-ной муравьиной кислоте в течение нескольких часов превращается в диформиат, который переводили в исходный диол кипячением в метаноле. Выход диола 89 % [49]. С выходом 72 % получен пентаэритрит из тринитрата пентаэритрита.
В уксусной кислоте, содержащей каталитические количества серной кислоты, 1-пентахлорфенилэтилнитрат и пентахлорбензилнитрат переходят в ацетаты [50,51]. Другие бензил нитраты переходят в бензальдегиды:

Обертэн [44] располагает по склонности к окислению различные продукты в следующий ряд: спирты, сульфоэфиры, нитроэфиры. Нитроэфиры окисляются с трудом. Наибольшей окисляющей способностью обладают кислоты, в которых соотношение HNO3:H2SO4 равно единице, а содержание воды около 30 %.
В случае с отработанными кислотами суммарная скорость разложения НГЦ максимальна при содержании воды около 40 %. При окислении органических веществ азотной кислотой образуются окислы азота и азотистая кислота. По мнению большинства исследователей, окислы азота являются причиной автокаталитического разложения нитроэфиров, т.к. они являются более сильными окислителями, чем азотная кислота. Их окислительная способность максимальна при общей концентрации кислот около 60–65 %, где окислы азота находятся в виде четырёхокиси азота N2O4. При более высокой концентрации кислот снижается степень гидролиза нитроэфиров, а окислы азота связываются серной кислотой в нитрозилсерную кислоту:
![]()
Оман определял стойкость кислых нитроэфиров и отработанных кислот, измеряя окислительно-восстановительный потенциал при 70–80 °C, который изменялся с изменением содержания азотистой кислоты. Кислый НГЦ содержит в основном азотную кислоту, содержание которой максимально при мольном соотношении H2O:H2SO4 в отработанной кислоте 1:1. Кроме того, в нём содержится около 1 % динитрата глицерина и около 0,7 % воды. При увеличении соотношения H2O:H2SO4 содержание динитрата и воды возрастает и стойкость НГЦ снижается. Отработанная кислота по сравнению с кислым НГЦ более стойкая. Главными реакциями разложения Оман считает окисление свободных гидроксильных групп до альдегидов и образование нитритов по реакции:
![]()
Эта реакция объясняет влияние окислов азота и азотной кислоты на стойкость: окислы азота сдвигают равновесие реакции в сторону образования нитритов и снижают стойкость кислых нитроэфиров, а азотная кислота снижает содержание нитритов и повышает стойкость продуктов.
Стойкость отработанных кислот исследована более подробно по контролю за содержанием окислов азота или за повышением температуры отработанных кислот. Она зависит от состава кислоты и содержания в ней нитропродуктов. Растворимость НГЦ и ДНЭГ минимальна в кислотах с соотношением H2O:H2SO4 1:1 и снижается с повышением содержания азотной кислоты до 13–15 %. Минимальная растворимость НГЦ 2,3 %.
Большой объём исследований стойкости кислых нитроэфиров и их поведения в кислотных смесях выполнен Шакировым Ф.Г. в ФНПЦ «Алтай». Эти работы отличались тем, что эксперименты с кислыми нитроэфирами и отработанными кислотами проводились при обычных температурах с контролем состава кислотных смесей, содержания нитротел в отработанных кислотах бихроматным методом (определяется сумма всех органических веществ), содержания нитратных эфиров методом восстановления солями двухвалентного железа (в кислых нитроэфирах весовым и колориметрическим методами), содержания окислов азота перманганатным и колориметрическим методами. Потенциометрическим титрованием определялись составы кислот в кислых нитроэфирах.
Качественный состав кислых нитроэфиров и нитротел в отработанных кислотах определён с использованием метода ТСХ.
Предварительно была определена стабильность растворов НГЦ и ДНДЭГ в азотной кислоте. Растворимость нитроэфиров в азотной кислоте в зависимости от концентрации представлена на рисунках 4.1 и 4.2. Там же приведено распределение азотной кислоты между водной и органической фазами. До 20 %-ной концентрации HNO3 растворимость нитроэфиров и распределение HNO3 между фазами пропорциональны концентрации кислоты, выше 20 % растворимость начинает резко возрастать, аналогично возрастает содержание HNO3 в нитроэфире.

Рисунок 4.1 – Растворимость НГЦ и ДНГ в азотной кислоте;
распределение HNO3 между водой и НГЦ
1
2
Рисунок 4.2 – Растворимость ДНДЭГ в азотной кислоте (1),
распределение азотной кислоты между водой и ДНДЭГ (2)
В азотной кислоте с концентрацией выше 90 % нитроэфиры находятся без изменения в течение трёх месяцев, неполные нитраты в этих растворах не обнаруживаются.
При снижении концентрации кислоты до 85 % в НГЦ обнаруживается динитрат глицерина (ДНГл), в 80 % HNO3 уже 40 % НГЦ гидролизуется до ДНГл, в 70 %-ной HNO3 через трое суток весь НГЦ превращается в ДНГл, причём преобладает количественно α,β-ДНГл, (~60 %) частично присутствует мононитрат глицерина (МНГл). Возможно образование глицерина, но разложение таких растворов начинается до достижения равновесия реакции гидролиза.
Гидролиз нитроэфиров сопровождается окислением неполных нитратов с образованием азотистой кислоты:
Скорости обеих реакций определяются концентрацией азотной и азотистой кислоты. Наименее стабильными являются растворы в 60–65 %-ной HNO3. В них нитроэфир начинает разлагаться немедленно. Тогда как в растворах с большей или меньшей концентрацией наблюдается индукционный период до начала окисления, измеряемый, например, для НГЦ в 70 %-ной HNO3 10-ю часами, а для ДНДЭГ одним часом. С ростом концентрации нитроэфира в растворе стойкость его также снижается, особенно это заметно для ДНДЭГ.
Окислы азота ускоряют окисление неполных нитратов. В безводной азотной кислоте НГЦ начинает заметно разлагаться при содержании окислов азота выше 10 %. Причём в таком растворе 20 % НГЦ превращено в α,γ-ДНГл, тогда как α,β-ДНГл и МНГл обнаруживаются только в следовых количествах. Источником α,γ- ДНГл здесь является органический нитрит:
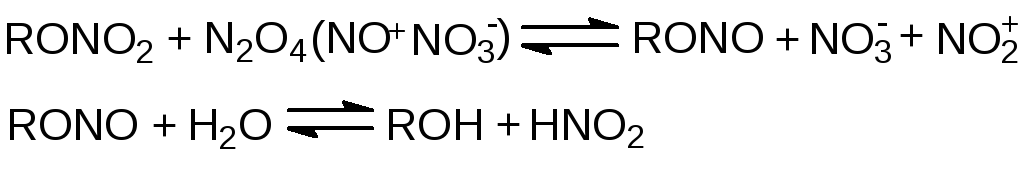
ДНДЭГ в смеси 82 % HNO3 и 18 % N2O4 сразу же превращается в динитрит, который в течение нескольких суток окисляется до дигликолевой кислоты.
При окислении нитроэфиров в азотной кислоте промежуточными продуктами являются альдегиды, нитраты оксикислот и в конечном итоге НГЦ и ДНЭГ с количественным выходом превращаются в щавелевую кислоту, а ДНДЭГ в дигликолевую кислоту.
В серной кислоте НГЦ и ДНДЭГ растворяются постепенно. Скорость растворения и растворимость снижаются со снижением концентрации H2SO4. В 60 %-ной H2SO4 0,5 % НГЦ удалось растворить только после длительного перемешивания, тогда как в 96 %-ной H2SO4 за 2 мин растворилось 8 % НГЦ. ДНДЭГ растворяется в серной кислоте значительно быстрее. Процессы растворения заключаются в одновременной переэтерификации нитроэфиров с образованием сульфоэфиров. Например, при растворении 5 % НГЦ или ДНДЭГ в 96 %-ной H2SO4 выделяется около 2 моль HNO3 из 1 моль нитроэфира, что указывает на образование дисульфата МНГл и дисульфата диэтиленгликоля. Со снижением концентрации H2SO4 степень сульфирования снижается. Образуются кроме дисульфатов моносульфаты ДНГл и МНДЭГ. Так же идёт гидролиз нитроэфиров
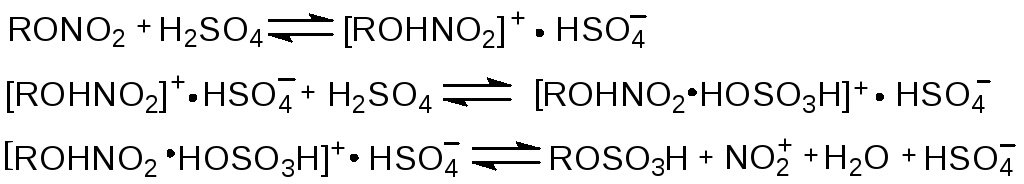
Определяющая cкорость реакции является стадия 3. Сульфоэфиры также участвуют в реакциях гидролиза и окисления.
Стойкость растворов нитроэфиров в серной кислоте значительно выше, чем в азотной кислоте, так как склонность к окислению сульфоэфиров ниже, чем спиртов. Также здесь окислы азота связаны в нитрозилсерную кислоту.
